Солі соляної кислоти. З хлоридів
найбільше використовують хлорид
натрію і хлорид калію. Хлорид
натрію
(кухонну сіль) виділяють з озерної та
морської води, а також
добувають у соляних
шахтах. Кухонну сіль
використовують у їжу. У
промисловості хлорид натрію
служить сировиною для отримання
хлору, гідроксиду натрію і соди.
Хлорид калію використовують у
сільському господарстві як калійне добриво.
Солі соляної кислоти. З хлоридів
найбільше використовують хлорид
натрію і хлорид калію. Хлорид натрію
(кухонну сіль) виділяють з озерної та
морської води, а також
добувають у соляних
шахтах. Кухонну сіль
використовують у їжу. У
промисловості хлорид натрію
служить сировиною для отримання
хлору, гідроксиду натрію і соди.
Хлорид калію використовують у
сільському господарстві як калійне добриво.
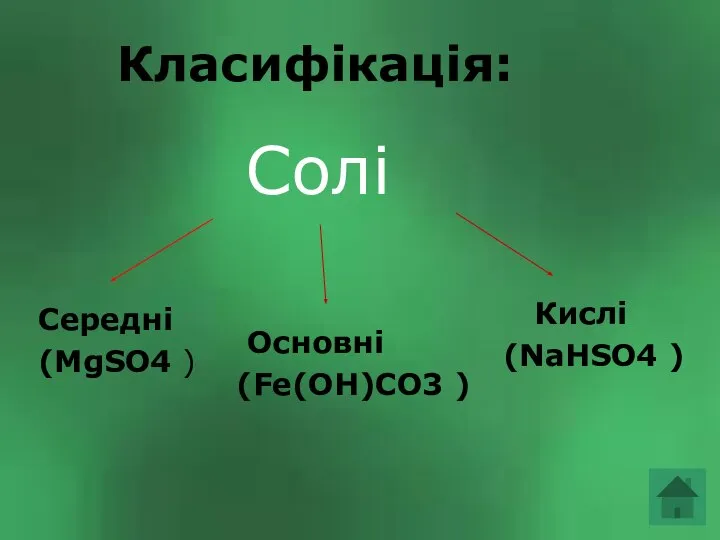
Використання:











 Реакции замещения и реакции обмена
Реакции замещения и реакции обмена Федотова Елена Анатольевна – учитель химии
Федотова Елена Анатольевна – учитель химии  Агрегирование ПАВ в воде и неполярных растворителях
Агрегирование ПАВ в воде и неполярных растворителях Карбонільні сполуки. Альдегіди і кетони
Карбонільні сполуки. Альдегіди і кетони Радиоактивные превращения . Закон радиоактивного распада.
Радиоактивные превращения . Закон радиоактивного распада. Материаловедение. Строение и основные свойства материалов
Материаловедение. Строение и основные свойства материалов Биохимия белковых гормонов
Биохимия белковых гормонов железо
железо Едкость Coca-Cola
Едкость Coca-Cola Классы неорганических веществ
Классы неорганических веществ Роль органической химии в жизни человека. Выполнила Чабан Выполнила ученица 10 «б» класса МОУ «СОШ р.п. Озинки» Чабан Мария
Роль органической химии в жизни человека. Выполнила Чабан Выполнила ученица 10 «б» класса МОУ «СОШ р.п. Озинки» Чабан Мария  Олимпиада по фармацевтической химии. Своя игра
Олимпиада по фармацевтической химии. Своя игра Периодический закон Д.И.Менделеева (1834-1907г.г.)
Периодический закон Д.И.Менделеева (1834-1907г.г.) Электрохимические методы анализа: потенциометрия. Потенциометрическое титрование
Электрохимические методы анализа: потенциометрия. Потенциометрическое титрование Тепловой эффект химических реакций 8 класс
Тепловой эффект химических реакций 8 класс Подгруппа азота
Подгруппа азота Энергетика химических реакций. Лекция 4
Энергетика химических реакций. Лекция 4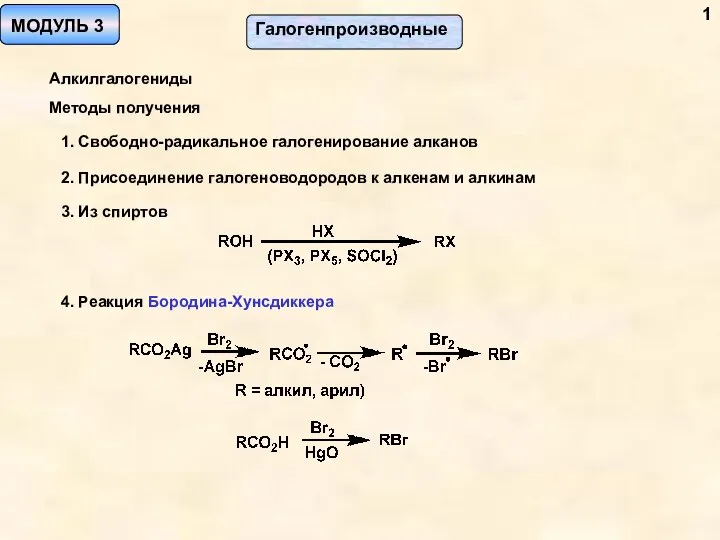 Галогенпроизводные. Алкилгалогениды. Методы получения. (Модуль 3)
Галогенпроизводные. Алкилгалогениды. Методы получения. (Модуль 3) Кристалічні та аморфні тіла. Рідкі кристали та їх властивості
Кристалічні та аморфні тіла. Рідкі кристали та їх властивості Требования к осадителю
Требования к осадителю Пищевые добавки Они повсюду…
Пищевые добавки Они повсюду…  Феромагнетики До феромагнетики (ferrum - залізо) належать речовини, магнітна сприйнятливість яких позитивна і досягає значень. Н
Феромагнетики До феромагнетики (ferrum - залізо) належать речовини, магнітна сприйнятливість яких позитивна і досягає значень. Н Занимательные опыты
Занимательные опыты Жизнь есть способ существования белковых тел
Жизнь есть способ существования белковых тел Каталитический крекинг
Каталитический крекинг Графен. Нобелевская премия 2016
Графен. Нобелевская премия 2016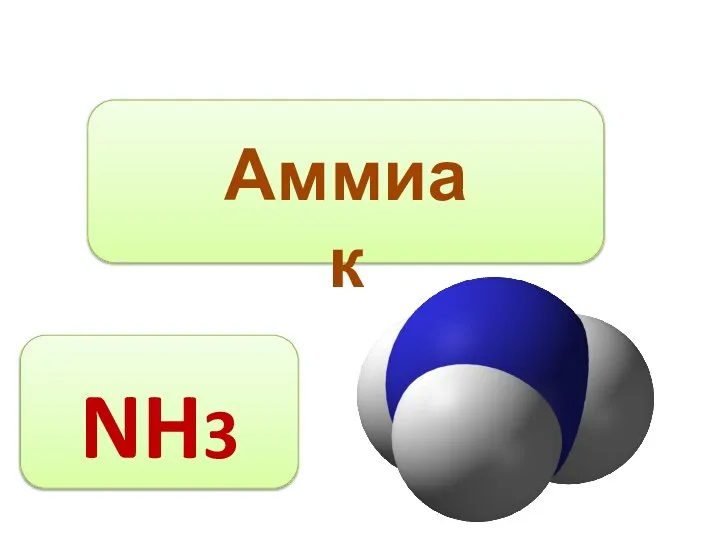 Состав вещества
Состав вещества Металлическая связь. Агрегатные состояния вещества
Металлическая связь. Агрегатные состояния вещества