Презентация по Химии "Строение атома и периодическая система химических элементов" - скачать смотреть
Содержание
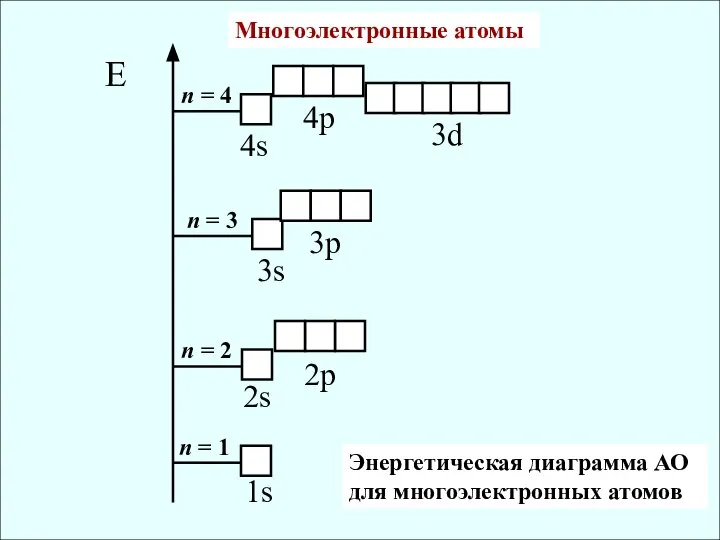
- 2. Е 1s 3s 4s 3p 4p 3d n = 1 n = 2 n = 3
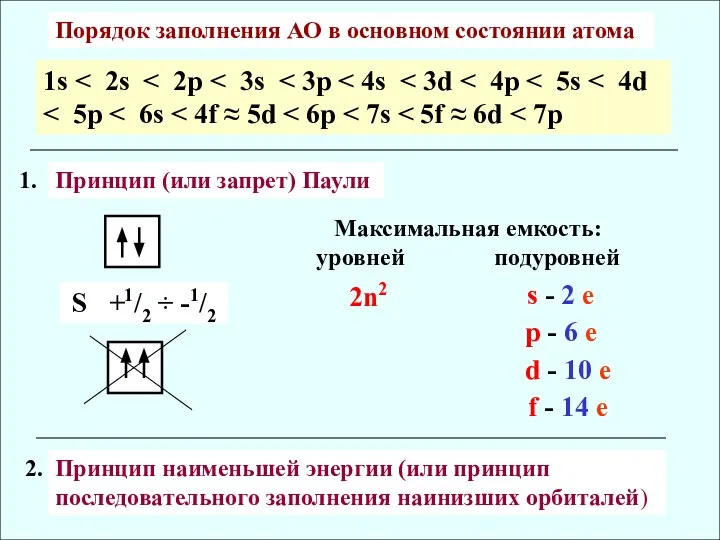
- 3. 1s Порядок заполнения АО в основном состоянии атома S +1/2 ÷ -1/2 Принцип (или запрет) Паули
- 4. Правило Хунда При данном значении l (т.е. в пределах одного подуровня) электроны располагаются таким образом, чтобы
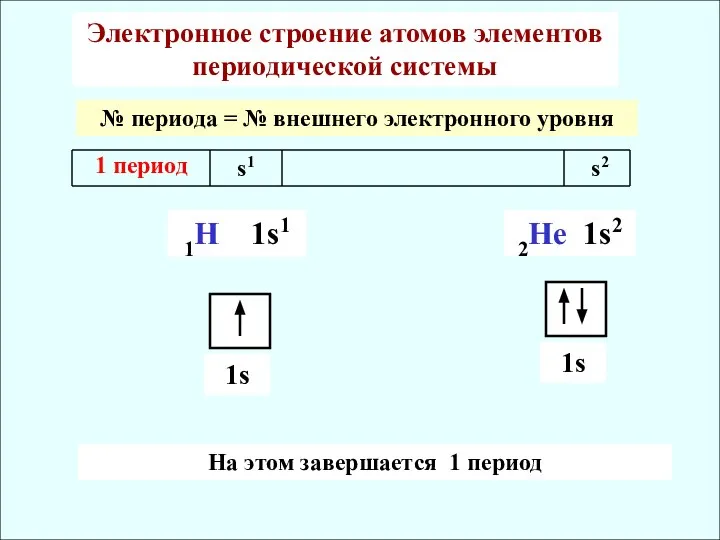
- 5. Электронное строение атомов элементов периодической системы № периода = № внешнего электронного уровня 1 период s1
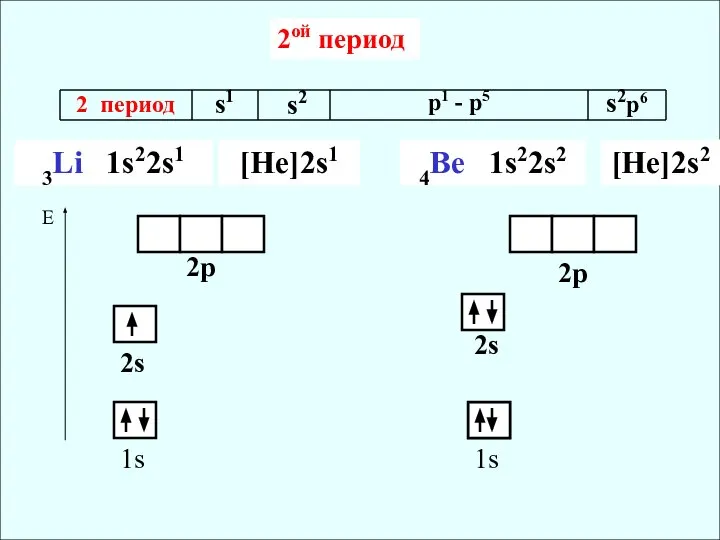
- 6. 2 период s1 s2 p1 - p5 s2p6 3Li 1s22s1 1s 2s 2p 4Be 1s22s2 1s
- 7. 5В 1s22s22p1 1s 2s 2p 6C 1s22s22p2 1s 2s 2p Противоречит правилу Хунда [He]2s22p1 [He]2s22p2 E
- 8. 7N 1s22s22p3 8O 1s22s22p4 1s 2s 2p 1s 2s 2p [He]2s22p3 [He]2s224 E
- 9. 9F 1s22s22p5 10Ne 1s22s22p6 1s 1s 2s 2p [He]2s22p5 [He]2s22p6 = [Ne]
- 10. 3ий период 3 период s1 s2 p1 - p5 s2p6 11Na 1s22s22p63s1 12Mg 1s22s22p63s2 13Al 1s22s22p63s23p1
- 11. 4ый период энергия 3d К [Ar] 4s1 Ca [Ar] 4s2 Sc [Ar] 3d14s2 Ti [Ar] 3d24s2
- 12. Ga [Ar] 3d104s24p1 Ni [Ar] 3d84s2 Cu [Ar] 3d104s1 Zn [Ar] 3d104s2 …………………… Kr [Ar] 3d104s24p6
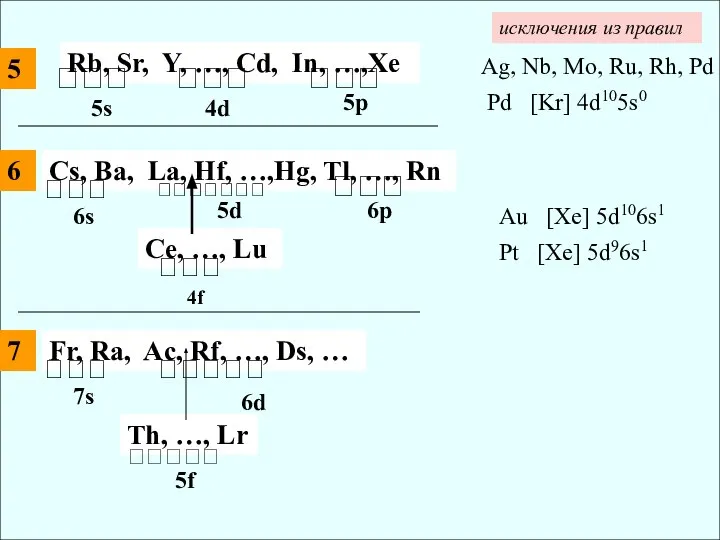
- 13. Rb, Sr, Y, …, Cd, In, …,Xe 5s 4d 5p Cs, Ba, La,
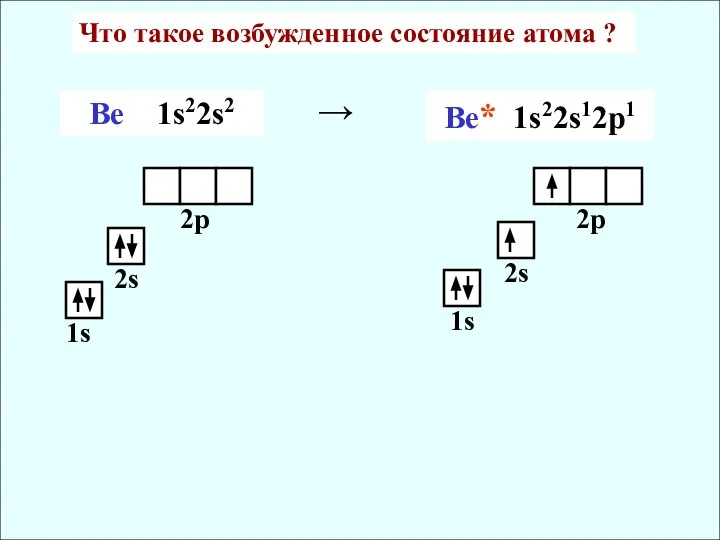
- 14. Что такое возбужденное состояние атома ? Ве 1s22s2 Be* 1s22s12p1 → 1s 2s 2p 1s 2s
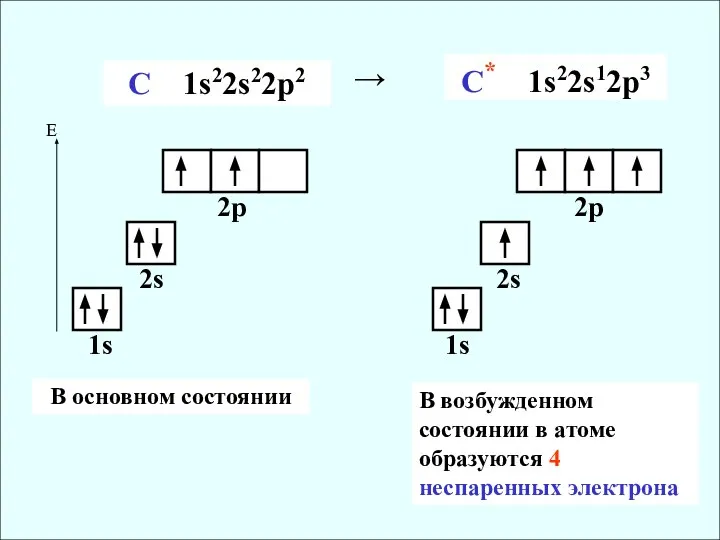
- 15. С 1s22s22p2 C* 1s22s12p3 → 1s 2s 2p 1s 2s 2p В возбужденном состоянии в атоме
- 16. N 1s22s22p3 NCl5 P [Ne] 3s23p3 3s 3p 3d P* [Ne] 3s13p33d1 → PCl5 У атома
- 17. Парамагнитные и диамагнитные свойства веществ Zn [Ar] 3d104s2 Cr [Ar] 3d54s1 Диамагнитные свойства Парамагнитные свойства
- 18. 1. По горизонтали – периоды. Всего 7 периодов. 2. По вертикали – группы. Всего 8 групп.
- 19. s - элементы IA, IIA [благ.газ]nsх х= 1,2 n - № периода х - № подгруппы
- 20. d - элементы IB - VIIIB [благ.газ](n-1)dxnsy x=1-10, y=2,1 n = 4, … х + y
- 21. Sb (Z = 51) 1s22s22p63s23p64s23d104p65s25p3 электроны внутренних оболочек валентные электроны [Kr]5s25p3 Сурьма Степени окисления: -3 -2
- 22. Цирконий Zr (Z = 40) 1s22s22p63s23p64s23d104p65s24d2 электроны внутренних оболочек валентные электроны [Kr]4d25s2 4d 5s Степени окисления:
- 23. Правило октета На орбитали с n = 2 общее число е = 8 (2s22p6) На орбитали
- 24. N [He]2s22p3 N-3 [He]2s22p6 N + 3е = N3- C*[He]2s12p3 C [He]2s22p6 Правило октета – инструмент
- 26. Скачать презентацию

![5В 1s22s22p1 1s 2s 2p 6C 1s22s22p2 1s 2s 2p Противоречит правилу Хунда [He]2s22p1 [He]2s22p2 E](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1180398/slide-6.jpg)
![7N 1s22s22p3 8O 1s22s22p4 1s 2s 2p 1s 2s 2p [He]2s22p3 [He]2s224 E](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1180398/slide-7.jpg)
![9F 1s22s22p5 10Ne 1s22s22p6 1s 1s 2s 2p [He]2s22p5 [He]2s22p6 = [Ne]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1180398/slide-8.jpg)

![4ый период энергия 3d К [Ar] 4s1 Ca [Ar] 4s2 Sc](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1180398/slide-10.jpg)
![Ga [Ar] 3d104s24p1 Ni [Ar] 3d84s2 Cu [Ar] 3d104s1 Zn [Ar]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1180398/slide-11.jpg)
![N 1s22s22p3 NCl5 P [Ne] 3s23p3 3s 3p 3d P* [Ne]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1180398/slide-15.jpg)
![Парамагнитные и диамагнитные свойства веществ Zn [Ar] 3d104s2 Cr [Ar] 3d54s1 Диамагнитные свойства Парамагнитные свойства](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1180398/slide-16.jpg)

![s - элементы IA, IIA [благ.газ]nsх х= 1,2 n - №](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1180398/slide-18.jpg)
dxnsy x=1-10, y=2,1 n =](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1180398/slide-19.jpg)
![Sb (Z = 51) 1s22s22p63s23p64s23d104p65s25p3 электроны внутренних оболочек валентные электроны [Kr]5s25p3](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1180398/slide-20.jpg)


![N [He]2s22p3 N-3 [He]2s22p6 N + 3е = N3- C*[He]2s12p3 C](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1180398/slide-23.jpg)
 Общая и неорганическая химия
Общая и неорганическая химия Гетероциклические соединения
Гетероциклические соединения Биохимия минерализованных тканей зуба. (Тема 10)
Биохимия минерализованных тканей зуба. (Тема 10) Жидкие вещества
Жидкие вещества  Алкалоїди. Поняття «алкалоїди» і їх функції
Алкалоїди. Поняття «алкалоїди» і їх функції Презентация по Химии "Моющие и чистящие средства" - скачать смотреть
Презентация по Химии "Моющие и чистящие средства" - скачать смотреть  Електрофорез
Електрофорез Оксиди
Оксиди - Это оружие массового поражения, действие которого основано на токсических свойствах химических веществ. - Это оружие массового
- Это оружие массового поражения, действие которого основано на токсических свойствах химических веществ. - Это оружие массового  Свойства, получение и применение алканов. Циклоалканы
Свойства, получение и применение алканов. Циклоалканы Структурные превращения стали 15Х5М при различных режимах термической обработки
Структурные превращения стали 15Х5М при различных режимах термической обработки Металлы побочных подгрупп
Металлы побочных подгрупп Викторина Своя игра по химии
Викторина Своя игра по химии Диаграммы состояния двухкомпонентных систем типа твердое тело – жидкость
Диаграммы состояния двухкомпонентных систем типа твердое тело – жидкость Химические волокна. Полиэфирные волокна. Лавсан
Химические волокна. Полиэфирные волокна. Лавсан Periodic Table of the Elements
Periodic Table of the Elements Белки. Строение аминокислот
Белки. Строение аминокислот Dzeramā ūdens sagatavošanas shēma
Dzeramā ūdens sagatavošanas shēma ЛР и ЛРС содержащие фитоэкдизоны
ЛР и ЛРС содержащие фитоэкдизоны а) oleum vitrioli – купоросное масло б) oleum sulfusis – серное масло
а) oleum vitrioli – купоросное масло б) oleum sulfusis – серное масло Свойства катализатора. Промотирование и модифицирование
Свойства катализатора. Промотирование и модифицирование Такой разный песок Выполнила: Гайдукова Екатерина, 10 класс
Такой разный песок Выполнила: Гайдукова Екатерина, 10 класс  Определение нитратов в овощах, произрастающих на территории Уфимского района Республики Башкортостан
Определение нитратов в овощах, произрастающих на территории Уфимского района Республики Башкортостан Количественный масс-спектрометрический анализ
Количественный масс-спектрометрический анализ Химические элементы. Относительная атомная масса химических элементов
Химические элементы. Относительная атомная масса химических элементов Изомерия биоорганических соединений. Структура и функции биолекул
Изомерия биоорганических соединений. Структура и функции биолекул Получение, собирание, распознавание газов. (Практическая работа 2)
Получение, собирание, распознавание газов. (Практическая работа 2) Алкены
Алкены