Содержание
- 2. Исторические сведения Серная кислота известна с древности. Первое упоминание о кислых газах, получаемых при прокаливании квасцов
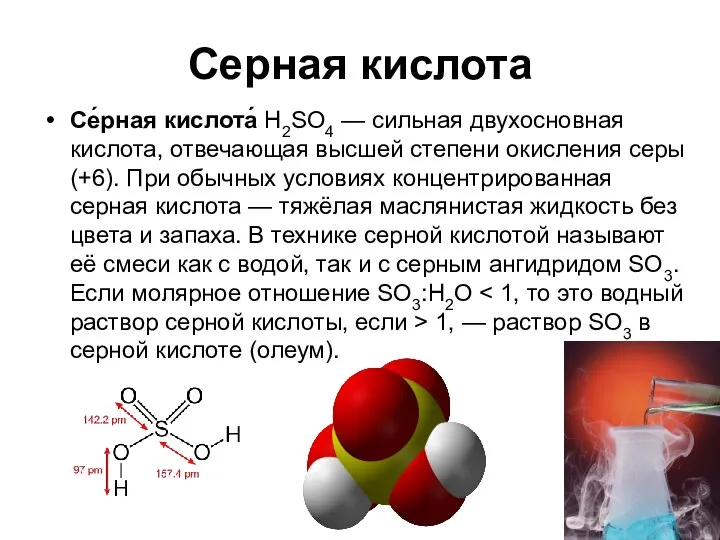
- 3. Серная кислота Се́рная кислота́ H2SO4 — сильная двухосновная кислота, отвечающая высшей степени окисления серы (+6). При
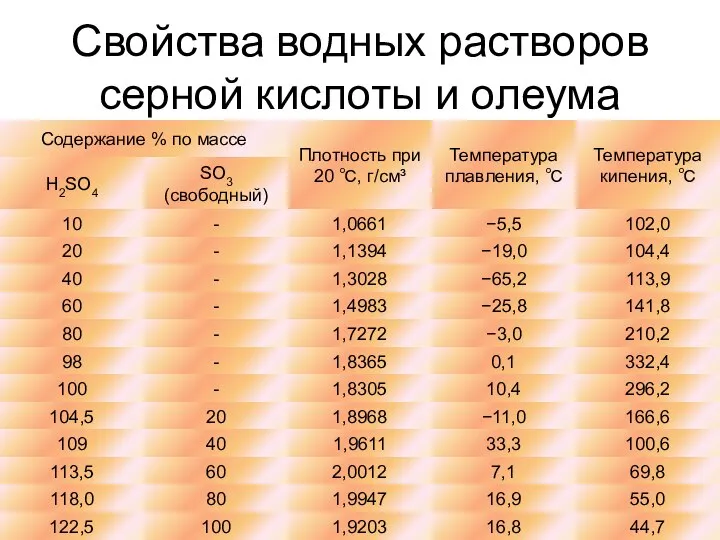
- 4. Свойства водных растворов серной кислоты и олеума
- 5. Химические свойства Mg + H2SO4 → MgSO4 + H2↑ Cu + H2SO4 → CuO + H2SO4
- 6. Токсическое действие Серная кислота и олеум — очень едкие вещества. Они поражают кожу, слизистые оболочки, дыхательные
- 7. Серную кислоту применяют: в производстве минеральных удобрений; как электролит в свинцовых аккумуляторах; для получения различных минеральных
- 8. Стандарты серной кислоты Кислота серная техническая ГОСТ 2184—77 Кислота серная аккумуляторная. Технические условия ГОСТ 667—73 Кислота
- 9. Производство серной кислоты Получение серной кислоты (т.н. купоросное масло) из железного купороса - термическое разложение сульфата
- 10. Основные стадии получения серной кислоты: 1) Обжиг сырья с получением SO2 2) Окисление SO2 в SO3
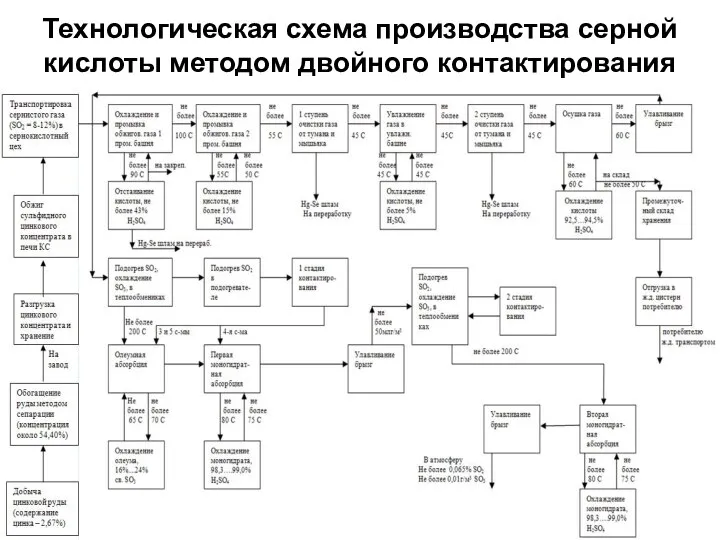
- 11. Технологическая схема производства серной кислоты методом двойного контактирования
- 13. SO2 + ½O2 SO3 + Q
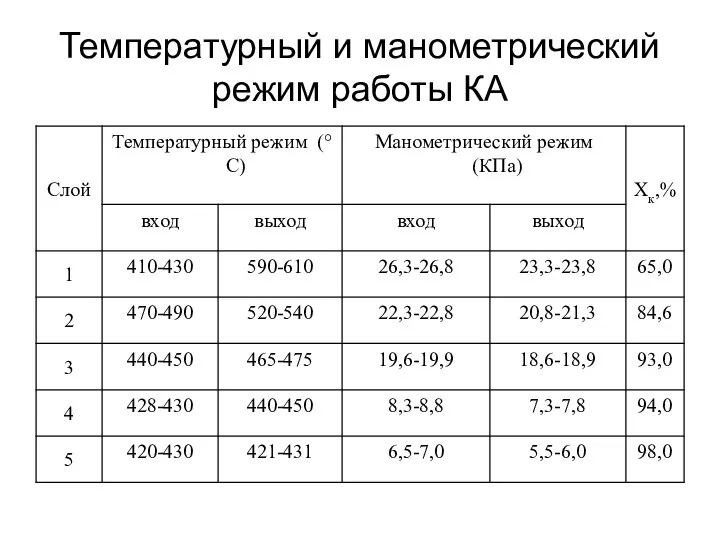
- 15. Температурный и манометрический режим работы КА
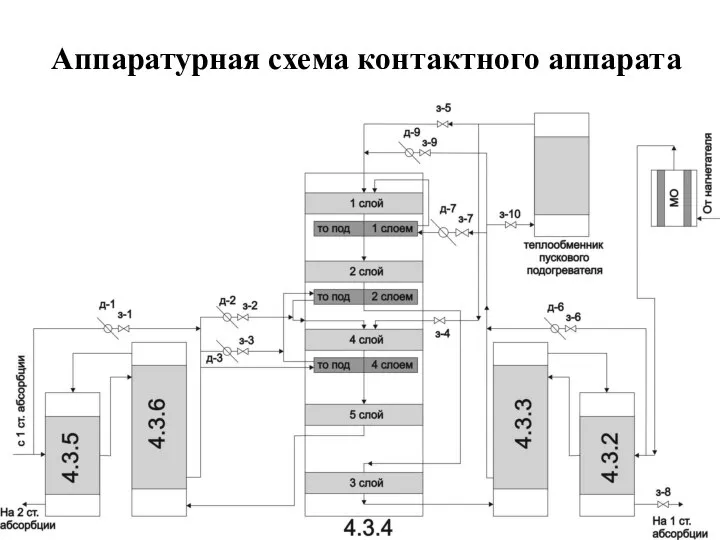
- 16. Аппаратурная схема контактного аппарата
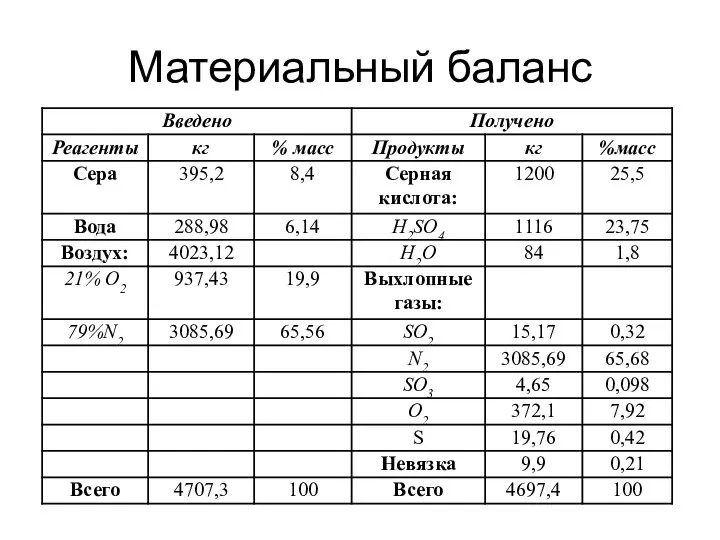
- 17. Материальный баланс
- 18. Заключение В производстве H2SO4 соблюдены основные направления развития химической промышленности: Технология малоотходная – переход сырья в
- 20. Скачать презентацию








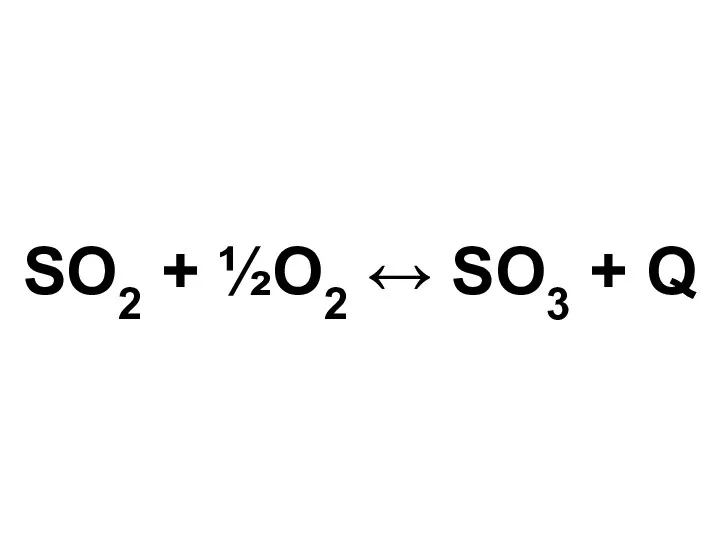


 ХИМИЯ – ЭТО ОБЛАСТЬ ЧУДЕС. О, сколько нам, открытий чудных, готовит просвещенья дух, и опыт сын, ошибок трудных, и гений парадо
ХИМИЯ – ЭТО ОБЛАСТЬ ЧУДЕС. О, сколько нам, открытий чудных, готовит просвещенья дух, и опыт сын, ошибок трудных, и гений парадо Железо Составил: учитель химии МОУ «Средняя общеобразовательная школа №92 с углубленным изучением отдельных предметов» Б
Железо Составил: учитель химии МОУ «Средняя общеобразовательная школа №92 с углубленным изучением отдельных предметов» Б Способ вызвать быструю, но контролируемую коррозию железа
Способ вызвать быструю, но контролируемую коррозию железа Биогеохимия Оренбургской области
Биогеохимия Оренбургской области Физическая технология топлива. Направления переработки нефти. Классификация нефтепродуктов
Физическая технология топлива. Направления переработки нефти. Классификация нефтепродуктов Презентация по Химии "Грегор Иоганн Мендель" - скачать смотреть
Презентация по Химии "Грегор Иоганн Мендель" - скачать смотреть  Аттестационная работа. Сравнение механизма действия некоторых популярных антацидных лекарственных препаратов
Аттестационная работа. Сравнение механизма действия некоторых популярных антацидных лекарственных препаратов Композиционные материалы
Композиционные материалы Колебания кристаллической решетки и ее тепловые свойства. Динамика решетки
Колебания кристаллической решетки и ее тепловые свойства. Динамика решетки Бродильні мікроорганізми і бродіння. Лекція 5
Бродильні мікроорганізми і бродіння. Лекція 5 Природные и попутные нефтяные газы
Природные и попутные нефтяные газы Лабораторная посуда и оборудование
Лабораторная посуда и оборудование Мембранные липиды: строение и функции
Мембранные липиды: строение и функции Гигиеническое нормирование. Принципы гигиенического нормирования
Гигиеническое нормирование. Принципы гигиенического нормирования Водород.Способы получения. Физические свойства
Водород.Способы получения. Физические свойства Коррозия металлов
Коррозия металлов АТФ (Аденозинтрифосфат)
АТФ (Аденозинтрифосфат) Железо. Строение атома железа
Железо. Строение атома железа Фосфор и его соединения
Фосфор и его соединения Положение тугоплавких металлов в Периодической системе элементов
Положение тугоплавких металлов в Периодической системе элементов Учение о растворах. Буферные растворы
Учение о растворах. Буферные растворы Презентація з хімії на тему: “Захист довкілля від забруднення шкідливих мійних засобів» учениці 7(11)Б класу Одеського НВК №13 Бургелі Наталії
Презентація з хімії на тему: “Захист довкілля від забруднення шкідливих мійних засобів» учениці 7(11)Б класу Одеського НВК №13 Бургелі Наталії  Аморфные сплавы
Аморфные сплавы Химия p-элементов
Химия p-элементов Газификация тяжёлых нефтяных остатков. Конверсия природного газа
Газификация тяжёлых нефтяных остатков. Конверсия природного газа Методы разделения и концентрирования. Жидкостная экстракция органических соединений. (Лекция 2)
Методы разделения и концентрирования. Жидкостная экстракция органических соединений. (Лекция 2) Минералы горных пород
Минералы горных пород Алюміній
Алюміній