§ Расчет кривой титрования слабой
кислоты сильным основанием
Необходимо учитывать следующие факторы:
а)
Слабая кислота диссоциирует частично
б) На участке 0 < τ < 100 % в процессе титрования образуется буферный раствор
в) В точке эквивалентности образуется соль, подвергающаяся гидролизу
Пример: СH3COOH + NaOH = СH3COONa + HOH
Условные обозначения:
С0, К – исходная концентрация кислоты
V0, К – исходный объем кислоты
СЩ – концентрация щелочи
VЩ – объем щелочи
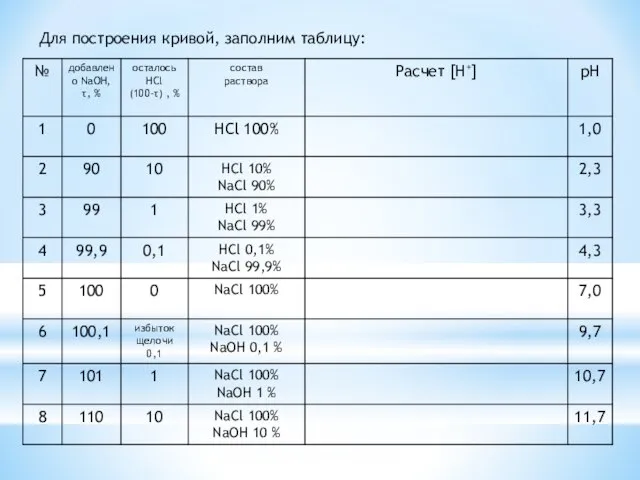
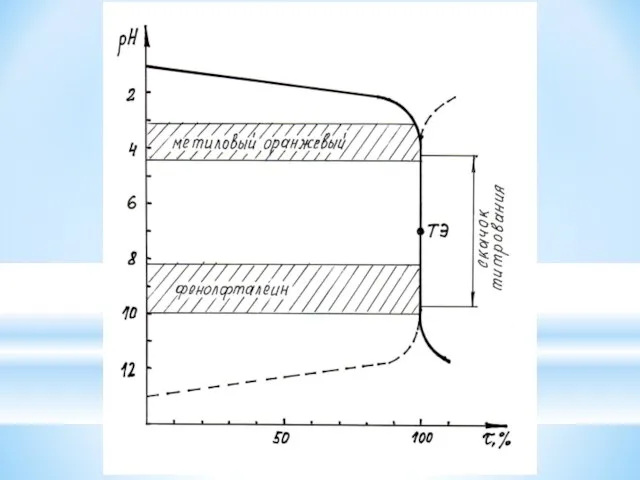
Задача: Рассчитать и построить кривую титрования 10 мл 0,1 М раствора
уксусной кислоты 0,1 М раствором NaOH








 Платина. Свойства
Платина. Свойства Введение в аналитическую химию. Введение в качественный анализ
Введение в аналитическую химию. Введение в качественный анализ Жиры и масла в косметическом производстве
Жиры и масла в косметическом производстве Урок-упражнение по веществам
Урок-упражнение по веществам Основы электрохимии. Электрохимические процессы
Основы электрохимии. Электрохимические процессы Алюминий, его физические и химические свойства
Алюминий, его физические и химические свойства PROTEIN PLEX. Состав
PROTEIN PLEX. Состав Спирти та їх види
Спирти та їх види Цепная сополимеризация
Цепная сополимеризация Вуглецеві матеріали
Вуглецеві матеріали Комплексные соединения
Комплексные соединения Упражнения по теме скорость химической реакции
Упражнения по теме скорость химической реакции Задачи на смеси (задание № 33)
Задачи на смеси (задание № 33) Алкалоиды природного происхождения
Алкалоиды природного происхождения Альдегиды. Строение молекул
Альдегиды. Строение молекул Phosphorus
Phosphorus Предмет и задачи химии
Предмет и задачи химии Stereoselective total syntheses of guanacastepenes N and O
Stereoselective total syntheses of guanacastepenes N and O Создание оптимального теплового режима в реакторах
Создание оптимального теплового режима в реакторах Медь. Биоэлементы в теле человека. Продукты, содержащие медь
Медь. Биоэлементы в теле человека. Продукты, содержащие медь Периодический закон Д.И. Менделеева (лекция 3)
Периодический закон Д.И. Менделеева (лекция 3) Витамины молока и молочных продуктов. Жирорастворимые витамины
Витамины молока и молочных продуктов. Жирорастворимые витамины Органічні речовини
Органічні речовини  Хлор
Хлор Предмет химии. Вещества и их свойства.
Предмет химии. Вещества и их свойства. Оксиди неметалічних елементів
Оксиди неметалічних елементів  Добавки, красители и консерванты в пищевых продуктах
Добавки, красители и консерванты в пищевых продуктах Изобутан. Получение и применение
Изобутан. Получение и применение