Содержание
- 2. ОСНОВЫ ЭЛЕКТРОХИМИИ Электрохимические процессы
- 3. Электрохимия - это наука, которая изучает процессы, либо протекающие с возникновением электрического тока, либо вызванные электрическим
- 4. Электрохимические процессы – это частный случай окислительно-восстановительных р-ций. ОВР можно осуществлять двумя способами: при прямом контакте
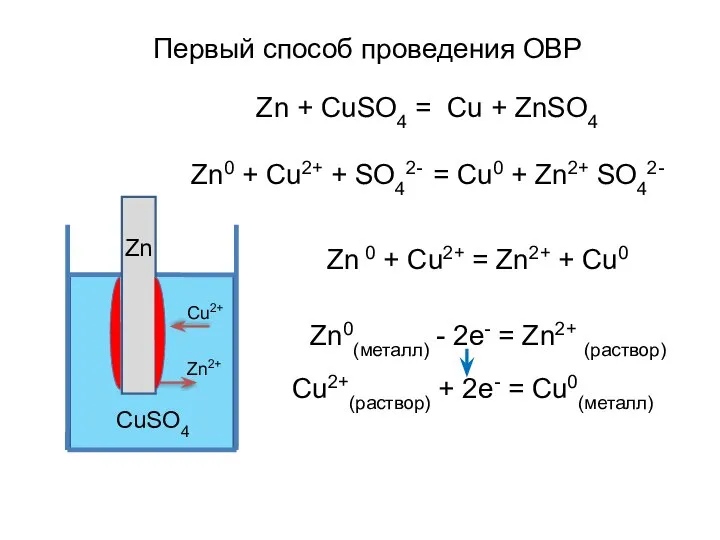
- 5. Zn + CuSO4 = Cu + ZnSO4 Zn0 + Cu2+ + SO42- = Cu0 + Zn2+
- 6. Гальванический элемент Якоби- Даниэля Zn Cu Zn + CuSO4 = ZnSO4 + Cu электродные процессы: Краткая
- 7. Устройства, в к-рых энергия химической р-ции непосредственного преобразуется в электри-ческую энергию, называются химическими источниками электрической энергии
- 8. Электродвижущая сила (ЭДС) ∆G при р = const и Т = const ∆G = ∆H –
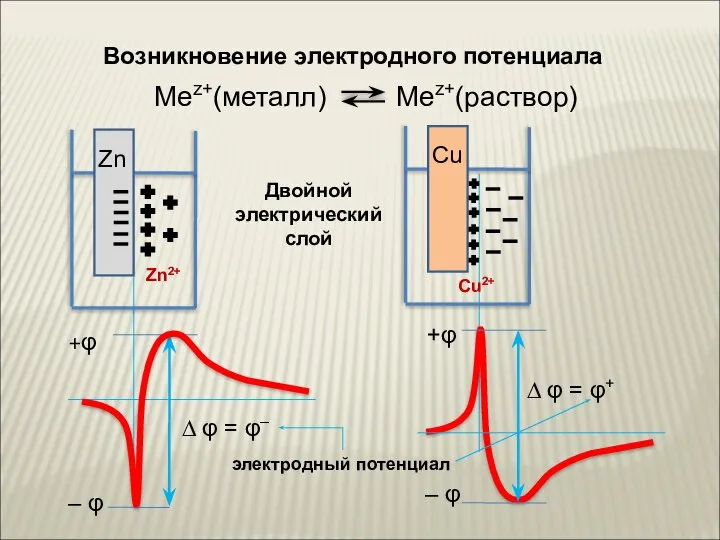
- 9. Возникновение электродного потенциала
- 10. При изучении потенциалов различных электродных процессов установлено, что их величины зависят от трех факторов: от природы
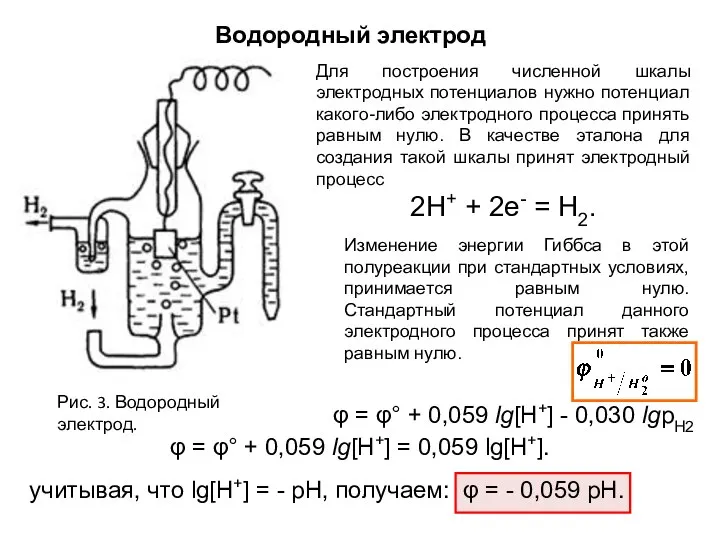
- 11. Водородный электрод Рис. 3. Водородный электрод. Для построения численной шкалы электродных потенциалов нужно потенциал какого-либо электродного
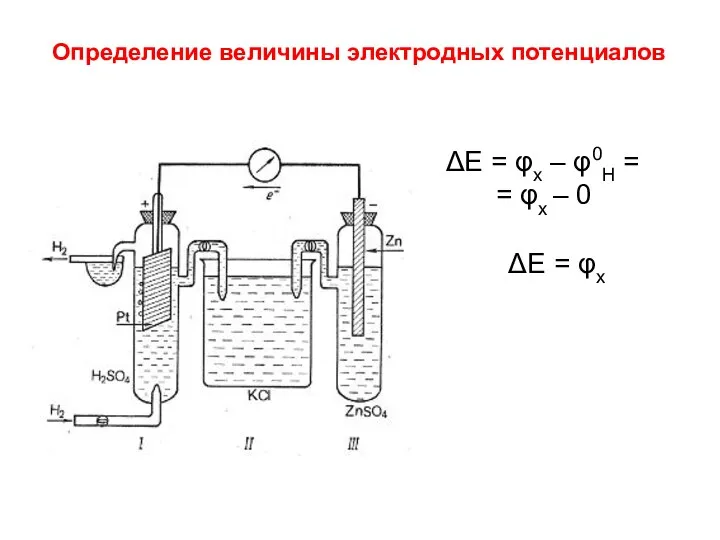
- 12. ΔE = φx – φ0H = = φx – 0 ΔE = φx Определение величины электродных
- 13. Концентрационные элементы Pt, H2 | H2SO4 || H2SO4 | H2, Pt C1 C2 φ2 = -
- 14. Задача 1. Определить знаки электродов в гальван. эл-те Co|CoCI2||AICI3|AI, указать анод и катод, объяснить механизм возникновения
- 15. С.Б. Бурухин, О.А. Ананьева «Введение в электрохимию»
- 16. Физические типы кристаллических решеток В зависимости от природы частиц, находящихся в узлах кристаллической решетки, и от
- 17. Типы кристаллов Ионные кристаллы В узлах кристаллической решетки располагаются ионы разных знаков. Силы взаимодействия между ними
- 18. Типы кристаллов Атомные кристаллы В узлах кристаллической решетки размещаются нейтральные атомы. Связь, объединяющая в кристалле (а
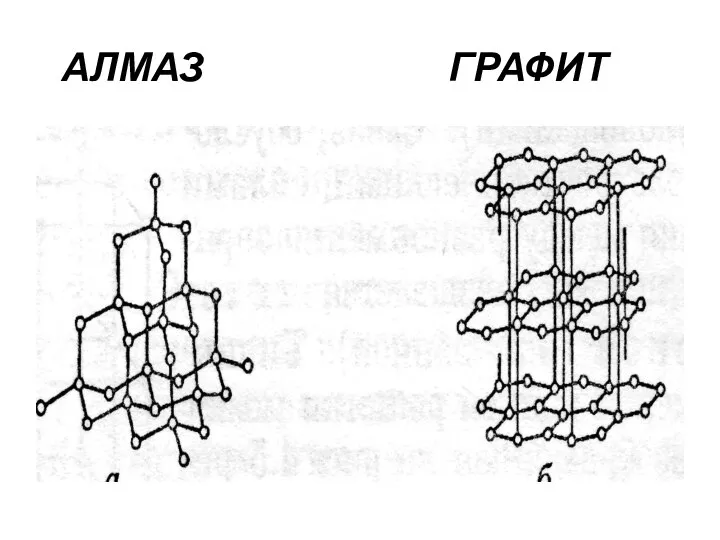
- 19. Типы кристаллов Характерные примеры атомных кристаллов – алмаз и графит. Абсолютно идентичные по химической природе (элемент
- 20. АЛМАЗ ГРАФИТ
- 21. Типы кристаллов Металлические кристаллы Во всех узлах кристаллической решетки расположены положительные ионы металла. Между ними беспорядочно,
- 22. Типы кристаллов Молекулярные кристаллы В узлах кристаллической решетки помещаются определенным образом ориентированные молекулы. Силы связи между
- 24. Скачать презентацию
















 Электронные эффекты заместителей. Типы химических реакций
Электронные эффекты заместителей. Типы химических реакций Гидроксилпроизводные углеводородов
Гидроксилпроизводные углеводородов Использование дрожжей в пищевой промышленности Федеральное государственное образовательное учреждение среднего профессионал
Использование дрожжей в пищевой промышленности Федеральное государственное образовательное учреждение среднего профессионал Алюминий және оның қосылыстары
Алюминий және оның қосылыстары Моделирование химико-технологических процессов
Моделирование химико-технологических процессов Робота учня 11-В класу: Андрійка Андрія
Робота учня 11-В класу: Андрійка Андрія  Получение полимеров из низкомолекулярных соединений
Получение полимеров из низкомолекулярных соединений Установление точной концентрации раствора щелочи по титрованному раствору соляной кислоты. (Лабораторная работа 1)
Установление точной концентрации раствора щелочи по титрованному раствору соляной кислоты. (Лабораторная работа 1) Общенаучные методы исследований
Общенаучные методы исследований Iodine
Iodine Презентация по Химии "Презентация Ионы и ионная химическая связь" - скачать смотреть
Презентация по Химии "Презентация Ионы и ионная химическая связь" - скачать смотреть  Химические свойства карбокатионов
Химические свойства карбокатионов Симметрия физических свойств кристаллов
Симметрия физических свойств кристаллов Оксокислоти. Номенклатура
Оксокислоти. Номенклатура Комплексні сполуки
Комплексні сполуки Презентация по Химии "ПОЛИМЕРАЗНАЯ ЦЕПНАЯ РЕАКЦИЯ" - скачать смотреть бесплатно
Презентация по Химии "ПОЛИМЕРАЗНАЯ ЦЕПНАЯ РЕАКЦИЯ" - скачать смотреть бесплатно Железо
Железо Дмитрий Иванович Менделеев
Дмитрий Иванович Менделеев Нуклеиновые кислоты
Нуклеиновые кислоты Неорганические полимеры
Неорганические полимеры Камни и Стрелец
Камни и Стрелец Високомолекулярні сполуки. Полімери
Високомолекулярні сполуки. Полімери Кислоты
Кислоты Алкины. Строение,номенклатура, изомерия
Алкины. Строение,номенклатура, изомерия Важнейшие кислоты и кислотные остатки. (Леция 1)
Важнейшие кислоты и кислотные остатки. (Леция 1) Пестицидтердің қоршаған ортаға тигізетін әсері
Пестицидтердің қоршаған ортаға тигізетін әсері Гидродинамика (процессы и аппараты химической технологии, 3 лекция)
Гидродинамика (процессы и аппараты химической технологии, 3 лекция) Характеристика ядов, изолируемых водой в клинической фармации
Характеристика ядов, изолируемых водой в клинической фармации