1. Гомогенные реакции без изменения числа молей (∆ђ=0)
– четыре
неизвестных, сведём к одному.
Обозначим через x число прореагировавших молей Н2 и I2, а в начальном состоянии было a молей Н2 и b молей I2. В конечном (равновесном) состоянии окажется 2х молей HI, а останется (а-х) Н2 и (b-х) молей I2. Удобно воспользоваться таблицей:
Пусть V – объём системы. Тогда:
;
Три неизвестных сведены к одному (→ равновесие реакции не зависит от внешних условий Р или V)
Допустим Кс = 50,4 (t=445оС). Решаем квадратное уравнение и принимаем а=b=1:
х=0,78 молей Н2 и I2, 2х=1,56 молей HI – это максимальный выход HI. Совпадает с экспериментом на ≈80%






 Метанол, етанол, гліцерин
Метанол, етанол, гліцерин Позднемеловая трубка взрыва щелочных базальтов Красноозерная
Позднемеловая трубка взрыва щелочных базальтов Красноозерная Эволюция антропогенных загрязнений в окружающей среде. Роль физико-химических явлений
Эволюция антропогенных загрязнений в окружающей среде. Роль физико-химических явлений Практическая работа по химии. Строение пламени
Практическая работа по химии. Строение пламени Кислоты
Кислоты Галогены VII группы. Биологическая роль и применение в медицине
Галогены VII группы. Биологическая роль и применение в медицине Занятие по познавательному развитию на тему: «Где спрятался воздух?» в средней группе.
Занятие по познавательному развитию на тему: «Где спрятался воздух?» в средней группе.  Молярный объём
Молярный объём Псевдогалогены и их соединения
Псевдогалогены и их соединения Органическая химия. Классификация и номенклатура органических соединений (ОС). Пространственное строение ОС
Органическая химия. Классификация и номенклатура органических соединений (ОС). Пространственное строение ОС Жиры Цели урока: Изучить жиры: состав, классификация,физические и химические свойства, переработка, применение, биологич
Жиры Цели урока: Изучить жиры: состав, классификация,физические и химические свойства, переработка, применение, биологич Теории кислот и оснований. Буферные системы крови
Теории кислот и оснований. Буферные системы крови План розміщення добрив у польовій сівозміні. (Лабораторна робота 22)
План розміщення добрив у польовій сівозміні. (Лабораторна робота 22) Нанохімія та нанотехнології
Нанохімія та нанотехнології Ультраосновные породы (гипербазиты)
Ультраосновные породы (гипербазиты) Применение интерактивной доски на уроках химии Учитель химии МОУ «СОШ п. Первомайский» Кириченко Е.Н.
Применение интерактивной доски на уроках химии Учитель химии МОУ «СОШ п. Первомайский» Кириченко Е.Н. МОЮЩИЕ СРЕДСТВА СВОЙСТВА МОЮЩИХ СРЕДСТВ КЛАССИФИКАЦИЯ МОЮЩИХ СРЕДСТВ
МОЮЩИЕ СРЕДСТВА СВОЙСТВА МОЮЩИХ СРЕДСТВ КЛАССИФИКАЦИЯ МОЮЩИХ СРЕДСТВ Ароматические системы
Ароматические системы Неорганические вещества
Неорганические вещества Буферные растворы
Буферные растворы Общая технология отрасли. Сахар и сахаристые вещества
Общая технология отрасли. Сахар и сахаристые вещества Химические и физические явления
Химические и физические явления Отдельные классы дисперсных систем
Отдельные классы дисперсных систем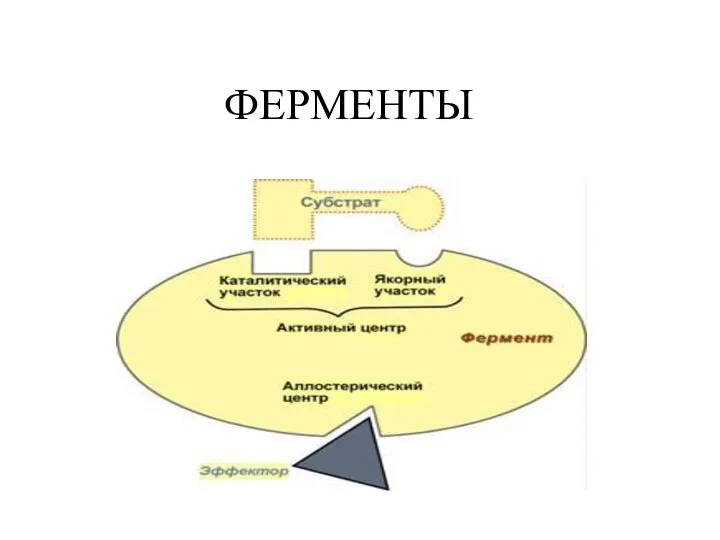 Ферменты. Значение ферментов
Ферменты. Значение ферментов Марганец. Роль марганца в организме
Марганец. Роль марганца в организме Элементы 7 группы побочной подгруппы
Элементы 7 группы побочной подгруппы Современная система контроля и обеспечения качества лекарственных средств в Украине
Современная система контроля и обеспечения качества лекарственных средств в Украине Сложные эфиры
Сложные эфиры