Содержание
- 2. ФИЗИЧЕСКАЯ ТЕОРИЯ РАСТВОРОВ Якоб Вант-Гофф Сванте Аррениус Вильгельм Освальд 1887 год Растворение--результат диффузии, т.е. физический процесс.
- 3. Физико-химическая теория растворов. 1906год Д.И.Менделеев Гидратная теория растворов. При взаимодействии растворённого вещества с водой образуются гидраты.
- 4. опыт 1 В пробирку поместите белые кристаллы CuSO4, добавьте воды, перемешайте. Определите цвет полученного раствора. CuSO4
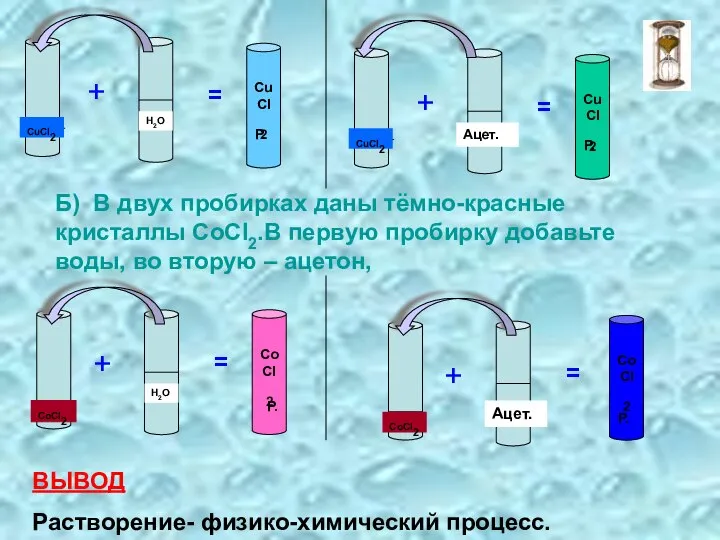
- 5. Б) В двух пробирках даны тёмно-красные кристаллы СоСI2.В первую пробирку добавьте воды, во вторую – ацетон,
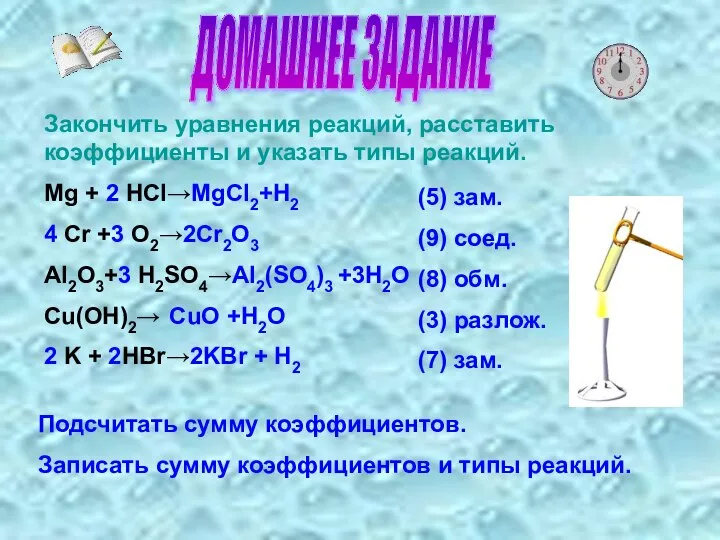
- 6. ДОМАШНЕЕ ЗАДАНИЕ Закончить уравнения реакций, расставить коэффициенты и указать типы реакций. Mg + 2 HCI→MgCI2+H2 4
- 7. РАСТВОРИМОСТЬ ВЕЩЕСТВ В ВОДЕ при 20ºС (г/100г воды) Хорошо растворимые Малорастворимые Практически нерастворимые >1г Сульфат меди
- 8. ЗАДАЧА В организме человека в среднем содержится 5 л крови, плотность которой состовляет 1,05 г/мл. Сколько
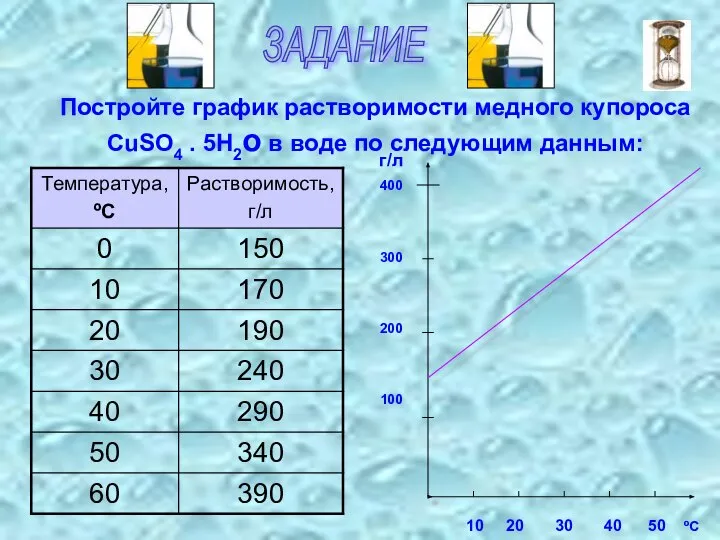
- 9. ЗАДАНИЕ Постройте график растворимости медного купороса CuSO4 . 5H2о в воде по следующим данным: 10 20
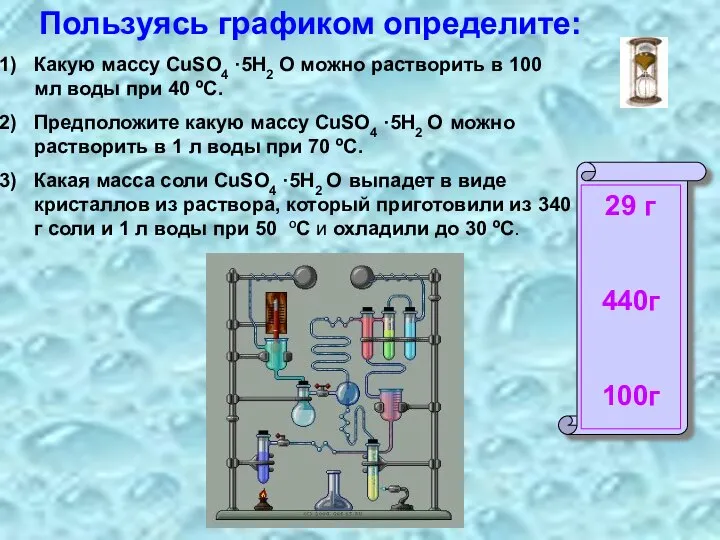
- 10. Пользуясь графиком определите: Какую массу CuSO4 ·5H2 O можно растворить в 100 мл воды при 40
- 11. ОТВЕТ: m(гем.) = 630 г m(Fe) = 31,5 г.
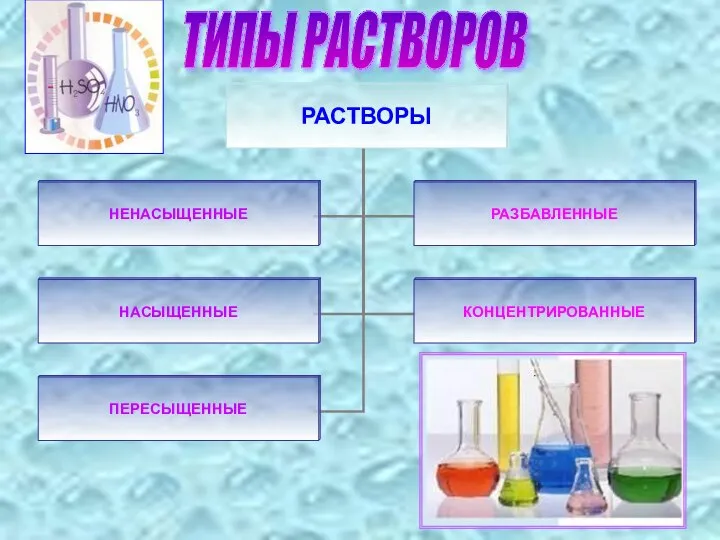
- 12. ТИПЫ РАСТВОРОВ
- 13. ВЕЩЕСТВА Хорошо растворимые Малорастворимые Практически нерастворимые >1г Сульфат меди CuSO4 – 222 г Нитрат калия KNO3
- 15. КРОССВОРД O2
- 16. ДОМАШНЕЕ ЗАДАНИЕ § 34 Упражнения 4, 5, 6. Страница 142 ДОМАШНЕЕ ЗАДАНИЕ ДОМАШНЕЕ ЗАДАНИЕ § 34
- 18. Скачать презентацию










 Электрохимия. Электродные потенциалы
Электрохимия. Электродные потенциалы Каталитический риформинг
Каталитический риформинг Новогаленовые. Максимально очищенные экстракционные препараты
Новогаленовые. Максимально очищенные экстракционные препараты Химия гетероциклических соединений. Трехчленные циклы
Химия гетероциклических соединений. Трехчленные циклы Вакуумная перегонка мазута
Вакуумная перегонка мазута Жиры. Тема 2.5
Жиры. Тема 2.5 Основные законы в химии
Основные законы в химии Математический аппарат квантовой механики
Математический аппарат квантовой механики Химическая игра Своя игра
Химическая игра Своя игра Основы теории плавления и отвердевания металлов
Основы теории плавления и отвердевания металлов Чистые вещества и смеси. Уголь и вода
Чистые вещества и смеси. Уголь и вода ПРИРОДНИЙ ГАЗ
ПРИРОДНИЙ ГАЗ  Дослід Ознайомлення зі змістом етикеток харчових продуктів
Дослід Ознайомлення зі змістом етикеток харчових продуктів  Классификация моторных масел по стандартам API
Классификация моторных масел по стандартам API Степень окисления
Степень окисления Роль химии в нашей жизни
Роль химии в нашей жизни Термические превращения углеводородов и других компонентов нефти
Термические превращения углеводородов и других компонентов нефти Методы анализа живых систем, группы методов
Методы анализа живых систем, группы методов Гликогенді және кетогенді аминқышқылдары. Биологиялық рөлі
Гликогенді және кетогенді аминқышқылдары. Биологиялық рөлі Свойства кислот Сульфура H2SO4, H2SO3, H2S
Свойства кислот Сульфура H2SO4, H2SO3, H2S Полимерные материалы и изделия. (Лекция 16)
Полимерные материалы и изделия. (Лекция 16) Изопроцессы в идеальном газе
Изопроцессы в идеальном газе Обратимость химических реакций. Химическое равновесие, условия его смещения
Обратимость химических реакций. Химическое равновесие, условия его смещения Значення хімії у повсякденному житті Значення хімії у побуті
Значення хімії у повсякденному житті Значення хімії у побуті  Оксиды азота
Оксиды азота Презентация по Химии "«Самородки»" - скачать смотреть
Презентация по Химии "«Самородки»" - скачать смотреть  «Көмірсулар» Қайталау сабағы
«Көмірсулар» Қайталау сабағы Обмен аминокислот и белков
Обмен аминокислот и белков