Содержание
- 2. План Понятие и классификация растворов. Способы выражения концентрации – на практических занятиях. Ионизация воды, ионное произведение,
- 3. План Расчёт рН водных растворов кислот и оснований; Индикаторы. Кислоты и основания Бренстеда (протолитическая теория), показатели
- 4. Понятие «растворы» Растворы - это гомогенные (однородные) системы, состоящие из двух и более компонентов переменного состава.
- 5. Понятие «растворы» Растворителем принято называть такое вещество, которое не меняет своего агрегатного состояния при растворении. Обычно,
- 6. Таблица 1. Классификация растворов по агрегатному состоянию.
- 7. Жидкими растворами являются: вода морей и океанов, и даже водопроводная вода; биологические жидкости с растворенными в
- 8. истинные, где частицы растворенного вещества находятся в воде или другом растворителе в виде молекул, атомов или
- 9. коллоидные, относящиеся к дисперсным системам, где частицы дисперсной фазы находятся в дисперсионной среде в виде мицелл,
- 10. Ионизация воды. Водородный показатель. HOH + HOH ⇆ НО⁻ + Н3О + Катион гидроксония HOH ⇆
- 11. [НОН] = СМ (НОН) = = = 55,6 моль/л Сгруппируем постоянные величины в уравнении (2) и
- 12. # Роль Кw заключается в том, что, зная Кw и концентрацию одного из ионов воды, можно
- 13. При повышении [H+], среда становится кислой (здесь [H+] >10⁻7 , тогда [HО⁻ ] При понижении [H+],
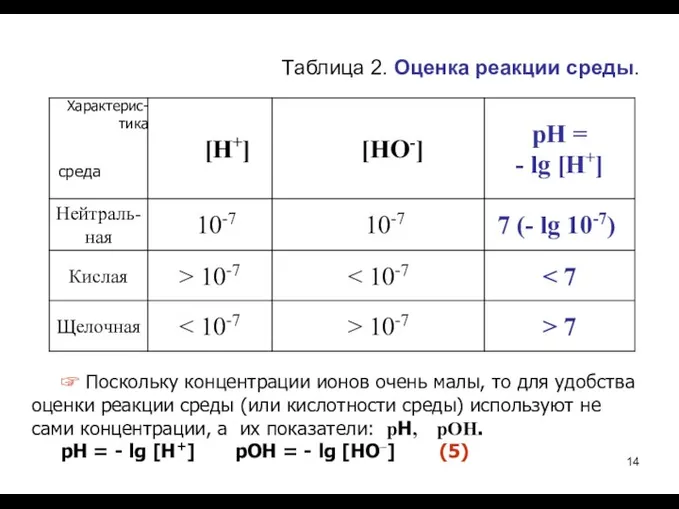
- 14. Таблица 2. Оценка реакции среды. среда Характерис- тика ☞ Поскольку концентрации ионов очень малы, то для
- 16. Далее, выражение для ионного произведения воды (3) переведём в логарифмическую шкалу. Для этого прологарифмируем (3) с
- 17. И мы имеем связь показателей среды (рН и рОН): сумма показателей среды рН и рОН постоянна
- 18. рН биологических жидкостей колеблется в зоне 1÷9 рН желудочного сока 1; рН кишечного сока 9 рН
- 19. рН среды, оптимальное для развития патогенных для человека бактерий практически совпадает с рН плазмы крови: рН
- 20. Ионизация кислот и оснований. С позиций теории электролитической диссоциации (теории Аррениуса): кислоты – это молекулы или
- 21. Константа равновесия Кр (8) - – константа кислотности Ка где Ка (НА) – константа ионизации кислоты
- 22. Обратимся к реакции ионизации кислоты (8). Положение равновесия этой реакции зависит от кислотности среды. В кислой
- 23. Кр = Ка = [H+] а её логарифмирование с отрицательным знаком даст: - lg Kа =
- 24. Примечание рКа может быть своеобразной точкой отсчёта для количества ионизированных форм кислоты при любом рН. Это
- 25. Ионизация оснований С позиций теории электролитической диссоциации (теории Аррениуса): Основания – это молекулы или ионы, которые
- 26. рКb = - lgКb (12) Основность растёт с увеличением Кb и с уменьшением рКb Водный раствор
- 27. Это связано с тем, что некоторая часть водородных связей между атомом азота и атомом кислорода перерастает
- 28. Такой процесс ионизации аммиака записывается: NH3 + HOH ⇆ +NH4 + ⁻OH pH > 7 (13)
- 29. # Обратим внимание, что ионизируется аммиак, а не NH4OH , как это было принято считать во
- 30. Физический смысл рКb # Физический смысл рКb для оснований устанавливают также как рКа для кислот: рКb
- 31. Расчет рН разбавленных растворов сильных и слабых кислот и оснований КИСЛОТЫ сильные слабые одноосновные двухосновные
- 32. рН растворов сильных кислот (HCl, HNO3, HClO4, H2SO4 и др.) А. Одноосновные сильные кислоты диссоциируют нацело:
- 33. [H+] = 2Cм(Н2А) = 2· = 2 = =Сэ(Н2А) Сэ(Н2А) z Сэ(Н2А) 2 рН = -lg
- 34. Для расчетов рН растворов сильных оснований (щелочей) рассуждения аналогичны, только касаются рОН: рОН = рСэ (щёлочи)
- 35. Поэтому решение задачи 1.через α: Степень диссоциации показывает долю ионизирован-ных молекул, и концентрацию Н+ можно выразить
- 36. 2. через Ка(НА): Ка = = (т.к., согласно уравнению (22), для одно основных кислот [H+] =
- 37. Вывод: для слабых одноосновных кислот рН определяется либо как сумма двух показателей рα и рСМ (23),
- 38. Б. Слабые двухосновные кислоты также как и слабые одноосновные диссоциируют обратимо, но по ступеням: Н2 А
- 39. Решение задач Определим рН 0,1м HCl, 0,1м H2SO4 , 0,1э H2SO4 а) б) в) а) рННСl
- 40. Решение задач (продолжение) б) рН (H2SO4) - ? H2SO4 – сильная ислота. Поэтому, согласно (18): рН
- 41. Решение задач (продолжение) в) рН(H2SO4) - ? рН = рСэ = -lgCэ = -lg10-1 =1 Ответ:
- 42. рН 0,1э (H2SO3) -? H2SO3 – это слабая Решение задач (продолжение) Ка1 = 1,2∙10-2 двухосновная кислота.
- 43. # Cравните с рН 0,1э H2SO4 = 1 ! Получается, что H2SO3, взятая в эквивалентном количестве
- 44. pH 0,1M (NH3 · H2O) - ? NH3 в воде – это слабое Кb = 1,79
- 45. Решение задач (продолжение) рКb = - lgKb = - lg 1,79∙10-5 = - 5,25 = 4,75
- 46. Кислотно-основные индикаторы В качестве индикаторов для определения рН растворов используют слабые органические кислоты и основания, у
- 47. В растворе кислотный индикатор, например, ведёт себя следующим образом: НInd ⇆ H+ + Ind⁻ (33) окраска
- 48. Таблица 3. Примеры индикаторов.
- 49. рН среды, при котором индикатор ионизирован на 50% (а это, как мы помним, есть значение рКа
- 50. Кислоты и основания Бренстеда (протолитическая теория кислот и оснований). Кислоты Бренстеда – это нейтральные молекулы или
- 51. Кислоты и основания Бренстеда (протолитическая теория кислот и оснований). Чтобы принимать Н+, основания должны иметь электронные
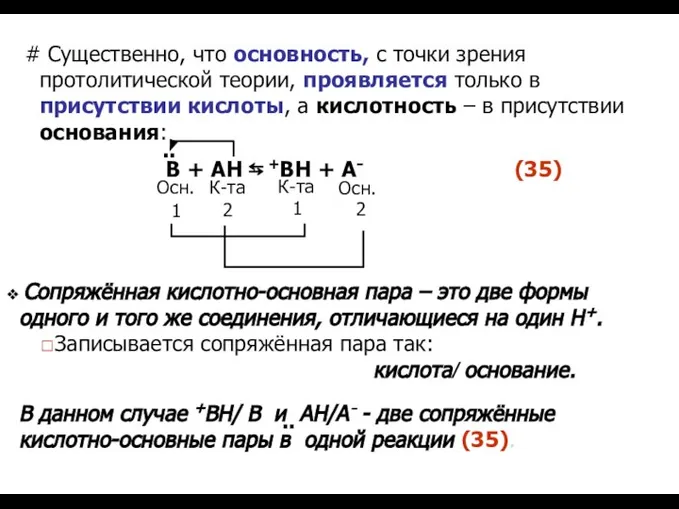
- 52. # Существенно, что основность, с точки зрения протолитической теории, проявляется только в присутствии кислоты, а кислотность
- 53. Таким образом, кислотно-основное взаимодействие — это перенос Н+ с кислоты на основание, с образованием новой кислоты
- 54. Другими словами, почти в любой сопряжённой кислотно-основной паре один из компонентов сильный, другой слабый: Н3О+ /
- 55. Силовой характеристикой кислотно-основных свойств любой сопряжённой пары является рКа - показатель кислотности, характеризующий оба компонента этой
- 56. рКа(НОН / НО⁻) = 15,7 (37) В этой паре очень слабая кислотность (НОН) и очень сильная
- 57. -1,74 4,76 6,95 8,20 9,24 15,74 рКа | | | | | | Н3О+/Н2О CH3COOH NH4+/NH3
- 58. Сопряженную кислотно-основную пару можно характеризовать и показателем рКb. Для одной и той же сопряженной кислотно-основной пары
- 59. Гидролиз солей Гидролиз солей – это реакция обменного разложения между солью и водой. Гидролиз солей –
- 60. # Первые два определения являются классическими и возникли со времен появления теории электролитической диссоциации Аррениуса. #
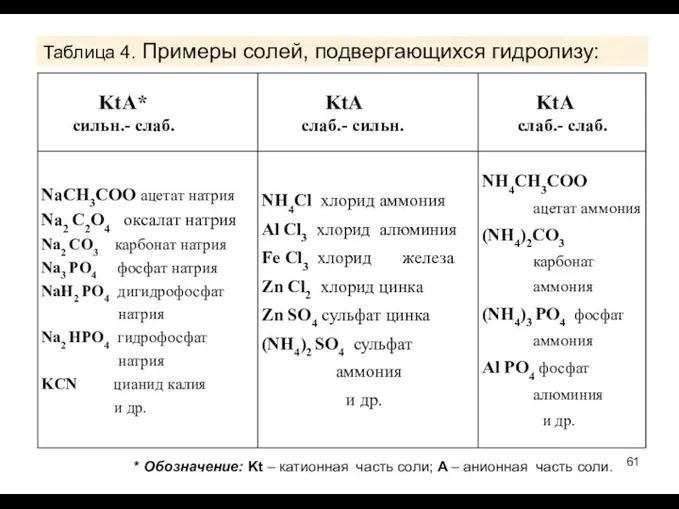
- 61. Таблица 4. Примеры солей, подвергающихся гидролизу: * Обозначение: Kt – катионная часть соли; A – анионная
- 62. Гидролиз солей (продолжение) Согласно определению, соли, образованные сильным основанием и слабой кислотой, в ходе гидролиза это
- 63. В результате гидролиза по аниону происходит защелачивание среды. Её рН будет зависеть от силовой характеристики (рКа)
- 64. Гидролиз солей (продолжение) Соль, образованная слабым основанием и сильной кислотой, в ходе гидролиза даёт слабое основание
- 65. В результате гидролиза соли по катиону среда приобретает слабо кислый характер, т.к. освобождается Н+ в гидратированной
- 66. Гидролиз солей (продолжение) Соли, образованные слабой кислотой и слабым основанием в ходе гидролиза эти же соединения
- 67. рН при таком гидролизе может быть нейтральным, слабокислым или слабощелочным. Это зависит от сравнительной силы слабого
- 68. Степень гидролиза – это отношение числа гидролизованных молекул соли к общему числу растворённых молекул (выражается в
- 69. Степень гидролиза зависит: от природы соли (характеристики рКа и рКb). от t0 (повышается t0 - растёт
- 70. # Многозарядные ионы гидролизуются ступенчато: Так, гидролиз по двухзарядному аниону: 1 ступень СО32⁻ + НОН ⇆
- 71. Гидролиз по многозарядному катиону: 1 ступень Fe3+ + HOH ⇆ (FeOH)2+ + H+ 1,82·10-12 (Кb3 Fe(OH)3)
- 73. Скачать презентацию









![[НОН] = СМ (НОН) = = = 55,6 моль/л Сгруппируем постоянные](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1394231/slide-10.jpg)

![При повышении [H+], среда становится кислой (здесь [H+] >10⁻7 , тогда](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1394231/slide-12.jpg)








![Кр = Ка = [H+] а её логарифмирование с отрицательным знаком](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1394231/slide-22.jpg)









![[H+] = 2Cм(Н2А) = 2· = 2 = =Сэ(Н2А) Сэ(Н2А) z](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1394231/slide-32.jpg)




































 Презентация по химии Строение атома
Презентация по химии Строение атома  Новые наноматериалы. Получение, свойства и применение
Новые наноматериалы. Получение, свойства и применение Функциональные производные с простой связью C-“O”. Часть 4 (продолжение) …окси-производные
Функциональные производные с простой связью C-“O”. Часть 4 (продолжение) …окси-производные Общие сведения о полезных ископаемых. (Лекция 2)
Общие сведения о полезных ископаемых. (Лекция 2) Смесители. Пропеллерная мешалка
Смесители. Пропеллерная мешалка Щелочноземельные металлы
Щелочноземельные металлы Информационно – исследовательский проект Кристаллы вокруг нас.
Информационно – исследовательский проект Кристаллы вокруг нас. Дисперсні системи
Дисперсні системи Полиуретаны. Структура и строение
Полиуретаны. Структура и строение Лекция 10. Химия s-элементов
Лекция 10. Химия s-элементов Фармацевтическая химия
Фармацевтическая химия Натуральный комплекс минералов
Натуральный комплекс минералов Алкалоидтар. Алкалоидтар туралы түсінік
Алкалоидтар. Алкалоидтар туралы түсінік Пищевые добавки
Пищевые добавки Присадки к маслам
Присадки к маслам Буферные системы
Буферные системы Давайте повторим Заключительный урок в 8 классе
Давайте повторим Заключительный урок в 8 классе  Серная кислота. (9 класс)
Серная кислота. (9 класс) Металлы. Общая характеристика
Металлы. Общая характеристика Альдегидтер және кетондар
Альдегидтер және кетондар Н2O Матвієнко А. 10-а
Н2O Матвієнко А. 10-а  Металл золото
Металл золото Кислород. Общая характеристика и нахождение в природе. 8 класс
Кислород. Общая характеристика и нахождение в природе. 8 класс Общая характеристика элементов V-А-группы. Азот
Общая характеристика элементов V-А-группы. Азот Аттестационная работа. Рабочая программа элективного курса по химии для 8 класса
Аттестационная работа. Рабочая программа элективного курса по химии для 8 класса Кислоты. Состав. Классификация
Кислоты. Состав. Классификация НАСЛІДКИ ЧОРНОБИЛЬСЬКОЇ ТРАГЕДІЇ Чорнобиль продемонстрував всемогутність і безсилля людини та застеріг її: не захоплюйся своєю
НАСЛІДКИ ЧОРНОБИЛЬСЬКОЇ ТРАГЕДІЇ Чорнобиль продемонстрував всемогутність і безсилля людини та застеріг її: не захоплюйся своєю  Презентация по Химии "Основания." - скачать смотреть бесплатно
Презентация по Химии "Основания." - скачать смотреть бесплатно