Содержание
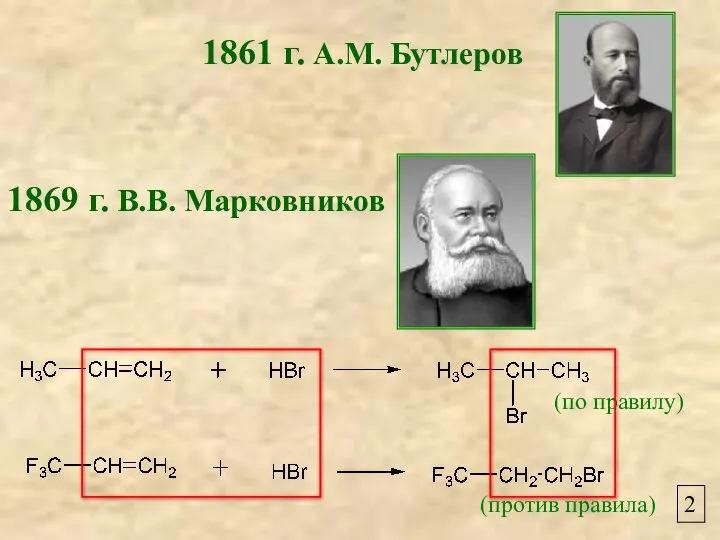
- 2. 1861 г. А.М. Бутлеров 1869 г. В.В. Марковников 2 (по правилу) (против правила)
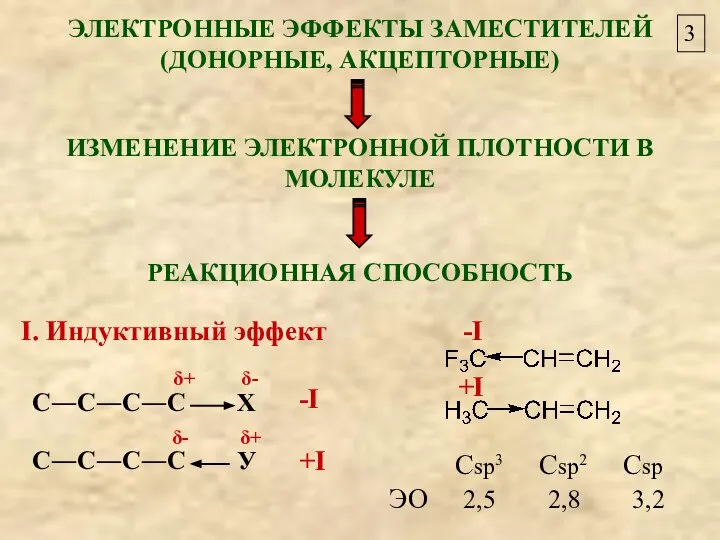
- 3. 3 ЭЛЕКТРОННЫЕ ЭФФЕКТЫ ЗАМЕСТИТЕЛЕЙ (ДОНОРНЫЕ, АКЦЕПТОРНЫЕ) ИЗМЕНЕНИЕ ЭЛЕКТРОННОЙ ПЛОТНОСТИ В МОЛЕКУЛЕ РЕАКЦИОННАЯ СПОСОБНОСТЬ Сsp3 Csp2 Csp
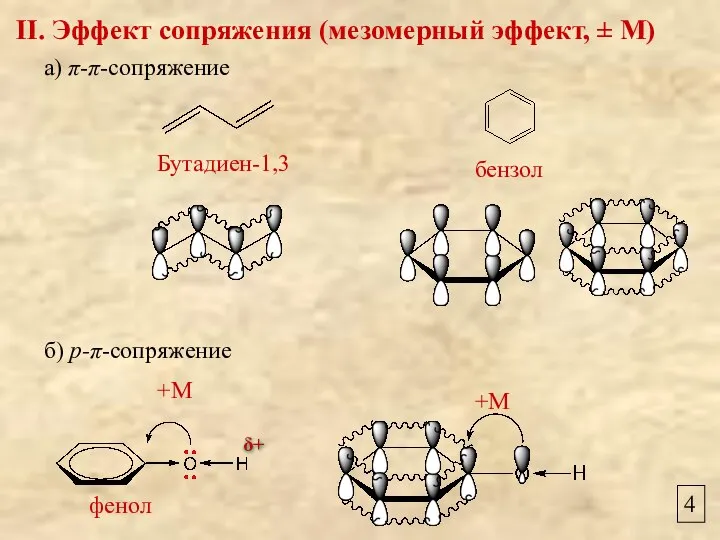
- 4. 4 II. Эффект сопряжения (мезомерный эффект, ± М) а) π-π-сопряжение б) р-π-сопряжение Бутадиен-1,3 бензол +М +М
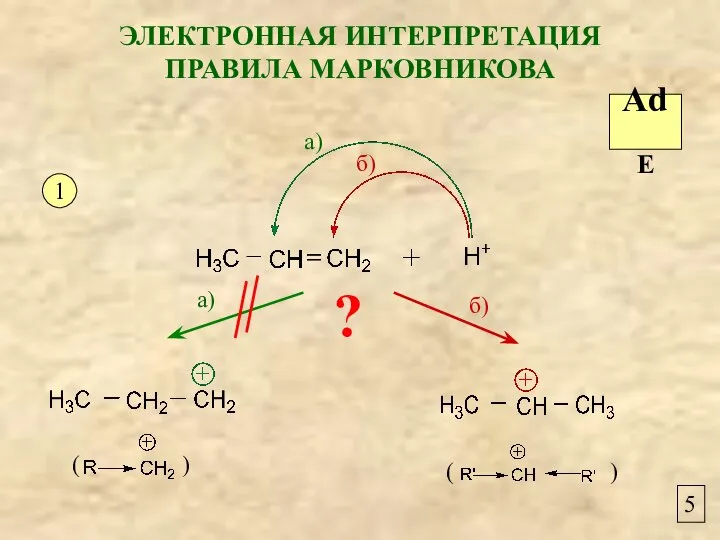
- 5. 5 ЭЛЕКТРОННАЯ ИНТЕРПРЕТАЦИЯ ПРАВИЛА МАРКОВНИКОВА 1 а) б) а) б) AdE ?
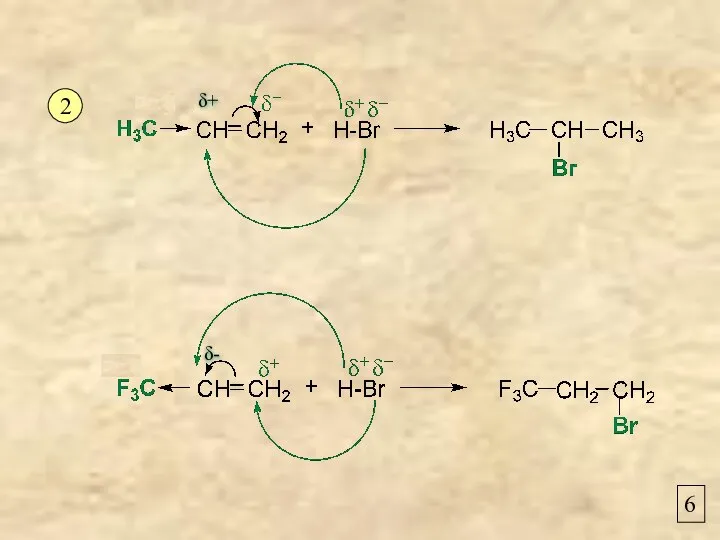
- 6. 6 2 δ+ δ-
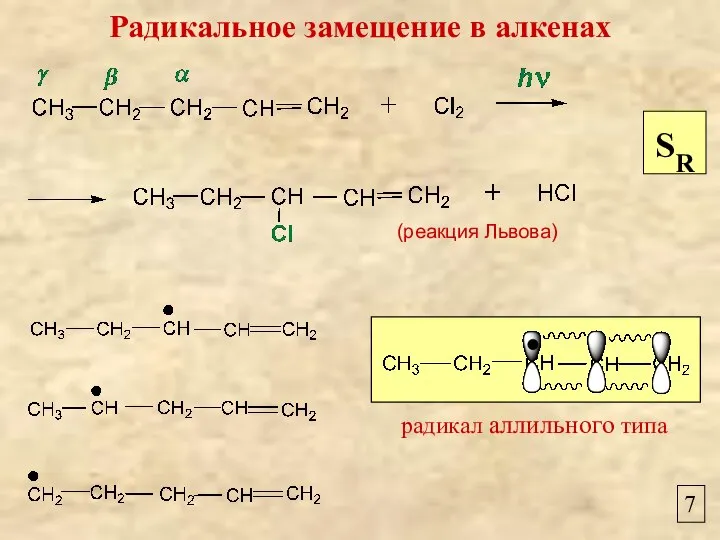
- 7. 7 радикал аллильного типа Радикальное замещение в алкенах SR (реакция Львова)
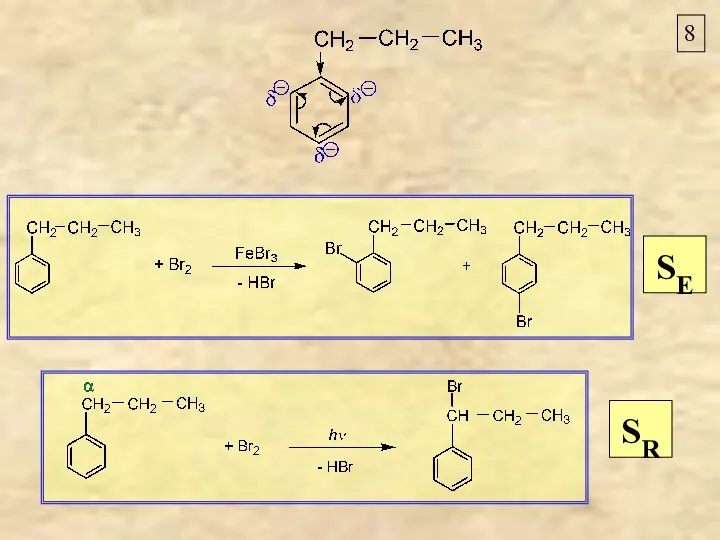
- 8. 8 SR SE
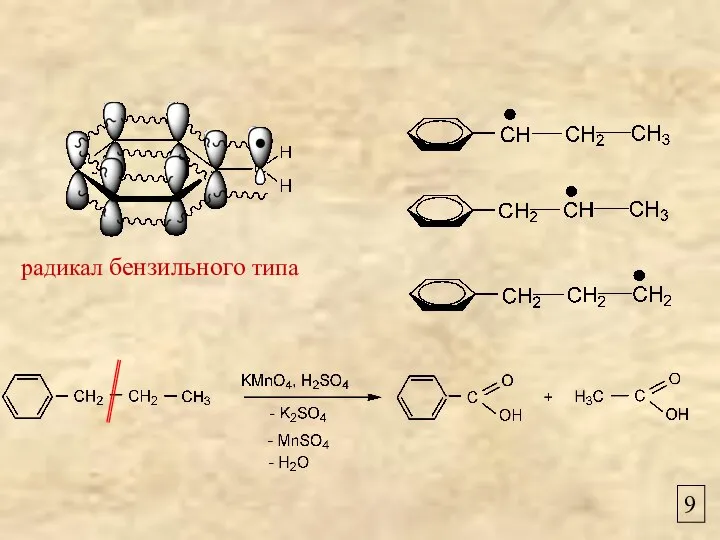
- 9. 9 радикал бензильного типа
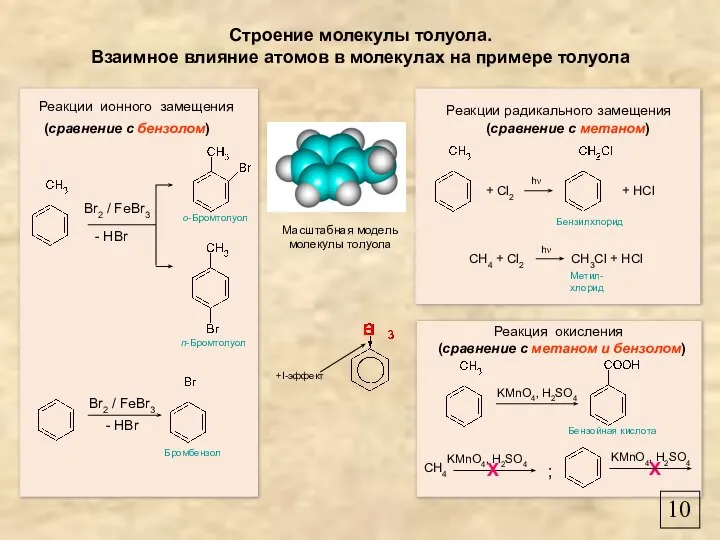
- 10. Строение молекулы толуола. Взаимное влияние атомов в молекулах на примере толуола Масштабная модель молекулы толуола CH4
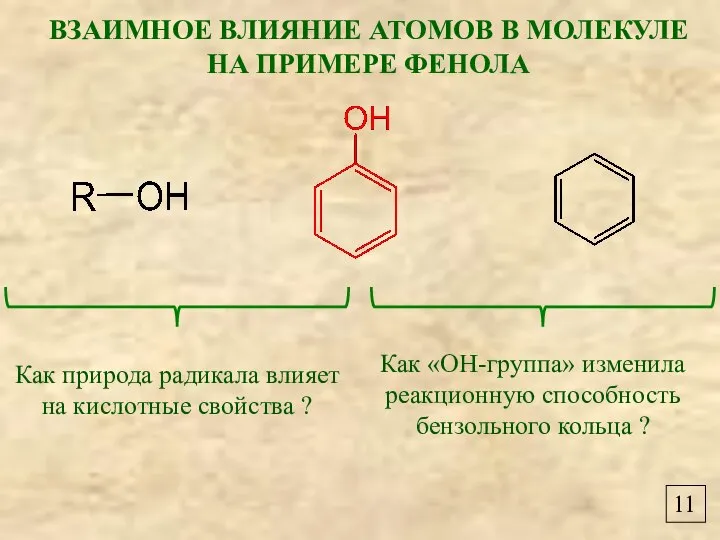
- 11. 11 ВЗАИМНОЕ ВЛИЯНИЕ АТОМОВ В МОЛЕКУЛЕ НА ПРИМЕРЕ ФЕНОЛА Как природа радикала влияет на кислотные свойства
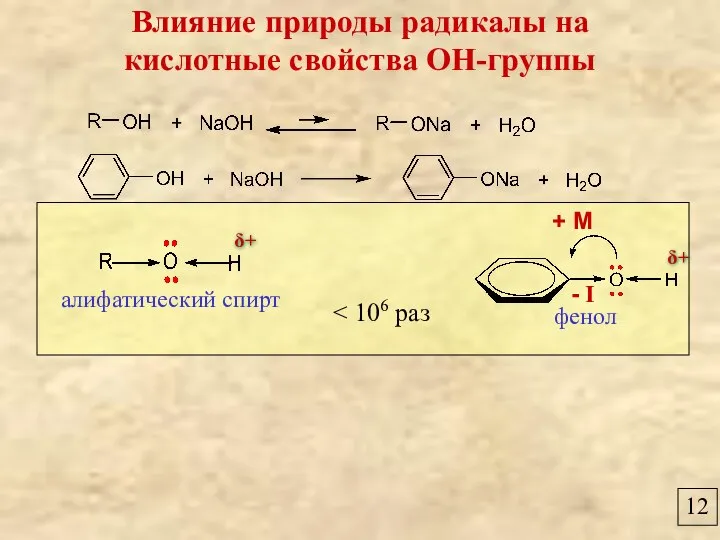
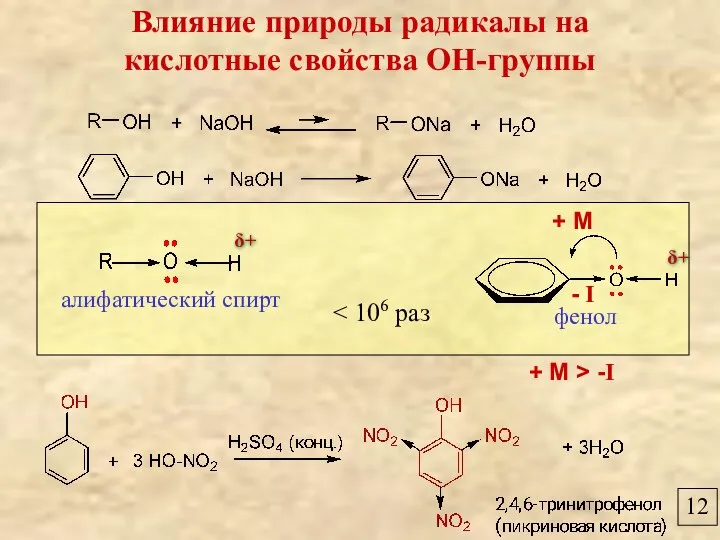
- 12. 12 Влияние природы радикалы на кислотные свойства ОН-группы фенол алифатический спирт + М - I δ+
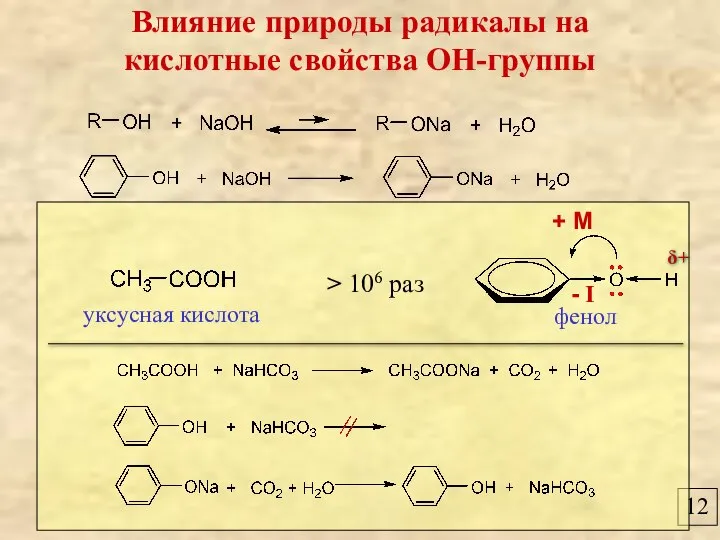
- 13. 12 Влияние природы радикалы на кислотные свойства ОН-группы фенол уксусная кислота > 106 раз + М
- 14. 12 Влияние природы радикалы на кислотные свойства ОН-группы фенол алифатический спирт + М - I +
- 15. 13 бромбензол Влияние ОН-группы на реакционную способность бензольного кольца в реакциях SE I. II.
- 16. 14 +М фенол + Х+
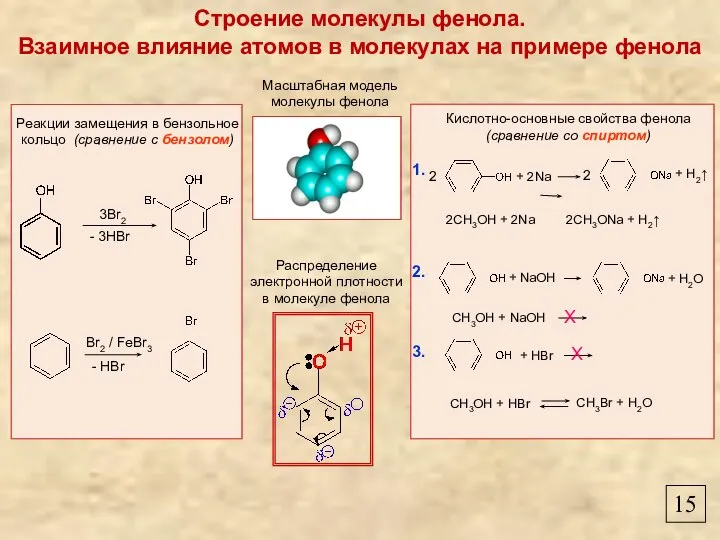
- 17. Строение молекулы фенола. Взаимное влияние атомов в молекулах на примере фенола Масштабная модель молекулы фенола Распределение
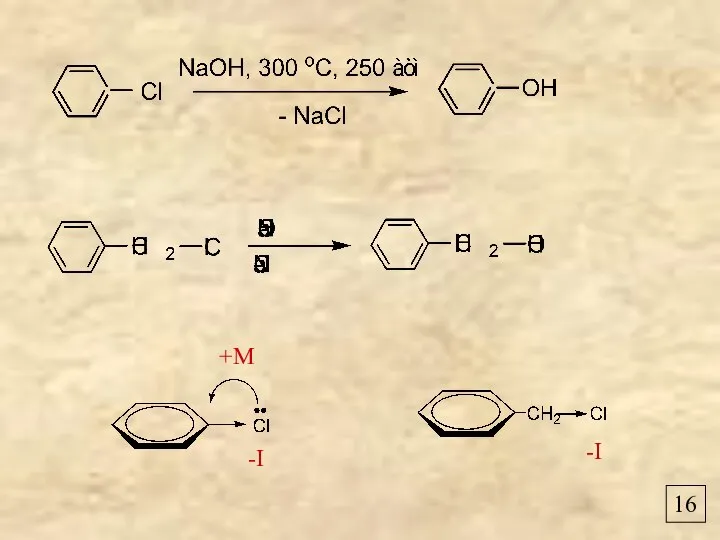
- 18. 16 +М -I -I
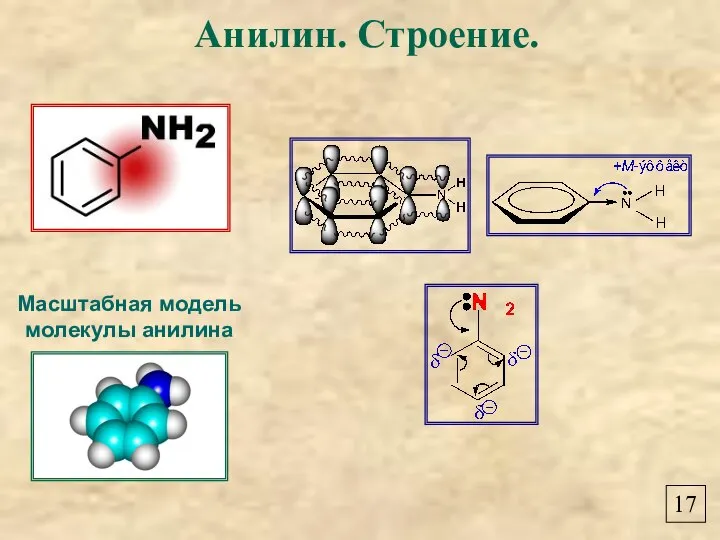
- 19. Масштабная модель молекулы анилина Анилин. Строение. 17
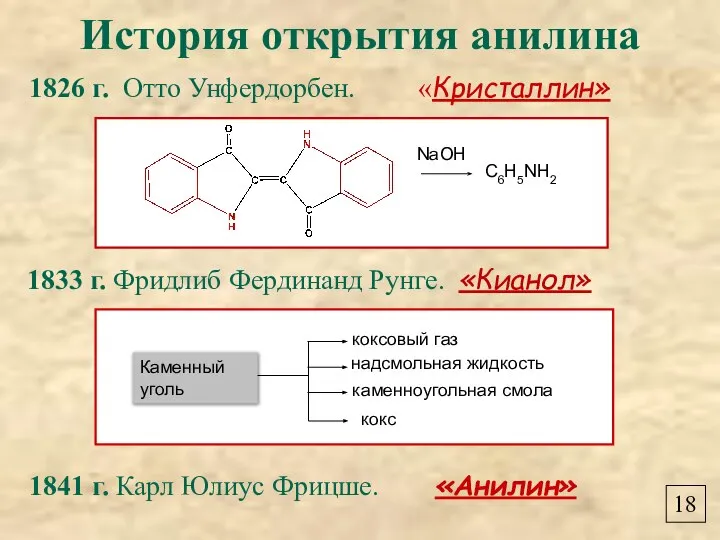
- 20. История открытия анилина 1826 г. Отто Унфердорбен. «Кристаллин» 1833 г. Фридлиб Фердинанд Рунге. «Кианол» 1841 г.
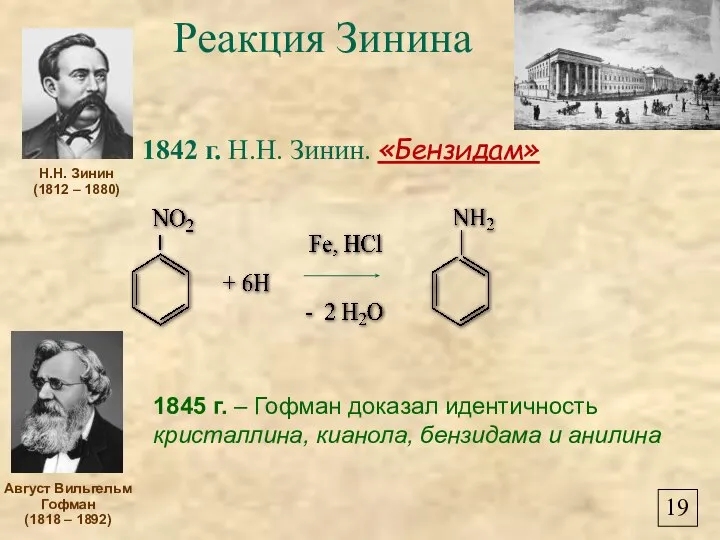
- 21. Реакция Зинина 1842 г. Н.Н. Зинин. «Бензидам» Н.Н. Зинин (1812 – 1880) 1845 г. – Гофман
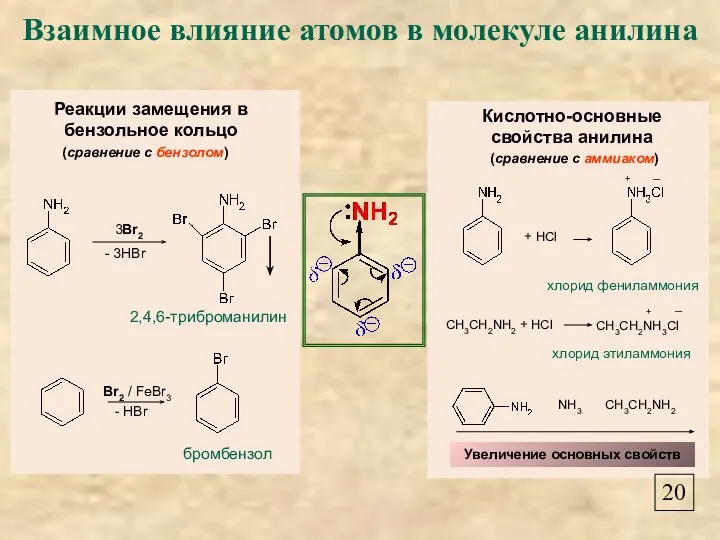
- 22. Взаимное влияние атомов в молекуле анилина 20
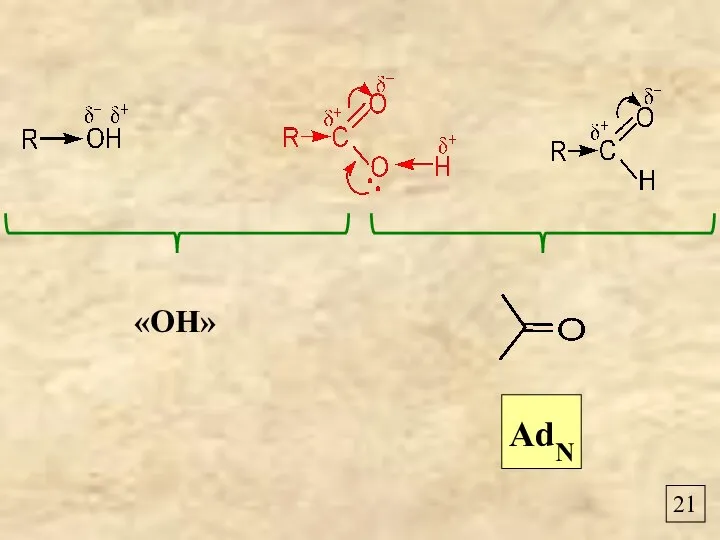
- 23. 21 AdN «OH»
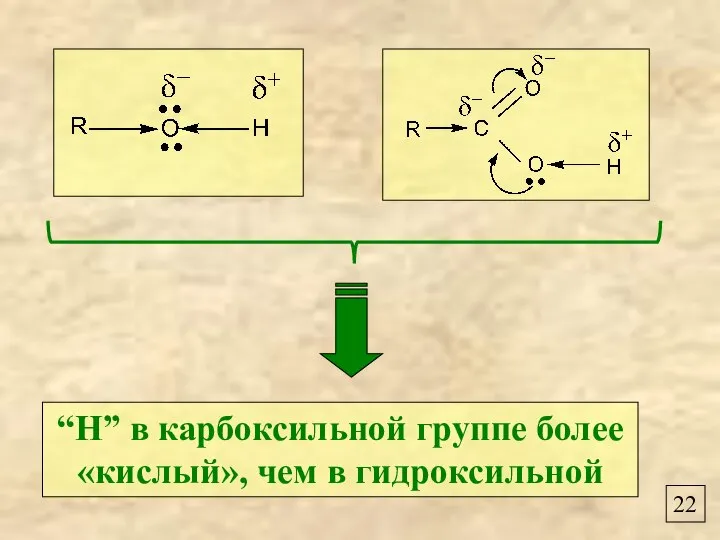
- 24. 22 “Н” в карбоксильной группе более «кислый», чем в гидроксильной
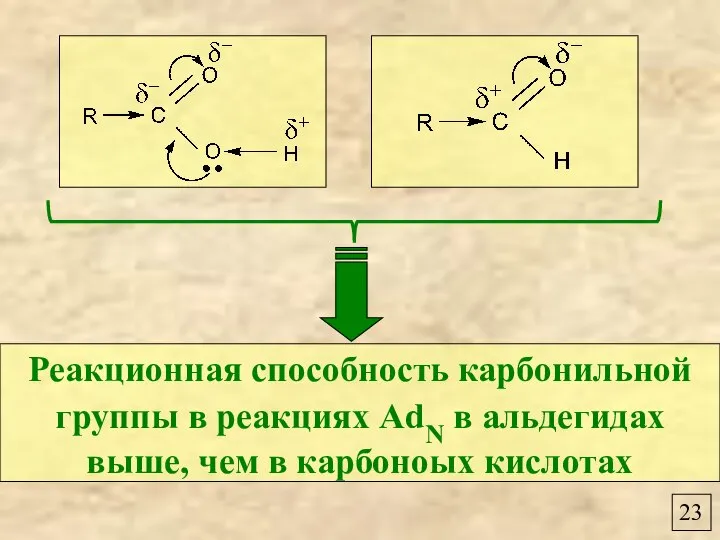
- 25. 23 Реакционная способность карбонильной группы в реакциях AdN в альдегидах выше, чем в карбоноых кислотах
- 27. Скачать презентацию

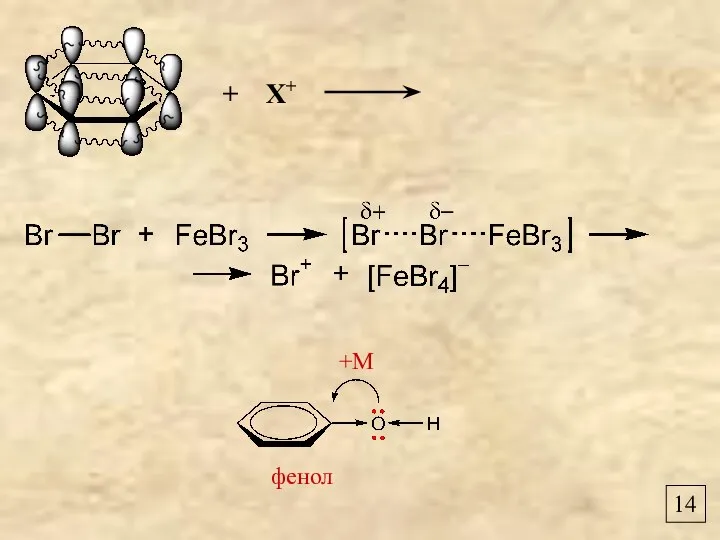
 Продукты - рекордсмены по содержанию различных минеральных компонентов
Продукты - рекордсмены по содержанию различных минеральных компонентов Научные основы управления свойствами композиционных пленок для электролюминесцентных устройств
Научные основы управления свойствами композиционных пленок для электролюминесцентных устройств Оксиды. Классификация и химические свойства
Оксиды. Классификация и химические свойства Митохондрии и пластиды
Митохондрии и пластиды Классификация нефтей и товарных нефтепродуктов. Основные свойства нефтепродуктов
Классификация нефтей и товарных нефтепродуктов. Основные свойства нефтепродуктов Узагальнення знань з теми «Вуглеводні»
Узагальнення знань з теми «Вуглеводні» Реакции при участии катализатора
Реакции при участии катализатора Хімія в стоматології
Хімія в стоматології Химия органических соединений. Углеводороды
Химия органических соединений. Углеводороды Водородная связь
Водородная связь Валентність
Валентність  Cоляная кислота и ее соли
Cоляная кислота и ее соли Хімічний склад і використання мінералів
Хімічний склад і використання мінералів Презентация по Химии "Нефть" - скачать смотреть бесплатно
Презентация по Химии "Нефть" - скачать смотреть бесплатно Перманганатометрия. Окислительно-восстановительное титрование. (Лекция 8)
Перманганатометрия. Окислительно-восстановительное титрование. (Лекция 8) В ходе каких реакций в природе получаются: глюкоза, фруктоза, сахароза, крахмал, целлюлоза. Области их применения
В ходе каких реакций в природе получаются: глюкоза, фруктоза, сахароза, крахмал, целлюлоза. Области их применения Аттестационная работа. Рабочая программа элективного курса по химии для 8 класса
Аттестационная работа. Рабочая программа элективного курса по химии для 8 класса Углерод. 9 класс
Углерод. 9 класс Оксид марганца
Оксид марганца Галлий. Существование Галлия
Галлий. Существование Галлия Вуглеводи. Класифікація вуглеводів
Вуглеводи. Класифікація вуглеводів Тяжелосредные гидроциклоны
Тяжелосредные гидроциклоны Растворы. Классификация дисперсных систем
Растворы. Классификация дисперсных систем ЩЕЛОЧНЫЕ МЕТАЛЛЫ Выполнили: Патренкина Наталия, Иванова Кристина, ученицы 9«А» класса СОШ №6 Руководитель: Овсяникова Мар
ЩЕЛОЧНЫЕ МЕТАЛЛЫ Выполнили: Патренкина Наталия, Иванова Кристина, ученицы 9«А» класса СОШ №6 Руководитель: Овсяникова Мар Тренировочный вариант заданий для подготовки к ГИА по химии
Тренировочный вариант заданий для подготовки к ГИА по химии Типы химической связи
Типы химической связи Программа элективных курсов «Химические реакции в аналитической химии»
Программа элективных курсов «Химические реакции в аналитической химии» Периодический закон Д.И. Менделеева
Периодический закон Д.И. Менделеева