Содержание
- 2. Растворы вокруг нас Все природные жидкости - растворы
- 3. Существуют ли чистые вещества? Квалификации химических веществ: «Тех.» Техн. чистый. Не менее основного вещества70% «Ч.» Чистый.
- 4. Абсолютно чистых веществ нет! Видишь суслика? — Нет. — И я не вижу. А он есть!
- 5. Классификация растворов Истинные и коллоидные растворы Растворы электролитов и неэлектролитов Растворы сильных и слабых электролитов Окрашенные
- 6. Что такое раствор? Смесь, как минимум, двух веществ. Чем отличается раствор от смеси? Однородный. Растворенное вещество
- 7. Что такое раствор? Фаза – однородная область пространства. Фаза – область пространства, описываемая единой термодинамической функцией.
- 8. Что такое раствор? Компонентами называют не общее число составляющих систему веществ, а такое их число, которое
- 9. Что такое раствор? Раствор – многокомпонентная однофазная система. Чем раствор отличается от соединения и смеси? Раствор
- 10. Типичные структуры железоуглеродистых сплавов. Сталь с 0,65% С (сетка феррита и перлит). Увеличено в 150 раз.
- 11. Примеры растворов и смесей Белильная известь Молоко Нефильтрованное пиво Древесина Кость Кровь Томатный сок Мясной бульон
- 12. Коллоидные растворы Это смеси. Очень тонкие. Растворы промежуточные между истинными растворами и взвесями с размером растворенных
- 13. Истинные растворы Истинные растворы – однофазные, термодинамически устойчивые системы, неограниченно стабильные во времени. Прозрачные системы. Движущими
- 14. Истинные растворы В химической практике наиболее важны растворы, приготовленные на основе жидкого растворителя. Именно жидкие смеси
- 15. Исинные растворы В конце XIX века в науке существовало 2 полярных взгляда на природу растворов. Один
- 16. Способы выражения концентраций
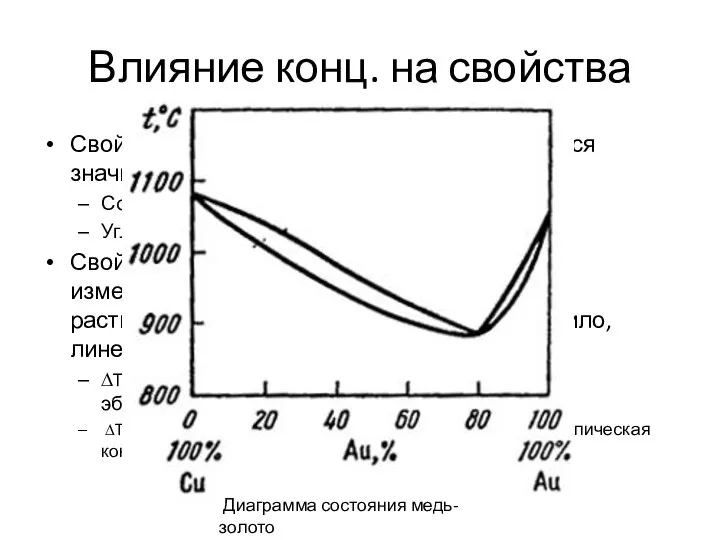
- 17. Влияние конц. на свойства Свойства растворенного вещества изменяются значительно. Соль. Была белой, твердой, тугоплавкой. Углекислый газ.
- 18. Закон Рауля Франсуа Мари Рауль
- 19. Концентрированные и разбавленные растворы.
- 20. Растворы электролитов Растворы веществ проводящих электрический ток. В XIX веке знали, что проводимость свойство заряженных частиц
- 21. Аррениус Отклонения от закона Рауля. Пришлось вводить i – изотонический коэффициент. Сванте Август Аррениус Так было
- 22. Сильные и слабые электролиты Сильные электролиты – хорошо проводят электрический ток. Распадаются на ионы полностью. Растворы
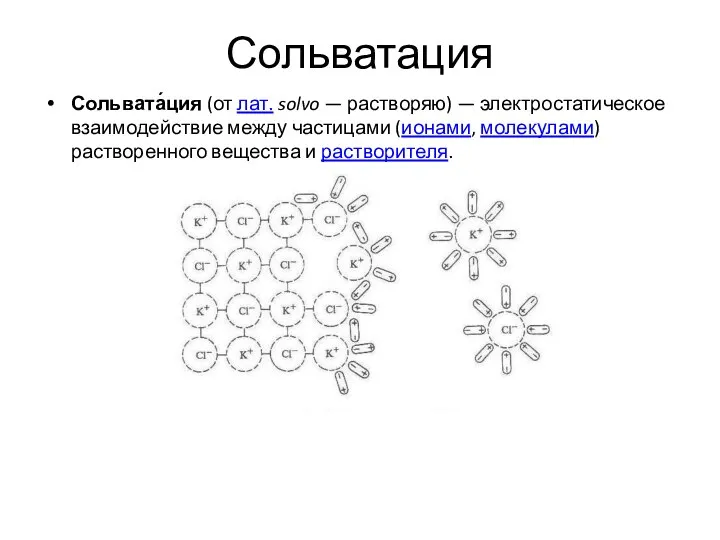
- 23. Сольватация Сольвата́ция (от лат. solvo — растворяю) — электростатическое взаимодействие между частицами (ионами, молекулами) растворенного вещества
- 24. Сольватация От алхимиков: Подобное в подобном. (лат. similia similibus curentur) Вода и масло Вода, I2 и
- 25. Концентрации сильных электролитов При растворении образуется всегда больше ионов, чем исходного вещества. NaCl → Na+ +
- 26. Уравнение электронейтральности
- 27. Правило фаз
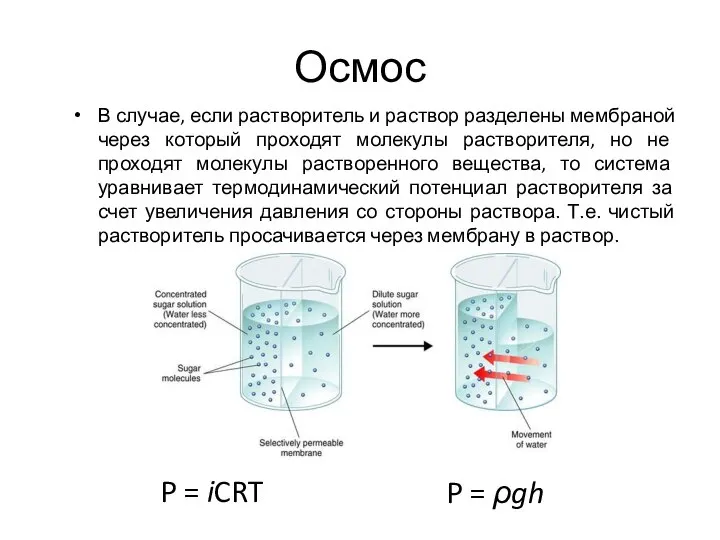
- 28. Осмос В случае, если растворитель и раствор разделены мембраной через который проходят молекулы растворителя, но не
- 29. Осмос Состояние эритроцита в растворах NаСI различной концентрации (в гипотоническом растворе - осмотический гемолиз).
- 31. Скачать презентацию

























 Комплексы хлорида и иодида цинка (II) с карбамидом: синтез, характеристика и биологическая активность
Комплексы хлорида и иодида цинка (II) с карбамидом: синтез, характеристика и биологическая активность Аттестационная работа. Рабочая программа курса внеурочной деятельности «Химия. Мои первые опыты»
Аттестационная работа. Рабочая программа курса внеурочной деятельности «Химия. Мои первые опыты» Презентация по Химии "Д. И. Менделеев и Искусство" - скачать смотреть
Презентация по Химии "Д. И. Менделеев и Искусство" - скачать смотреть 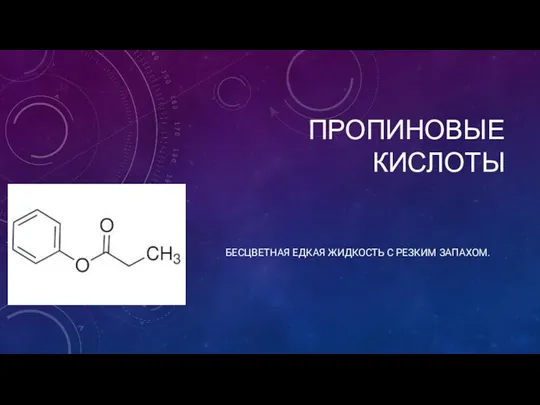 Пропиновые кислоты
Пропиновые кислоты Железо как химический элемент
Железо как химический элемент Коэффициент концентрации меди
Коэффициент концентрации меди Презентация по Химии "Презентация Дисперсия света" - скачать смотреть
Презентация по Химии "Презентация Дисперсия света" - скачать смотреть  Углеводороды: классификация
Углеводороды: классификация Непредельные углероды. Алкены
Непредельные углероды. Алкены Изомерия органических соединений
Изомерия органических соединений Азолы. Гетероциклы с двумя гетероатомами
Азолы. Гетероциклы с двумя гетероатомами Эндогенная серия. Альбитит-грейзеновая группа
Эндогенная серия. Альбитит-грейзеновая группа Углерод и его соединения
Углерод и его соединения Электрохимические процессы
Электрохимические процессы Конструкционные функциональные волокнистые композиты
Конструкционные функциональные волокнистые композиты Презентация по Химии "В мире веществ и реакций" - скачать смотреть
Презентация по Химии "В мире веществ и реакций" - скачать смотреть  Аттестационная работа. Методразработка по проведению исследовательской работы Выращивание кристаллов в домашних условиях
Аттестационная работа. Методразработка по проведению исследовательской работы Выращивание кристаллов в домашних условиях Углеводы
Углеводы Неорганические соединения. Тест
Неорганические соединения. Тест Загальна характеристика галогенів. (Тема 7)
Загальна характеристика галогенів. (Тема 7) Хімічні добавки. Е-числа
Хімічні добавки. Е-числа Поняття про валентність. Ребус
Поняття про валентність. Ребус Химия p-элементов
Химия p-элементов Рафинирование металлических расплавов
Рафинирование металлических расплавов Химическая посуда и лабораторное оборудование
Химическая посуда и лабораторное оборудование Gmp – тиісті өндірістік тәжірибе
Gmp – тиісті өндірістік тәжірибе Производные ненасыщенных полиокси-γ-лактонов
Производные ненасыщенных полиокси-γ-лактонов Клиническая биохимия азотистого обмена. (Лекция 7)
Клиническая биохимия азотистого обмена. (Лекция 7)