Содержание
- 2. План лекции: 1) Понятие о производных ненасыщенных полиокси-γ-лактонов 2) Кислота аскорбиновая
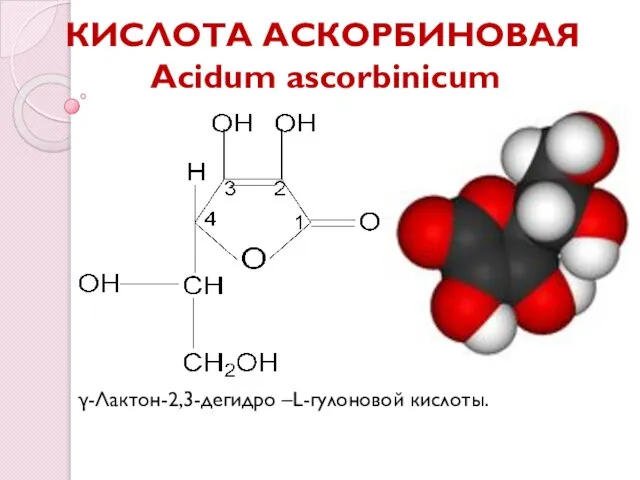
- 3. КИСЛОТА АСКОРБИНОВАЯ Acidum ascorbinicum γ-Лактон-2,3-дегидро –L-гулоновой кислоты.
- 4. Получение: Впервые аскорбиновая кислота была получена из капусты Бессоновым. Синтез был осуществлён в 1933г. В промышленности
- 5. Описание: Кислота аскорбиновая – белый кристаллический порошок без запаха, кислого вкуса; легко растворим в воде и
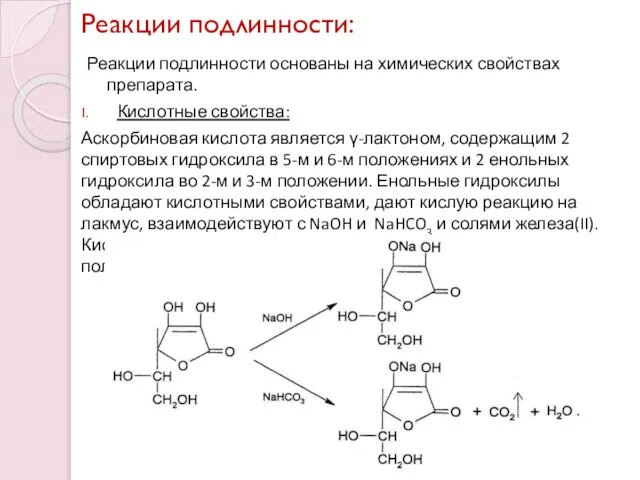
- 6. Реакции подлинности: Реакции подлинности основаны на химических свойствах препарата. Кислотные свойства: Аскорбиновая кислота является γ-лактоном, содержащим
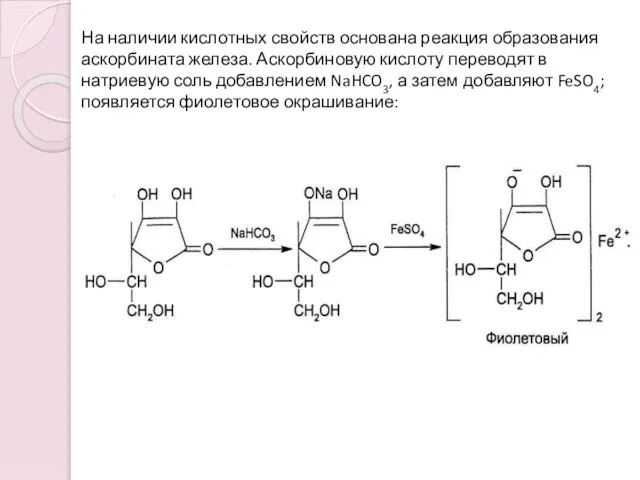
- 7. На наличии кислотных свойств основана реакция образования аскорбината железа. Аскорбиновую кислоту переводят в натриевую соль добавлением
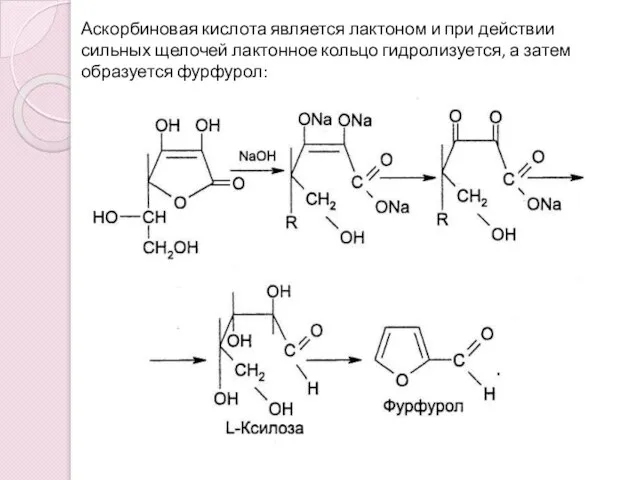
- 8. Аскорбиновая кислота является лактоном и при действии сильных щелочей лактонное кольцо гидролизуется, а затем образуется фурфурол:
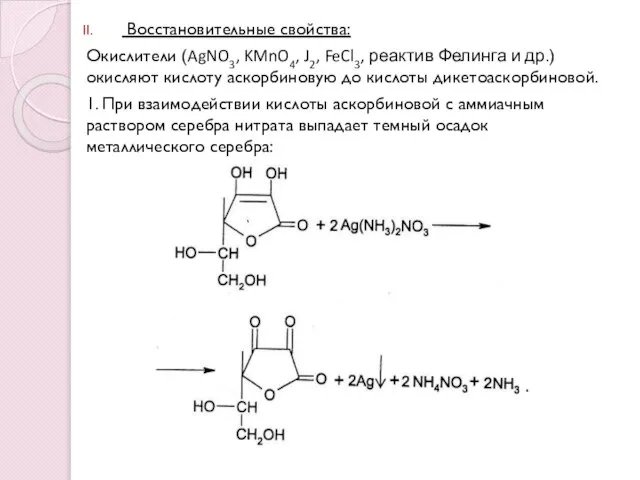
- 9. Восстановительные свойства: Окислители (AgNO3, KMnO4, J2, FeCl3, реактив Фелинга и др.) окисляют кислоту аскорбиновую до кислоты
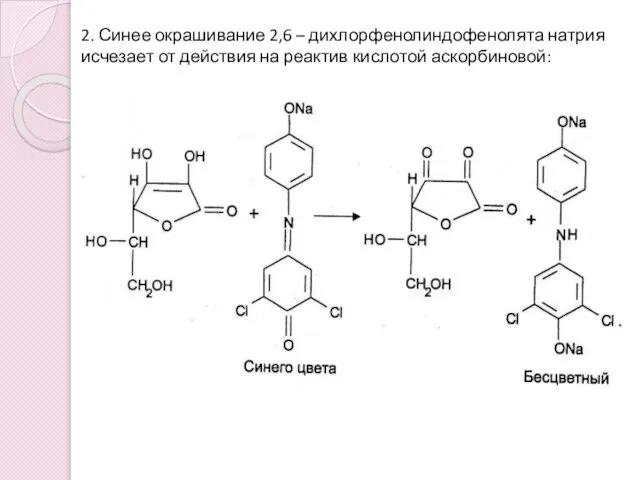
- 10. 2. Синее окрашивание 2,6 – дихлорфенолиндофенолята натрия исчезает от действия на реактив кислотой аскорбиновой:
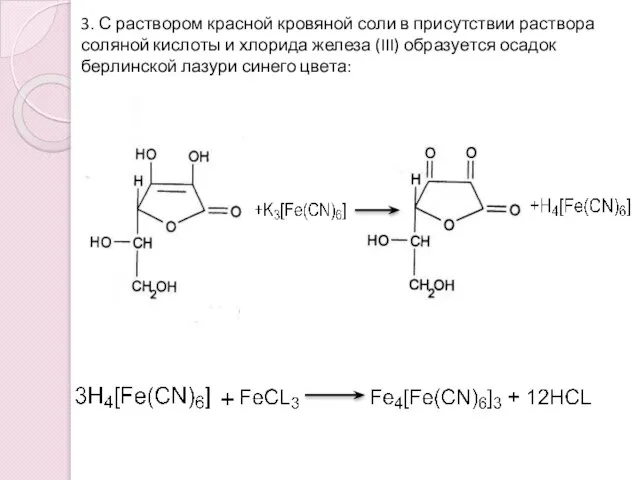
- 11. 3. С раствором красной кровяной соли в присутствии раствора соляной кислоты и хлорида железа (III) образуется
- 12. Испытание на чистоту: В качестве допустимых примесей рассматривают сульфатную золу (не более 0,1%) и тяжелые металлы
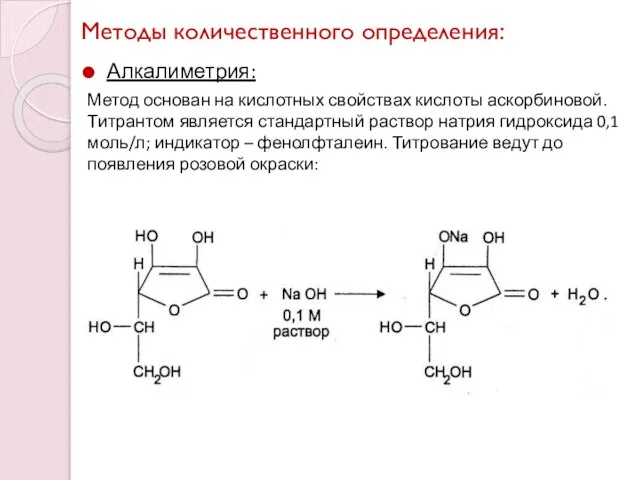
- 13. Методы количественного определения: Алкалиметрия: Метод основан на кислотных свойствах кислоты аскорбиновой. Титрантом является стандартный раствор натрия
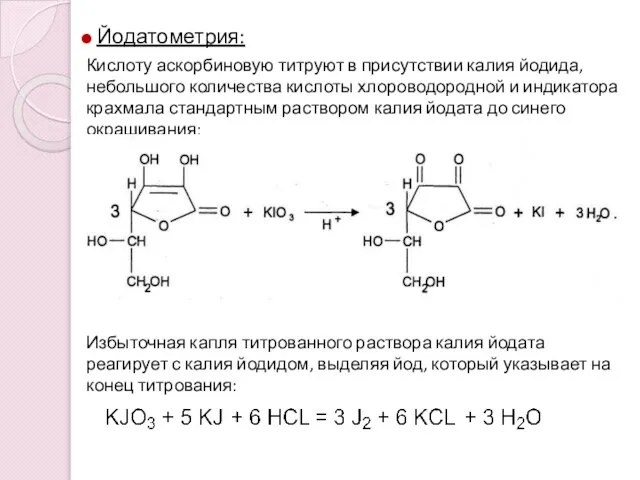
- 14. Йодатометрия: Кислоту аскорбиновую титруют в присутствии калия йодида, небольшого количества кислоты хлороводородной и индикатора крахмала стандартным
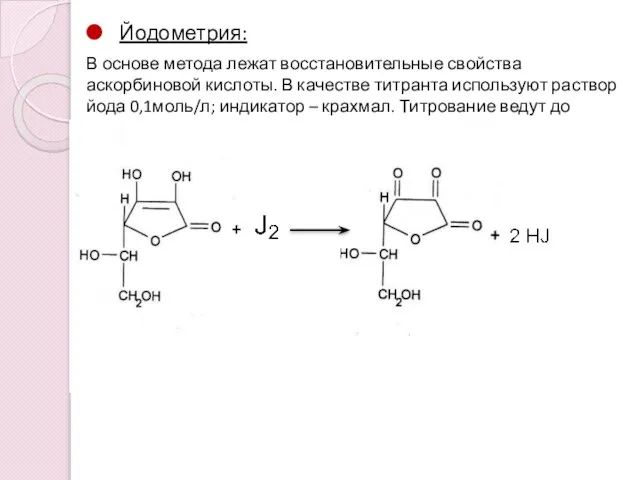
- 15. Йодометрия: В основе метода лежат восстановительные свойства аскорбиновой кислоты. В качестве титранта используют раствор йода 0,1моль/л;
- 16. Применение: Витаминное средство, оказывает метаболическое действие, не образуется в организме человека, а поступает только с пищей.
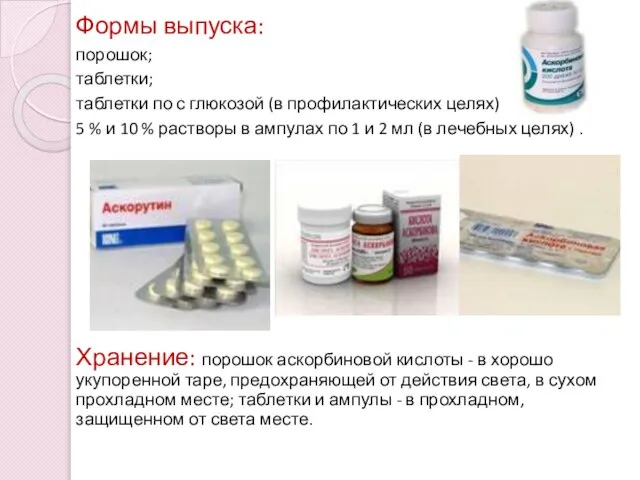
- 17. Формы выпуска: порошок; таблетки; таблетки по с глюкозой (в профилактических целях), 5 % и 10 %
- 19. Скачать презентацию





 Безопасное использование атразина, как гербицида в сельском хозяйстве
Безопасное использование атразина, как гербицида в сельском хозяйстве Білки
Білки  Вода. Химические и физические свойства воды
Вода. Химические и физические свойства воды Комплексные соединения
Комплексные соединения Перекисное окисление липидов. Характеристика, продукты, биологическая и патофизиологическая роль
Перекисное окисление липидов. Характеристика, продукты, биологическая и патофизиологическая роль Презентация на тему: «Химия и пища»
Презентация на тему: «Химия и пища»  19 марта 2010 года
19 марта 2010 года Общие схемы синтеза гетероциклов
Общие схемы синтеза гетероциклов Биохимия гормонов
Биохимия гормонов Взаимодействие в двухкомпонентных системах. Примитивные виды взаимодействия: без промежуточных фаз
Взаимодействие в двухкомпонентных системах. Примитивные виды взаимодействия: без промежуточных фаз Свойства растворов ВМС
Свойства растворов ВМС Оксиды углерода (II) и (IV). Качественная реакция на углекислый газ.
Оксиды углерода (II) и (IV). Качественная реакция на углекислый газ. Витамины. Классификация витаминов
Витамины. Классификация витаминов Презентация по Химии "8 класс Викторина «Что это?»" - скачать смотреть
Презентация по Химии "8 класс Викторина «Что это?»" - скачать смотреть  Алкины (ацетиленовые углеводороды). Номенклатура, изомерия, физические свойства
Алкины (ацетиленовые углеводороды). Номенклатура, изомерия, физические свойства Хімічна і біологічна зброя Виконала: учениця 10-ФМ класу Сосєдка Катерина
Хімічна і біологічна зброя Виконала: учениця 10-ФМ класу Сосєдка Катерина  Липиды. Насыщенные и ненасыщенные жирные кислоты
Липиды. Насыщенные и ненасыщенные жирные кислоты Презентация для класса Способы получения натрия
Презентация для класса Способы получения натрия  Дисперсные системы. Основные понятия
Дисперсные системы. Основные понятия Учебный проект Решение расчетных задач на сплавы, смеси и растворы различными методами. Автор проекта :ученица 9 клас
Учебный проект Решение расчетных задач на сплавы, смеси и растворы различными методами. Автор проекта :ученица 9 клас Теория валентных связей
Теория валентных связей Занимательные задачи по химии
Занимательные задачи по химии Углеводный обмен. Глюкоза крови
Углеводный обмен. Глюкоза крови Нефть, состав, свойства, переработка
Нефть, состав, свойства, переработка Строение атома
Строение атома Душистые вещества животного и растительного происхождения
Душистые вещества животного и растительного происхождения Нефть, её производство, авиационное и дизельное топливо
Нефть, её производство, авиационное и дизельное топливо АЛЮМИНИЙ Овчинникова Ольга Анатольевна Учитель химии МБОУ Российская гимназия № 59 г.Улан-Удэ
АЛЮМИНИЙ Овчинникова Ольга Анатольевна Учитель химии МБОУ Российская гимназия № 59 г.Улан-Удэ