Содержание
- 2. Растворы – это макроскопически однородные смеси двух или большего числа веществ (компонентов), образующие термодинамически равновесные системы.
- 3. Пример: Вода – это растворитель, если растворить твердое вещество (глюкозу) или газ (СО2 ). - А
- 4. Содержание и распределение воды в организме человека ~ 60 % от общей массы тела человека составляет
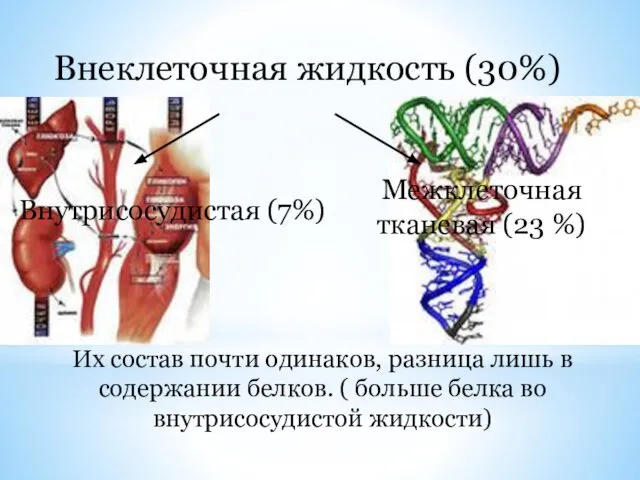
- 6. Внеклеточная жидкость (30%) Внутрисосудистая (7%) Межклеточная тканевая (23 %) Их состав почти одинаков, разница лишь в
- 7. В биохимических процессах вода выступает как : Растворитель Реагент Продукт реакции
- 8. Вода- универсальный растворитель Существование межмолекулярных водородных связей определяет аномальные физические свойства воды: 1. Высокая теплоемкость -…
- 9. Н2О – универсальный растворитель, наличие аномальных свойств ее играет важную физиологическую и биологическую роль. Биохимические процессы
- 10. «Вода! У тебя нет ни вкуса, ни цвета, ни запаха, тебя не опишешь, тобой наслаждаешься, не
- 11. Термодинамика процесса растворения Растворение – процесс самопроизвольный, поэтому ∆Gрастворения ∆Gрастворения = ∆Н растворения –Т ∆Sрастворения
- 12. Энергетическая характеристика растворения ∆Н растворения = ∆Н фаз. перехода + ∆Н гидратации 1. Рассмотрим растворение твердого
- 13. 1. Если |∆Н ф. п. |> |∆Н гидр. |, то ∆Н растворения > 0, эндо-процесс, раствор
- 14. Энтропийная характеристика растворения ∆Sрастворения = ∆S фаз. перехода + ∆S гидратации >> 0 т.к. уменьшается число
- 15. 2. Рассмотрим растворение газообразного вещества в воде. Обычно ∆Sрастворения газов ∆Нрастворения=∆G растворения + Т ∆Sрастворения ∆Gраств.
- 16. Реальные и идеальные растворы ∆Н р-ния = 0, ∆Gр-ния =– Т ∆Sр-ния ∆Sр-ния >0
- 17. Коллигативные свойства растворов осмотическое давление 2. понижение давления насыщенного пара растворителя над раствором по сравнению с
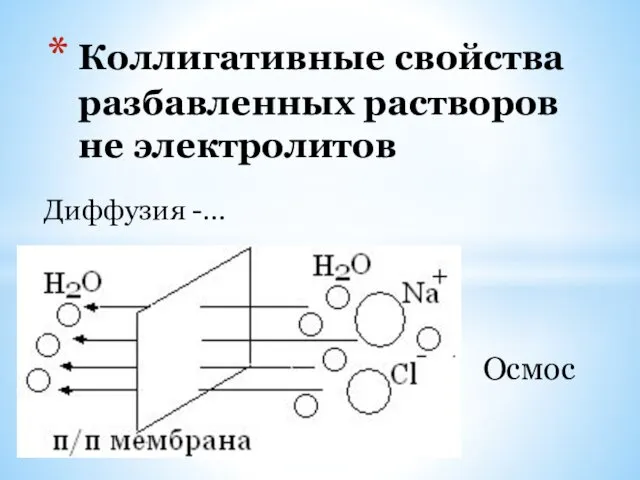
- 18. Коллигативные свойства разбавленных растворов не электролитов Диффузия -… Осмос
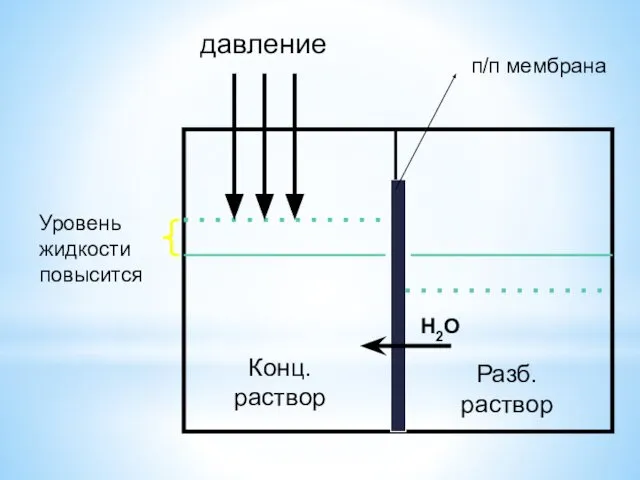
- 19. Конц. раствор Разб. раствор
- 20. В 1886 г. Вант-Гофф экспериментально установил, что Р осм. =СМRT – уравнение Вант-Гоффа. 1м3 = 1000
- 21. РVгаза= nRT уравнение Менделеева-Клапейрона.
- 22. Закон Вант-Гоффа: «Осмотическое давление раствора равно тому давлению, которое оказывало бы растворенное вещество, если бы оно,
- 23. распределение воды между внутриклеточной жидкостью и внеклеточной распределение воды между сосудистым руслом и внесосудистым пространством. Осмос
- 24. Для плазмы крови осмоляльность = 292 ммоль/кг. Она обусловлена: 1. низкомолекулярными веществами-электролитами: соли Na+, K+, Mg2+
- 25. Форменные элементы крови на Росм. не влияют. Р осм. внутри и вне клетки одинаково, т.е. осмоляльность
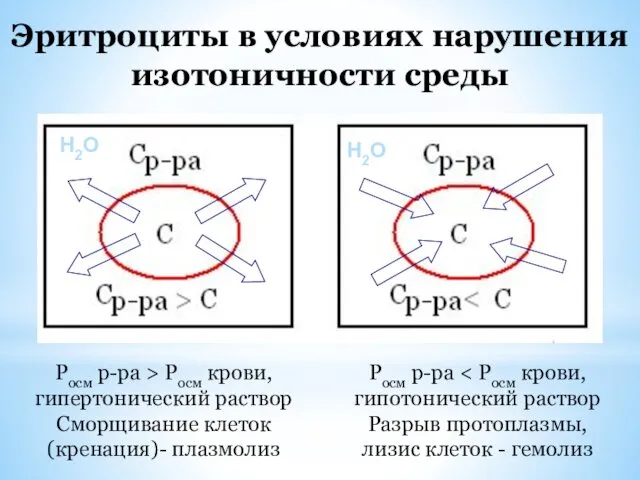
- 26. Эритроциты в условиях нарушения изотоничности среды Росм р-ра > Росм крови, гипертонический раствор Сморщивание клеток (кренация)-
- 27. Если раствор имеет Росм одинаковое с клеткой, то это изотонический раствор. При кровопотерях вводят растворы изотоничные
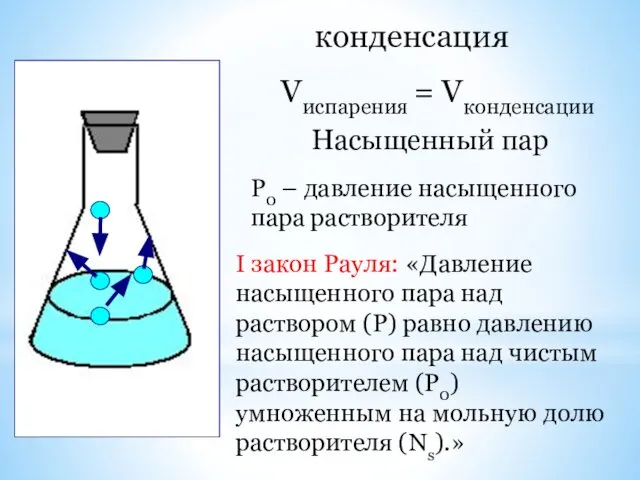
- 28. II. Давление насыщенного пара растворителя испарение
- 29. конденсация Vиспарения = Vконденсации Насыщенный пар Р0 – давление насыщенного пара растворителя I закон Рауля: «Давление
- 30. Р0 – Р = ΔР ; ΔР- абсолютное понижение давления насыщенного пара р-ля над р-ом Р
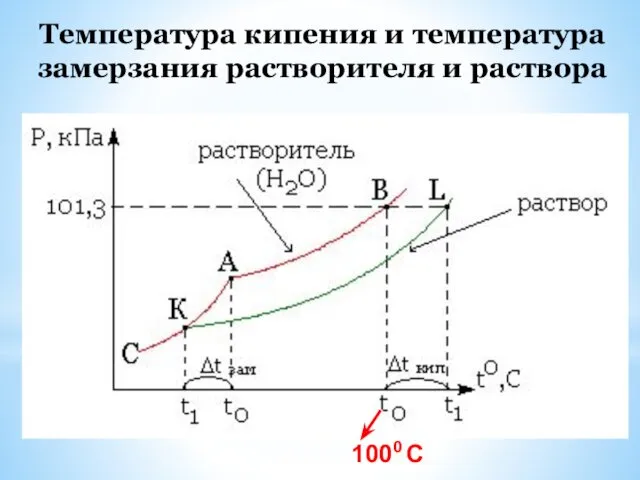
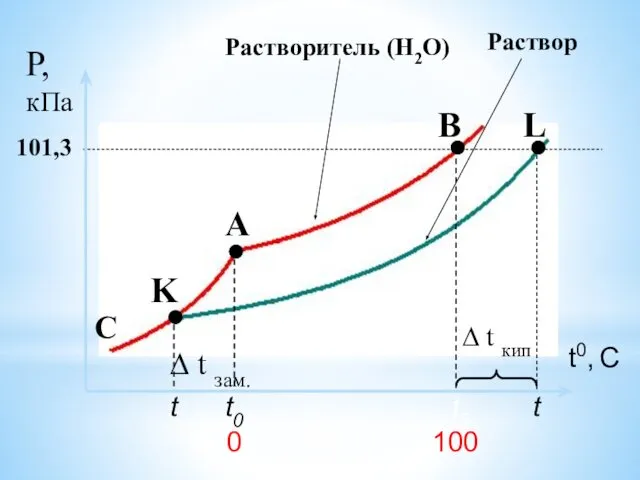
- 31. Температура кипения и температура замерзания растворителя и раствора
- 32. t0 t ∆ t кип t0 t ∆ t зам.
- 33. Е- эбулиоскопическая постоянная, К- криоскопическая постоянная, Сm- моляльность раствора. Для Н2О: Е= 0,53 кг⋅град / моль,
- 34. Криометрия, эбулиометрия
- 35. Коллигативные свойства разбавленных растворов электролитов Росм = См ⋅ R ⋅ T P = P0⋅ Ns
- 36. В 1887 г. Вант-Гофф ввел изотонический коэффициент – i (i>1) Росм = i ⋅ См ⋅
- 37. Электролитами называются вещества, которые в растворе или в расплаве частично или полностью распадаются на ионы и
- 38. В 1887г. шведский учёный С. Аррениус для объяснения особенностей водных растворов веществ предложил теорию электролитической диссоциации.
- 39. 1.Молекулы электролитов при растворении или расплавлении распадаются на ионы (+) и (-) заряженные. Процесс распада молекул
- 40. 2. Ионы движутся хаотически, а при пропускании электролитического тока (+) заряженные частицы (Kat) двигаются к (-)
- 41. 3. Диссоциация - процесс обратимый. Наряду с ионизацией - распадом молекул на ионы идет процесс ассоциации
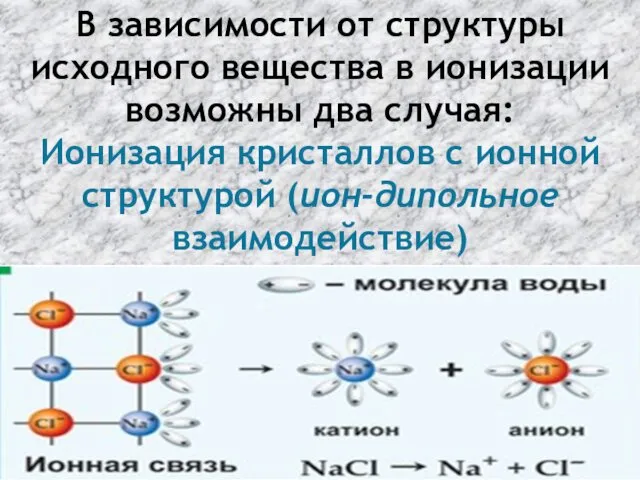
- 42. В зависимости от структуры исходного вещества в ионизации возможны два случая: Ионизация кристаллов с ионной структурой
- 43. Ионизация соединений, состоящих из полярных молекул ( HCl; HNO3; NaOH и другие), отмечается диполь- дипольное взаимодействие.
- 44. Теория Аррениуса не учитывала влияние растворителя на процесс ионизации. Д. И. Менделеев и И. А. Каблуков
- 45. Образование гидратных (сальватных) оболочек способствует уменьшению электростатического взаимодействия ионов. Ослабление этого процесса происходит тем сильнее, чем
- 47. По степени ионизации электролиты условно делят на: сильные (α > 30%), к ним относят почти все
- 48. cлабые (α это большинство органических кислот, а также H2S, HCN, H2CO3, H2SO3, HClO, H2O, H3BO3, Hg2Cl2,
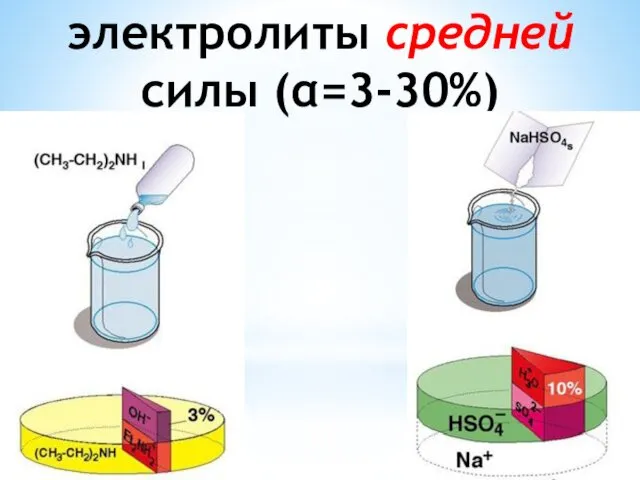
- 49. электролиты средней силы (α=3-30%)
- 51. На степень электролитической диссоциации влияют: ТЕМПЕРАТУРА: для эндотермических процессов (∆H > 0) увеличение t°C способствует >
- 52. ДОБАВЛЕНИЕ ОДНОИМЕННОГО ИОНА: CH3COOH ↔ CH3OO¯ + H+ Например, введение сильного электролита CH3COONa ↔ CH3COO¯ +
- 55. Суммарное уравнение: H2CO3 + 2H2O ↔ 2H3O+ + CO32- Ксум = К1·К2 Распад электролита по каждой
- 57. Эта формула отражает закон Оствальда: степень диссоциации слабого электролита возрастает с разбавлением раствора. Сильные электролиты не
- 58. ТЕОРИЯ ВОДНЫХ РАСТВОРОВ СИЛЬНЫХ ЭЛЕКТРОЛИТОВ сформулирована в 1923году Дебаем и Хюккелем: 1. Сильные электролиты в растворе
- 59. 2. В мало разбавленных растворах сильных электролитов среднее расстояние между ионами мало, а силы межионного взаимодействия
- 60. Каждый ион электролита окружен противоположно заряженными ионами, получившими название «ИОННОЙ АТМОСФЕРЫ», которая тормозит движение ионов и
- 61. Вследствие этого снижается эффективность ионов в таких явлениях, как перенос заряда (электрический ток) в растворах, понижение
- 62. Таким образом, можно считать, что во всех процессах участвуют лишь «активные ионы», т.е. ионы, не принимающие
- 63. Активность – эффективная концентрация электролита, в соответствии с которой он участвует в химических процессах. а(х) =
- 64. В идеальных растворах а = С, а в реальных С > a. Экспериментально (f) и (а)
- 66. Количественной характеристикой межионных электростатических взаимодействий является ионная сила раствора - величина измеряемая полу суммой произведений концентраций
- 67. Таким образом, при большой концентрации раствора силы межионного взаимодействия увеличиваются, µ растет, что приводит к уменьшению
- 69. Скачать презентацию

























































 Анионно-координационная полимеризация
Анионно-координационная полимеризация Rate of reactions. (Chapter 2)
Rate of reactions. (Chapter 2) Молекулярная адсорбция. (Лекция 2)
Молекулярная адсорбция. (Лекция 2) Биосфера и организм
Биосфера и организм Аттестационная работа. Программа элективного курса по химии «экологическая химия»
Аттестационная работа. Программа элективного курса по химии «экологическая химия» Теория растворов. Диффузия в растворах. Коллигативные свойства растворов
Теория растворов. Диффузия в растворах. Коллигативные свойства растворов “Физикалық химия” курсы бойынша жеке бағдарланған индивидуалды зерттеу жұмысы
“Физикалық химия” курсы бойынша жеке бағдарланған индивидуалды зерттеу жұмысы Растворы. Задачи
Растворы. Задачи Нанокаталіз. Активність каталізатора
Нанокаталіз. Активність каталізатора Типы окисления. Понятие об антиоксидантной системе
Типы окисления. Понятие об антиоксидантной системе  Биоорганическая химия
Биоорганическая химия Химия Соли. Свойства солей.
Химия Соли. Свойства солей. Рецепты литературы в химических опытах
Рецепты литературы в химических опытах Кремний и его соединения
Кремний и его соединения Термодинамика фазовых превращений
Термодинамика фазовых превращений Концепции химических процессов
Концепции химических процессов Мінеральні добрива
Мінеральні добрива  Школа экспериментов
Школа экспериментов Презентация Лекарства дома
Презентация Лекарства дома Основы химической кинетики и химическое равновесие (лекция 5)
Основы химической кинетики и химическое равновесие (лекция 5) Viscoelasticity
Viscoelasticity Химический элемент селен
Химический элемент селен БЫТОВАЯ ХИМИЯ. МОЮЩИЕ СРЕДСТВА МОУ СОШ № 95 Советского района городского округа г.Уфа
БЫТОВАЯ ХИМИЯ. МОЮЩИЕ СРЕДСТВА МОУ СОШ № 95 Советского района городского округа г.Уфа Знаки химических элементов. Тренажер
Знаки химических элементов. Тренажер Химический состав костей
Химический состав костей Повторение и обобщение знаний по темам "Металлы и сплавы."
Повторение и обобщение знаний по темам "Металлы и сплавы." Ионная полимеризация. Катионная полимеризация
Ионная полимеризация. Катионная полимеризация АЛЮМИНИЙ Овчинникова Ольга Анатольевна Учитель химии МБОУ Российская гимназия № 59 г.Улан-Удэ
АЛЮМИНИЙ Овчинникова Ольга Анатольевна Учитель химии МБОУ Российская гимназия № 59 г.Улан-Удэ