Содержание
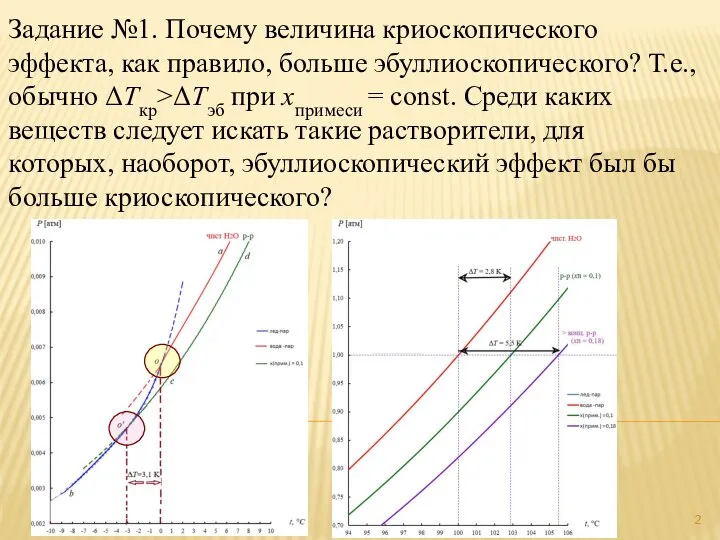
- 2. Задание №1. Почему величина криоскопического эффекта, как правило, больше эбуллиоскопического? Т.е., обычно ΔTкр>ΔTэб при xпримеси =
- 3. Задание №1. Почему величина криоскопического эффекта, как правило, больше эбуллиоскопического? Т.е., обычно ΔTкр>ΔTэб при xпримеси =
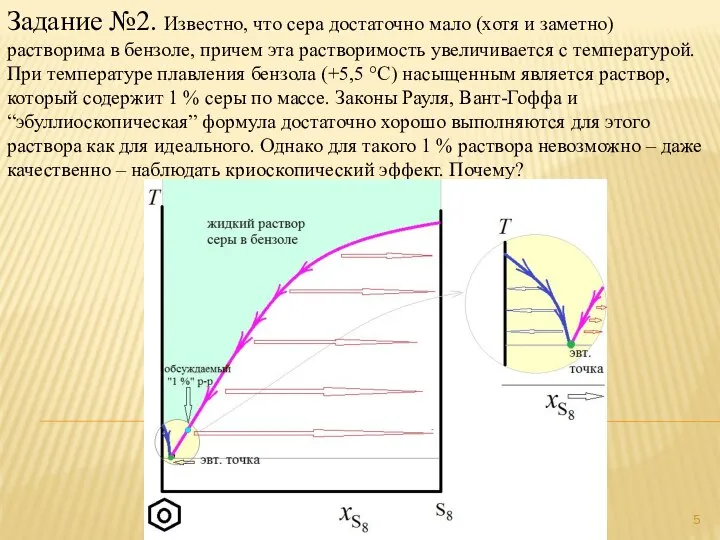
- 4. Задание №2. Известно, что сера достаточно мало (хотя и заметно) растворима в бензоле, причем эта растворимость
- 5. Задание №2. Известно, что сера достаточно мало (хотя и заметно) растворима в бензоле, причем эта растворимость
- 6. Задание №3. В пустой аквариум помещают 2 открытые чашки, содержащие по 100 г жидкостей. В одной
- 7. Задание №3. В пустой аквариум помещают 2 открытые чашки, содержащие по 100 г жидкостей. В одной
- 8. Задание №3а. В пустой аквариум помещают 2 открытые чашки, содержащие по 100 г жидкостей. В одной
- 9. Задание №3а. В пустой аквариум помещают 2 открытые чашки, содержащие по 100 г жидкостей. В одной
- 10. Задание №3а. В пустой аквариум помещают 2 открытые чашки, содержащие по 100 г жидкостей. В одной
- 11. Задание №4. Мысленный эксперимент. Предложите как можно больше способов получения жидкой воды из атмосферного воздуха (например,
- 12. Задание №5. Мысленный эксперимент. Предложите как можно больше способов опреснения морской воды, пользуясь любыми реактивами и
- 13. Задание №6. Мысленный эксперимент. Предложите как можно больше способов приготовить куриное яйцо вкрутую* в высокогорных условиях,
- 14. Задание №7. Просмотреть видео: https://www.youtube.com/watch?v=JIMswYhNGB0 Объяснить происходящие явления более научно, чем в ролике.
- 15. Задание №7. Просмотреть видео: https://www.youtube.com/watch?v=JIMswYhNGB0 Объяснить происходящие явления более научно, чем в ролике. Na2SiO3 + CuCl2
- 16. Задание №8. Некоторый гриб, растущий под слоем асфальта, содержит в своем плодовом теле (т.е. в том,
- 17. Задание №8. Некоторый гриб, растущий под слоем асфальта, содержит в своем плодовом теле (т.е. в том,
- 18. Задание №9. В 100 г раствора на основе фенола содержится 1 г серы. Этот раствор начинает
- 19. Задание №9. В 100 г раствора на основе фенола содержится 1 г серы. Этот раствор начинает
- 20. Задание №10. Определите температуру первичной кристаллизации (с образованием кристаллов бензола) раствора, содержащего 1,24 г белого фосфора
- 21. Задание №10. Определите температуру первичной кристаллизации (с образованием кристаллов бензола) раствора, содержащего 1,24 г белого фосфора
- 22. Задание №11. Расположить 1 % (мол.) растворы следующих веществ в ряд по понижению температуры первичной кристаллизации.
- 23. Задание №11. Расположить 1 % (мол.) растворы следующих веществ в ряд по понижению температуры первичной кристаллизации.
- 24. Задание №12. Распределите следующие растворы 0,01 М водные растворы в ряд по возрастанию pH: K2S, K2SO3,
- 25. Задание №13 Произведение растворимости хлорида серебра (+1) составляет при 18 ºС величину 1,1⋅10‑10. При этой же
- 26. Задание №14 При 25 ºС произведение растворимости гидроксида Cd(OH)2 составляет величину 2,1⋅10‑14. Рассчитайте величину pH насыщенного
- 27. Задание №15 Приготовили водный раствор соляной кислоты с концентрацией последней 1⋅10–7. Рассчитайте pH данного раствора. Проконтролируйте
- 28. Задание №16* При температурах, близких к комнатной, произведение растворимости хлорида серебра (+1) составляет величину 1,1⋅10‑10, а
- 30. Скачать презентацию

























 Алексей Евграфович Фаворский и его вклад в победу СССР.
Алексей Евграфович Фаворский и его вклад в победу СССР. Предмет и метод термодинамики. Химическая термодинамика
Предмет и метод термодинамики. Химическая термодинамика Выполнил: ученики 9 класса Проверил: учитель химии Санеева Л.П.
Выполнил: ученики 9 класса Проверил: учитель химии Санеева Л.П. Многообразие углеводородов. Обобщение
Многообразие углеводородов. Обобщение Общие закономерности адсорбции из растворов на поверхности твердого тела. Лекция 05
Общие закономерности адсорбции из растворов на поверхности твердого тела. Лекция 05 8 шагов к кристаллу
8 шагов к кристаллу Урок в 7 класі КЗ Верхівцевського НВК учитель хімії Кукса Н.М.
Урок в 7 класі КЗ Верхівцевського НВК учитель хімії Кукса Н.М.  Презентация по химии Пищевые кислоты
Презентация по химии Пищевые кислоты  Презентация по Химии "Комплексные соединения" - скачать смотреть
Презентация по Химии "Комплексные соединения" - скачать смотреть  В глубине кристалла (11 класс)
В глубине кристалла (11 класс) N-(2-амино-3,5-дибромбензил)-N-метилциклогексанамина гидрохлорид
N-(2-амино-3,5-дибромбензил)-N-метилциклогексанамина гидрохлорид Глинистые породы
Глинистые породы Удивительные свойства латекса и его применение
Удивительные свойства латекса и его применение Презентация по Химии "Великие учёные, внёсшие значительный вклад в развитие химии." - скачать смотреть бесплатно
Презентация по Химии "Великие учёные, внёсшие значительный вклад в развитие химии." - скачать смотреть бесплатно Углеводы. Классификация углеводов
Углеводы. Классификация углеводов Презентация Закон постоянства 8 класс
Презентация Закон постоянства 8 класс Пятая группа элементов
Пятая группа элементов Модифицированные природные полимеры
Модифицированные природные полимеры Презентация по Химии "Хроматографический анализ" - скачать смотреть
Презентация по Химии "Хроматографический анализ" - скачать смотреть  ГИА. Вопрос 10. Химические свойства оксидов: основных, амфотерных, кислотных
ГИА. Вопрос 10. Химические свойства оксидов: основных, амфотерных, кислотных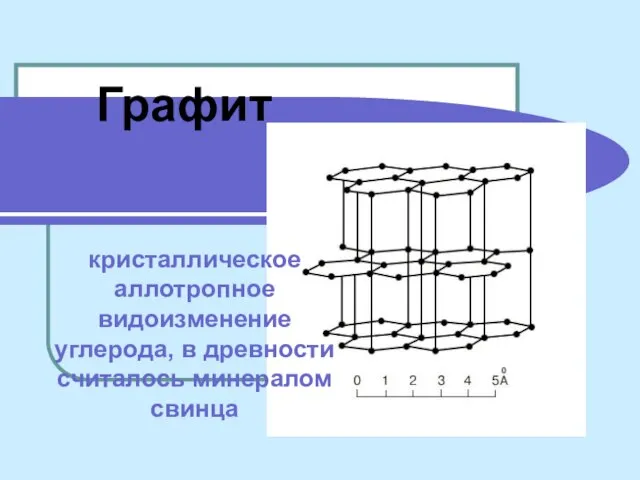 Графит кристаллическое аллотропное видоизменение углерода, в древности считалось минералом свинца
Графит кристаллическое аллотропное видоизменение углерода, в древности считалось минералом свинца Основные сведения о строении атома. Состав атомных ядер
Основные сведения о строении атома. Состав атомных ядер Презентация по Химии "Основные химические понятия" - скачать смотреть
Презентация по Химии "Основные химические понятия" - скачать смотреть  Окислительно-восстановителые реакции в органической химии
Окислительно-восстановителые реакции в органической химии Тест. Общая характеристика металлов главных подгрупп I-III групп в связи с их положением в Периодической системе
Тест. Общая характеристика металлов главных подгрупп I-III групп в связи с их положением в Периодической системе Основные понятия и законы химии
Основные понятия и законы химии Физико-химия поверхностных явлений
Физико-химия поверхностных явлений Презентация по Химии "Природные источники углеводородов" - скачать смотреть
Презентация по Химии "Природные источники углеводородов" - скачать смотреть