Содержание
- 2. Что такое комплексные соединения? Как они образуются? ? NH3, H2O, CO2, KI, HgCl2, CoCl2, …
- 3. Основные положения координационной теории Вернера Что такое комплексная частица ? ? Комплексообразователь: атом металла в
- 4. [PtIV(NH3)6]Cl4 [PtIV(NH3)5Cl]Cl3 [PtIV(NH3)4Cl2]Cl2 [PtIV(NH3)3Cl3]Cl [PtIV(NH3)2Cl4] От эмпирических формул КС к координационным: PtCl4 • 2NH3 PtCl4 •
- 5. NH3 NH3 NH3 NH3 NH3 NH3 CoIII [Co(NH3)6]3+ x + 0 = 3 III Октаэдр 6
- 6. F–Ј F–Ј F–Ј BIII [BF4]– F–Ј x – 4 = –1 III 4 Тетраэдр
- 7. [PtCl4]2– Квадрат ◒ ◒ ◒ ◒ ● Сl– Сl–Ј Сl– Сl– x – 4 = –2
- 8. [Ag(CN)2]– ◑ ◐ ● Линейная стуктура СN– CN– x – 2 = –1 I AgI 2
- 9. Полидентатные лиганды: СH2 – СH2 ╱ ╲ H2N NH2 [Co(en)3]3+ C2O42– Этилендиамин (en) Оксалат-ион [Fe(C2O4)3]3-
- 10. Номенклатура КС NaCl, K2SO4, … ⇦⇐ Порядок перечисления фрагментов комплексной частицы: ✔ Заряженные лиганды (Cl —
- 11. [Zn(NH3)4]SO4 [Co(H2O)2(NH3)3Cl]Cl2 Хлорид хлоротриамминдиаквакобальта (III) Сульфат тетраамминцинка (II) x – 1 = 2 III K4 [Fe(CN)6]
- 12. Диссоциация КС в водных растворах [Cu(NH3)4]SO4 = [Cu(NH3)4]2+ +SO42– [Cu(NH3)4]2+ ⇄ Cu2+ + 4NH3 Скомпл≫ Спрод.дисс
- 13. Двойные соли: (NH4)2SO4 ∙ FeSO4 ∙ 6H2O (соль Мора) KAl(SO4)2 ∙ 12H2O (алюмокалиевые квасцы) (NH4)2[Fe(SO4)2](k)= 2NH4+
- 14. Важнейшие типы КС AlCl3 ∙ 6H2O ≡ [Al(H2O)6]Cl3 Если лигандами является вода комплексы называются аквакомплексами [Co(H2O)6]2+
- 15. Амминокомплексы 2. В амминокомплексах лигандами являются молекулы NH3 [Cu(NH3)4]2+ [Ni(NH3)6]2+ ZnSO4 + 2NH3 ∙ H2O =
- 16. Ацидокомплексы 3. В ацидокомплексах лигандами являются анионы различных кислот. К ним относятся цианидные, галогенидные, карбонатные, оксалатные
- 17. Be(OH)2 + 2NaOH = Na2[Be(OH)4] Гидроксокомплексы 4. В гидроксокомплексах лигандами являются ионы ОН- Na3[Al(OH)6] K2[Sn(OH)6] BeCl2
- 18. [Cu(NH3)4]2+ [Cu(en)2]2+ H3N NH3 ⭨ ⭩ CuII ⭧ ⭦ H3N NH3 CH2— NH2 H2N — CH2
- 19. Природа химической связи в КС [Zn(NH3)4]Cl2 ⮦ Ионная связь Ковалентная связь ⮥ ? –
- 20. ❶ Координационная связь является ковалентной и образована по донорно-акцепторному механизму ⬜ + ⇅ = ⬜ ⇅
- 21. [Cr(H2O)6](NO3)3 Cr0 [Ar] 3d54s1 Cr3+ ⬜⬜⬜⬜⬜ ⬜ ⬜⬜⬜ [Cr(H2O)6]3+ ⬜⬜⬜⬜⬜ ⬜ ⬜⬜⬜ ↑ ↑ ↑ 3d
- 22. K4[Fe(CN)6] Fe0 [Ar] 3d64s2 Fe2+ ⬜⬜⬜⬜⬜ ⬜ ⬜⬜⬜ [Fe(CN)6]4– ⬜⬜⬜⬜⬜ ⬜ ⬜⬜⬜ ⇅ ↑ ↑ ↑
- 23. [Ni(NH3)6]Br2 Ni0 [Ar] 3d84s2 Ni2+ ⬜⬜⬜⬜⬜ ⬜ ⬜⬜⬜ ⇅ ⇅ ⇅ ↑ ↑ 3d 4s 4p
- 24. Na2[Zn(OH)4] Zn0 [Ar] 3d104s2 Zn2+ ⬜⬜⬜⬜⬜ ⬜ ⬜⬜⬜ [Zn(OH)4]2–Ј ⬜⬜⬜⬜⬜ ⬜ ⬜⬜⬜ ⇅ ⇅ ⇅ ⇅
- 25. K2[Ni(CN)4] Ni0 [Ar] 3d84s2 Ni2+ ⬜⬜⬜⬜⬜ ⬜ ⬜⬜⬜ [Ni(СN)4]2–Ј ⬜⬜⬜⬜⬜ ⬜ ⬜⬜⬜ ⇅ ⇅ ⇅ ↑
- 27. Скачать презентацию


![[PtIV(NH3)6]Cl4 [PtIV(NH3)5Cl]Cl3 [PtIV(NH3)4Cl2]Cl2 [PtIV(NH3)3Cl3]Cl [PtIV(NH3)2Cl4] От эмпирических формул КС к координационным:](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1194203/slide-3.jpg)
![NH3 NH3 NH3 NH3 NH3 NH3 CoIII [Co(NH3)6]3+ x + 0 = 3 III Октаэдр 6](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1194203/slide-4.jpg)
![F–Ј F–Ј F–Ј BIII [BF4]– F–Ј x – 4 = –1 III 4 Тетраэдр](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1194203/slide-5.jpg)
![[PtCl4]2– Квадрат ◒ ◒ ◒ ◒ ● Сl– Сl–Ј Сl– Сl–](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1194203/slide-6.jpg)
![[Ag(CN)2]– ◑ ◐ ● Линейная стуктура СN– CN– x – 2 = –1 I AgI 2](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1194203/slide-7.jpg)
![Полидентатные лиганды: СH2 – СH2 ╱ ╲ H2N NH2 [Co(en)3]3+ C2O42– Этилендиамин (en) Оксалат-ион [Fe(C2O4)3]3-](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1194203/slide-8.jpg)

![[Zn(NH3)4]SO4 [Co(H2O)2(NH3)3Cl]Cl2 Хлорид хлоротриамминдиаквакобальта (III) Сульфат тетраамминцинка (II) x – 1](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1194203/slide-10.jpg)
![Диссоциация КС в водных растворах [Cu(NH3)4]SO4 = [Cu(NH3)4]2+ +SO42– [Cu(NH3)4]2+ ⇄](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1194203/slide-11.jpg)

![Важнейшие типы КС AlCl3 ∙ 6H2O ≡ [Al(H2O)6]Cl3 Если лигандами является](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1194203/slide-13.jpg)
![Амминокомплексы 2. В амминокомплексах лигандами являются молекулы NH3 [Cu(NH3)4]2+ [Ni(NH3)6]2+ ZnSO4](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1194203/slide-14.jpg)

![Be(OH)2 + 2NaOH = Na2[Be(OH)4] Гидроксокомплексы 4. В гидроксокомплексах лигандами являются](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1194203/slide-16.jpg)
![[Cu(NH3)4]2+ [Cu(en)2]2+ H3N NH3 ⭨ ⭩ CuII ⭧ ⭦ H3N NH3](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1194203/slide-17.jpg)
![Природа химической связи в КС [Zn(NH3)4]Cl2 ⮦ Ионная связь Ковалентная связь ⮥ ? –](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1194203/slide-18.jpg)

3 Cr0 [Ar] 3d54s1 Cr3+ ⬜⬜⬜⬜⬜ ⬜ ⬜⬜⬜ [Cr(H2O)6]3+ ⬜⬜⬜⬜⬜ ⬜](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1194203/slide-20.jpg)
![K4[Fe(CN)6] Fe0 [Ar] 3d64s2 Fe2+ ⬜⬜⬜⬜⬜ ⬜ ⬜⬜⬜ [Fe(CN)6]4– ⬜⬜⬜⬜⬜ ⬜](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1194203/slide-21.jpg)
![[Ni(NH3)6]Br2 Ni0 [Ar] 3d84s2 Ni2+ ⬜⬜⬜⬜⬜ ⬜ ⬜⬜⬜ ⇅ ⇅ ⇅](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1194203/slide-22.jpg)
![Na2[Zn(OH)4] Zn0 [Ar] 3d104s2 Zn2+ ⬜⬜⬜⬜⬜ ⬜ ⬜⬜⬜ [Zn(OH)4]2–Ј ⬜⬜⬜⬜⬜ ⬜](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1194203/slide-23.jpg)
![K2[Ni(CN)4] Ni0 [Ar] 3d84s2 Ni2+ ⬜⬜⬜⬜⬜ ⬜ ⬜⬜⬜ [Ni(СN)4]2–Ј ⬜⬜⬜⬜⬜ ⬜](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1194203/slide-24.jpg)
 Газы, применяемые при сварке
Газы, применяемые при сварке Кремнийорганические каучуки
Кремнийорганические каучуки Золь. Свойства золи
Золь. Свойства золи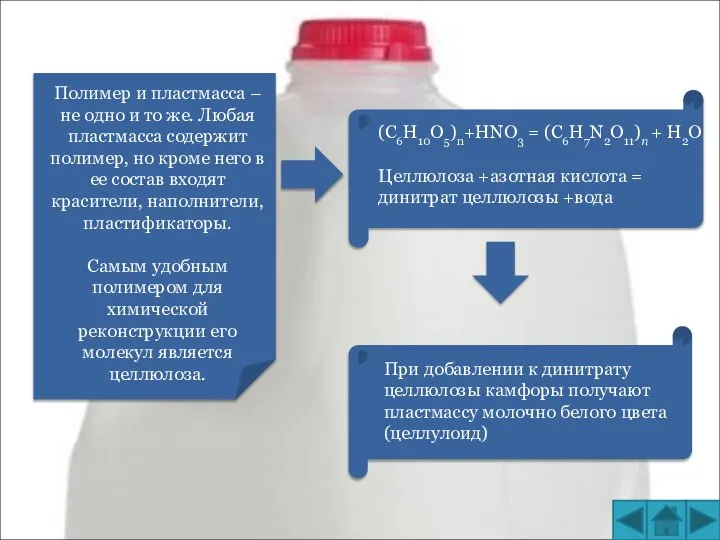 Полимер и пластмасса
Полимер и пластмасса Темір және оның маңызды қосылыстары
Темір және оның маңызды қосылыстары Валентность
Валентность Пиролиз. Современная мировая структура сырья
Пиролиз. Современная мировая структура сырья Металлы в природе. Общие способы получения металлов
Металлы в природе. Общие способы получения металлов Минерал как химическое соединение
Минерал как химическое соединение Кристаллическая решетка
Кристаллическая решетка Химическая связь. Лекция 4
Химическая связь. Лекция 4 Карбон кыш
Карбон кыш Тема 4- фенолы
Тема 4- фенолы Общие электронные конфигурации элементов главных подгрупп
Общие электронные конфигурации элементов главных подгрупп соединения АЗОТА Материал для повторения и подготовки к ГИА Учитель химии МОУ «Гимназия №1»г. Саратова Шишкина И.Ю.
соединения АЗОТА Материал для повторения и подготовки к ГИА Учитель химии МОУ «Гимназия №1»г. Саратова Шишкина И.Ю. Способы выращивания кристаллов (лекция 3)
Способы выращивания кристаллов (лекция 3) Симметрия кристаллов, текстур и элементы кристаллофизики
Симметрия кристаллов, текстур и элементы кристаллофизики 11 хб
11 хб  Виды парфюмерно-косметической косметики
Виды парфюмерно-косметической косметики Углеводы. Глюкоза
Углеводы. Глюкоза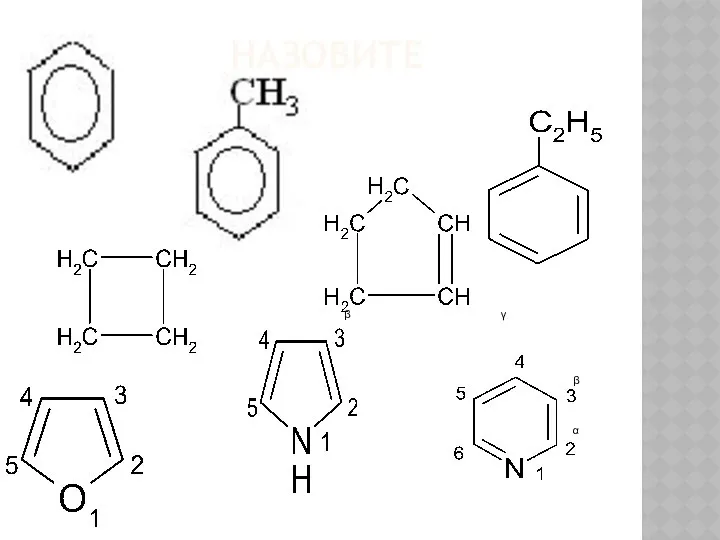 Общие сведения о гетероциклах
Общие сведения о гетероциклах Основные понятия органической химии
Основные понятия органической химии Будова атома. Ядро й електронні оболонки. Склад атомних ядер
Будова атома. Ядро й електронні оболонки. Склад атомних ядер Основы минералогии
Основы минералогии Алюминийорганические соединения
Алюминийорганические соединения Презентация по Химии "Поліпропілен" - скачать смотреть бесплатно
Презентация по Химии "Поліпропілен" - скачать смотреть бесплатно Биотит и тальк
Биотит и тальк Растворы. Способы выражения концентраций. Сильные и слабые электролиты. Закон разведения Оствальда. Лекция 02-1
Растворы. Способы выражения концентраций. Сильные и слабые электролиты. Закон разведения Оствальда. Лекция 02-1