Содержание
- 2. Цели урока Охарактеризовать серу в свете трёх форм существования элемента: в форме атомов, простых веществ (аллотропия),
- 3. План изучения Положение серы в ПСХЭ Строение атома, возможные степени окисления Физические свойства серы Нахождение в
- 4. Положение серы в периодической системе химических элементов Д.И. Менделеева
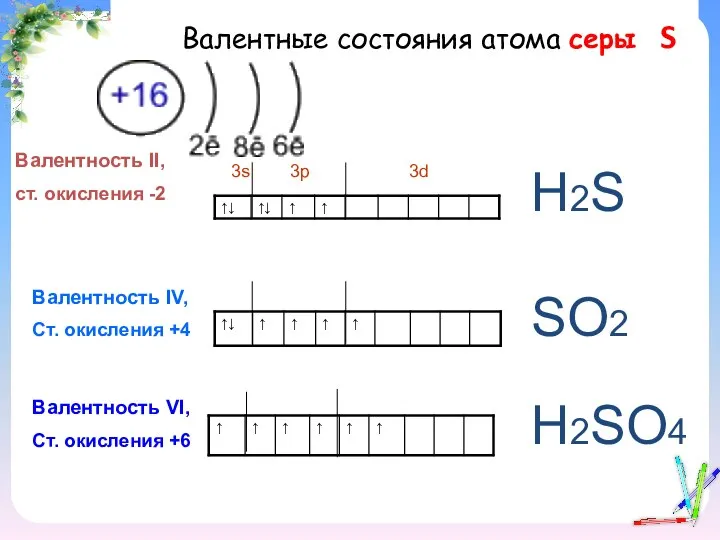
- 5. Валентные состояния атома серы S Валентность II, ст. окисления -2 3s 3p 3d Валентность IV, Ст.
- 6. Физические свойства серы Твёрдое кристаллическое вещество желтого цвета, без запаха Плохо проводит теплоту и не проводит
- 7. Нахождение серы в природе Сера является на 16-м месте по распространённости в земной коре. Встречается в
- 8. Сера также встречается в виде сульфатов - солей серной кислоты - мирабилит
- 9. Пирит – «огненный камень» (соединение серы в природе)
- 10. Сера входит в состав белков. Особенно много серы в белках волос, рогов, шерсти. Кроме этого сера
- 11. Серой богаты бобовые растения (горох, чечевица), овсяные хлопья, яйца
- 12. Аллотропные модификации серы Ромбическая Моноклинная Пластическая
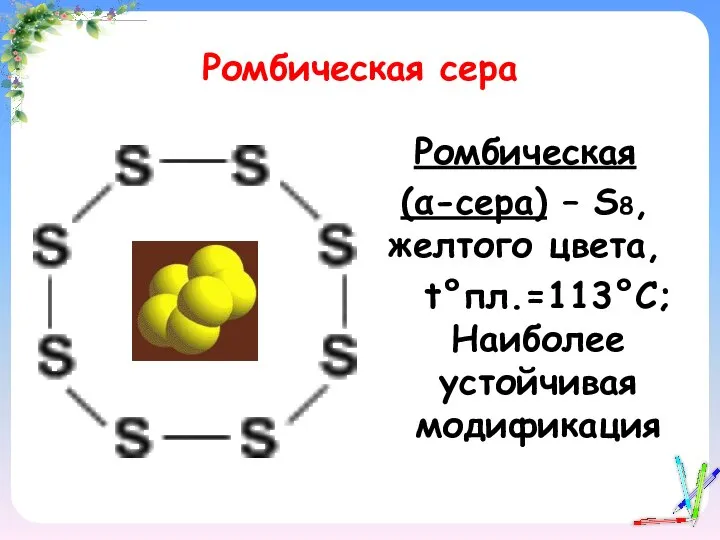
- 13. Ромбическая сера Ромбическая (α-сера) – S8, желтого цвета, t°пл.=113°C; Наиболее устойчивая модификация
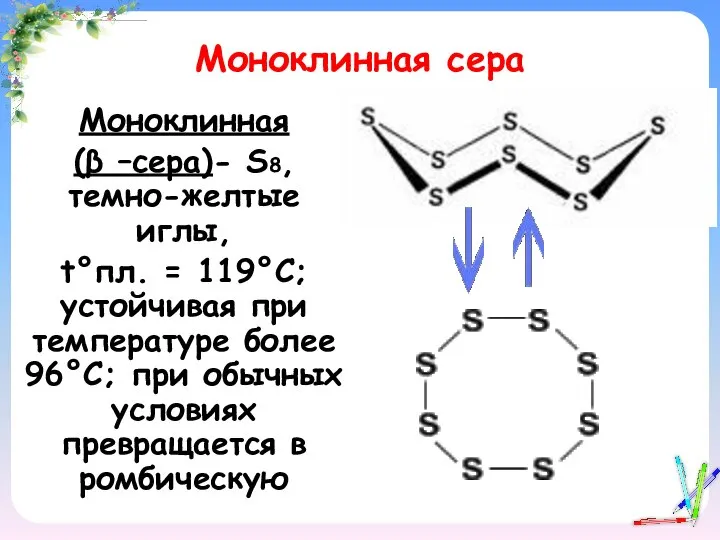
- 14. Моноклинная сера Моноклинная (β –сера)- S8, темно-желтые иглы, t°пл. = 119°C; устойчивая при температуре более 96°С;
- 15. Пластическая сера Пластическая сера- коричневая резиноподобная (аморфная) масса. Она неустойчива и через некоторое время становится хрупкой,
- 16. Химические свойства серы (восстановительные) Сера проявляет в реакциях с сильными окислителями: S - 2ē → S+2;
- 17. Химические свойства серы (окислительные) S0 + 2ē → S-2 4) Сера реагирует со щелочными металлами без
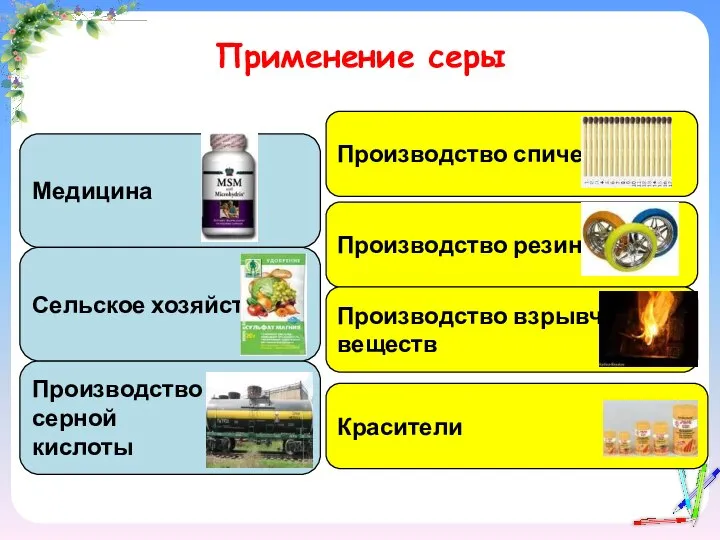
- 18. Применение серы Медицина Производство серной кислоты Сельское хозяйство Производство спичек Производство резины Производство взрывчатых веществ Красители
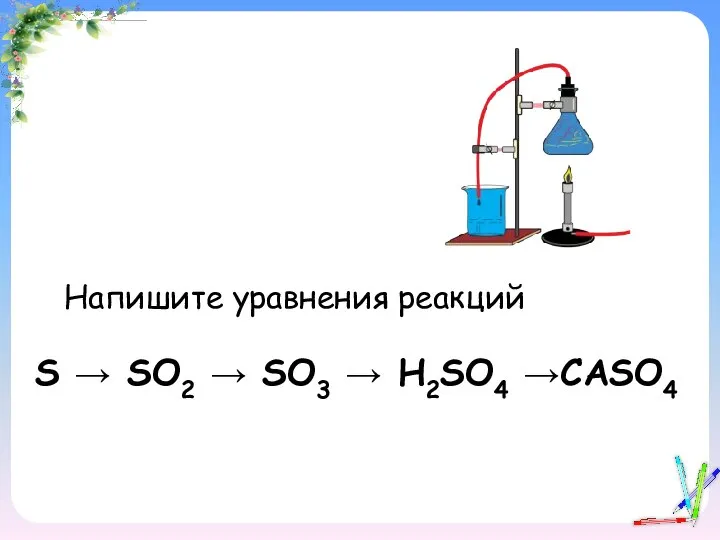
- 19. S → SO2 → SO3 → H2SO4 →CASO4 Напишите уравнения реакций
- 22. Скачать презентацию














 Фенолы Простые эфиры
Фенолы Простые эфиры Лужні метали Властивості, будова, застосування.
Лужні метали Властивості, будова, застосування.  Любовь с точки зрения лаборантов
Любовь с точки зрения лаборантов Презентация по Химии "Озоновый слой - щит Земли" - скачать смотреть
Презентация по Химии "Озоновый слой - щит Земли" - скачать смотреть  Теория растворов (лекция 2)
Теория растворов (лекция 2) Минералогия. Оксиды
Минералогия. Оксиды Ароматты галогентуындылар. Айырылу-қосылу және қосылу айырылу реакциясының механизмі
Ароматты галогентуындылар. Айырылу-қосылу және қосылу айырылу реакциясының механизмі Титриметрический анализ. Сущность титриметрического анализа
Титриметрический анализ. Сущность титриметрического анализа Химия – это область чудес, в ней скрыто счастье человечества, величайшие завоевания разума будут сделаны именно в этой области. (М.
Химия – это область чудес, в ней скрыто счастье человечества, величайшие завоевания разума будут сделаны именно в этой области. (М. Кислоты
Кислоты Вещества преимущественно удушающего действия (пульмонотоксиканты)
Вещества преимущественно удушающего действия (пульмонотоксиканты) Презентация на тему "Кремний"
Презентация на тему "Кремний" Таяние льда
Таяние льда Буферные растворы. Буферная емкость
Буферные растворы. Буферная емкость Щелочноземельные металлы
Щелочноземельные металлы Химия в сельском хозяйстве
Химия в сельском хозяйстве Химические сдвиги ядер
Химические сдвиги ядер Древесина и её топливные свойства
Древесина и её топливные свойства Общая и неорганическая химия
Общая и неорганическая химия Қатты әсер ететін уландырғыш заттар
Қатты әсер ететін уландырғыш заттар Антисептические и дезинфицирующие средства
Антисептические и дезинфицирующие средства Минералы и Близнецы
Минералы и Близнецы Атомно – молекулярное учение
Атомно – молекулярное учение Кислоты, их классификация и свойства
Кислоты, их классификация и свойства IV,III группа периодической системы Д..И. Менделеева. Кислота борная, натрия гидрокарбонат
IV,III группа периодической системы Д..И. Менделеева. Кислота борная, натрия гидрокарбонат Нефть. Состав. Свойства. Переработка
Нефть. Состав. Свойства. Переработка «Химия в искусстве»
«Химия в искусстве»  Презентация Сплавы металлов.
Презентация Сплавы металлов.