Содержание
- 2. А. Арфведсон 1792–1841 гг. Литий был открыт в 1817 г. шведским химиком А. Арфведсоном. Металл назвали
- 3. Г. Деви 1778–1829 гг. Впервые литий был получен английским химиком Г. Дэви в 1818 г.
- 4. Литий Dnn87
- 5. Использование лития
- 6. Использование лития
- 7. Г. Деви 1778–1829 гг. В 1807 г. английский химик и физик Г. Дэви впервые получил натрий
- 8. Натрий Dnn87
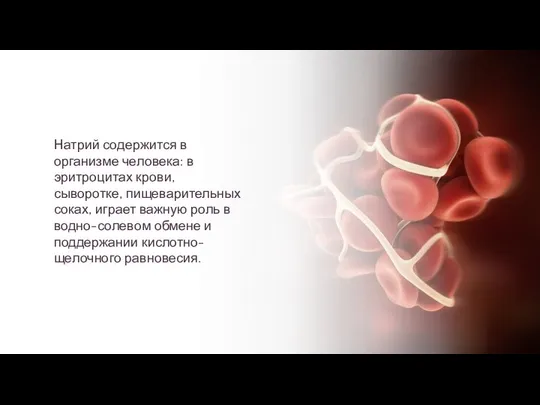
- 10. Натрий содержится в организме человека: в эритроцитах крови, сыворотке, пищеварительных соках, играет важную роль в водно-солевом
- 13. Металлическим натрием восстанавливают из соединений такие ценные металлы, как цирконий, тантал. Цирконий Alchemist-hp Тантал
- 14. Калий Dnn87
- 15. В природе калий встречается только в соединениях с другими элементами, например, в морской воде, во многих
- 17. Калий используют обычно в форме солей. Калийные удобрения — это природные или изменённые в процессе химической
- 18. Калий
- 19. Рубидий
- 20. Рубидий
- 21. Цезий Magnus Manske
- 22. Франций Маргарита Пере 1909–1975 гг. Франций был открыт в 1939 г. Маргаритой Пере. Она же дала
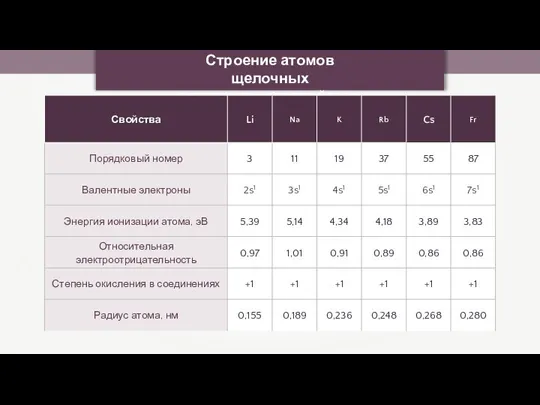
- 23. Строение атомов щелочных металлов и их свойства
- 24. Металлические свойства Металлический блеск Пластичность Мягкость Хорошая электропроводность Хорошая теплопроводность
- 25. Химические свойства металлов Щелочные металлы активно взаимодействуют почти со всеми неметаллами. 2M + H2 = 2MH
- 26. Химические свойства металлов При взаимодействии щелочных металлов с галогенами образуются соли (галогениды металлов). 2M + Cl2
- 27. Химические свойства металлов При взаимодействии щелочных металлов с серой образуются сульфиды металлов. 2M + S =
- 28. Реакция взаимодействия щелочных металлов с кислородом 4Li + O2 = 2Li2O 0 0 +1 –2 t
- 29. Взаимодействия натрия с водой, путём вытеснения воздуха
- 30. При взаимодействии с водой щелочные металлы образуют щёлочи, восстанавливая воду до водорода, и водород. 2Na +
- 31. Соединения щелочных металлов Галит Сильвинит
- 32. Оксиды щелочных металлов Оксиды щелочных металлов являются типичными основными оксидами, они обладают всеми свойствами основных оксидов.
- 33. Гидроксиды щелочных металлов Гидроксиды щелочных металлов являются сильными основаниями. Они участвуют во всех реакциях, характерных для
- 34. Соли щелочных металлов Гидроксид натрия
- 35. Соли щелочных металлов Хлорид натрия
- 36. Соли щелочных металлов
- 37. Соли щелочных металлов
- 39. Скачать презентацию


































 Презентация по Химии "Неорганические кислоты" - скачать смотреть
Презентация по Химии "Неорганические кислоты" - скачать смотреть  Простые и сложные вещества Звонарёва Т.И. Учитель биологии МОУ лицей Г. Электрогорск
Простые и сложные вещества Звонарёва Т.И. Учитель биологии МОУ лицей Г. Электрогорск Спирты. Методы получения
Спирты. Методы получения Закономерности адсорбции ионов и адагуляции коллоидных частиц. Самосборка на поверхности. (Лекция 9)
Закономерности адсорбции ионов и адагуляции коллоидных частиц. Самосборка на поверхности. (Лекция 9) Свойства живого вещества
Свойства живого вещества Нафта Виконала учениця 11-А класу Ковальова Анастасія
Нафта Виконала учениця 11-А класу Ковальова Анастасія  Изотопы, их свойства и применение
Изотопы, их свойства и применение «Химия позволяет раскрыть тайны мироздания»
«Химия позволяет раскрыть тайны мироздания» Адсорбция на границе твердое тело - раствор
Адсорбция на границе твердое тело - раствор Коллоидно-химическая теория схватывания и твердения вяжущих веществ
Коллоидно-химическая теория схватывания и твердения вяжущих веществ Охорона довкілля від забруднень при обробці вуглеводневої сировини Підготували учениці 11-А класу Ковальова Анастасія та Лі
Охорона довкілля від забруднень при обробці вуглеводневої сировини Підготували учениці 11-А класу Ковальова Анастасія та Лі Основы аналитической химии и физико - химических методов анализа
Основы аналитической химии и физико - химических методов анализа Элементы IV группы, побочной подгруппы периодической системы Менделеева
Элементы IV группы, побочной подгруппы периодической системы Менделеева Этот удивительный кремний Без любопытства и фантазии наука невозможна! А. Эйнштейн
Этот удивительный кремний Без любопытства и фантазии наука невозможна! А. Эйнштейн Сущность процесса электролитической диссоциации
Сущность процесса электролитической диссоциации Алкильные, амидные и тетраметилалюминатные комплексы редкоземельных элементов с тридентатным амидинатным лигандом. Синтез
Алкильные, амидные и тетраметилалюминатные комплексы редкоземельных элементов с тридентатным амидинатным лигандом. Синтез Неорганическая химия. Тема №11
Неорганическая химия. Тема №11 Оценка химической обстановки при авариях на химически опасных объектах
Оценка химической обстановки при авариях на химически опасных объектах Производства аммиака. Лекция 7
Производства аммиака. Лекция 7 Альдегіди
Альдегіди  УРОК В 4 КЛАССЕ ОКРУЖАЮЩИЙ МИР
УРОК В 4 КЛАССЕ ОКРУЖАЮЩИЙ МИР  Сложные эфиры R-COOR'
Сложные эфиры R-COOR' Презентация по Химии "Классификация реакций в неорганической химии." - скачать смотреть бесплатно_
Презентация по Химии "Классификация реакций в неорганической химии." - скачать смотреть бесплатно_ Характеристика химического элемента на основании его положения в Периодической системе Д. И. Менделеева Составил: учитель хим
Характеристика химического элемента на основании его положения в Периодической системе Д. И. Менделеева Составил: учитель хим Строение электронной оболочки атома
Строение электронной оболочки атома Витамины. Классификация витаминов
Витамины. Классификация витаминов Виды присадок к моторным топливам
Виды присадок к моторным топливам Ионное уравнения
Ионное уравнения