Содержание
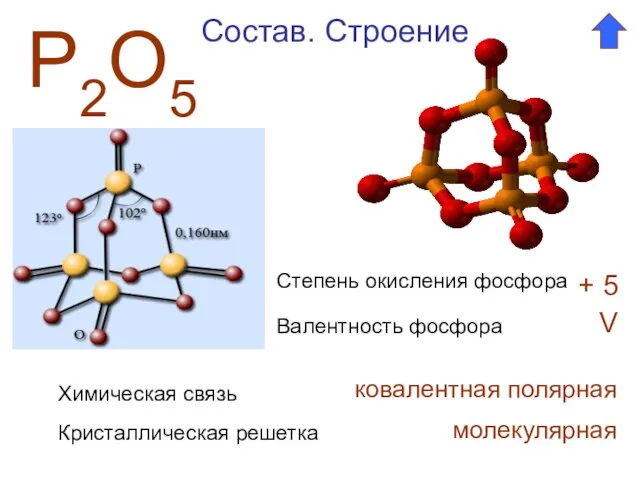
- 2. Р2О5 Степень окисления фосфора + 5 Валентность фосфора V Состав. Строение Химическая связь ковалентная полярная Кристаллическая
- 3. Физические свойства оксида фосфора (V) Оксид фосфора (V), или фосфорный ангидрид, Р2О5 – белый рыхлый порошок.
- 4. Химические свойства оксида фосфора (V) К какой группе оксидов относится оксид фосфора (V) ? Оксид фосфора
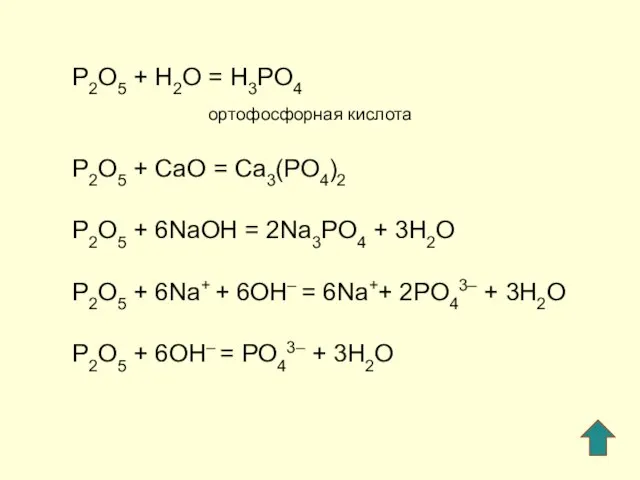
- 5. P2O5 + H2O = H3PO4 ортофосфорная кислота P2O5 + СaO = Ca3(PO4)2 P2O5 + 6NaOH =
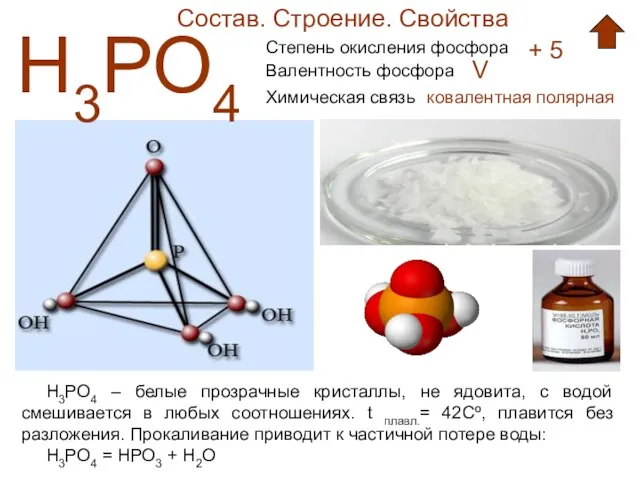
- 6. Состав. Строение. Свойства Н3РО4 Степень окисления фосфора + 5 Валентность фосфора V Химическая связь ковалентная полярная
- 7. Фосфорная кислота (H3РO4). Классификация Фосфорная кислота по: наличию кислорода: основности: растворимости в воде: летучести: степени электролитической
- 8. Химические свойства Фосфорная кислота проявляет все свойства кислот Опишите химические свойства фосфорной кислоты 1) со щелочами:
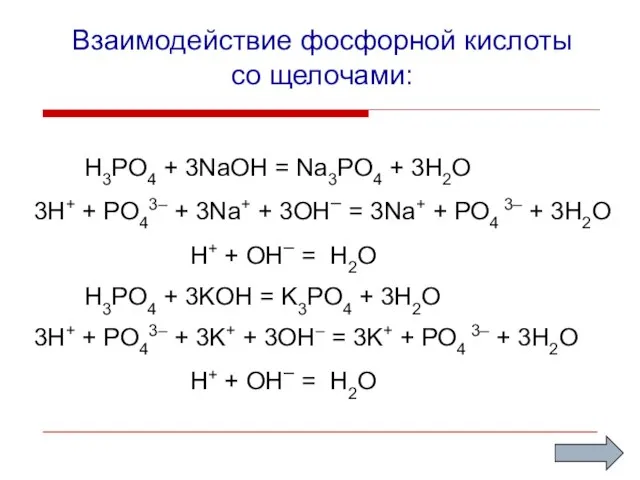
- 9. Взаимодействие фосфорной кислоты со щелочами: H3PO4 + 3NaOH = Na3PO4 + 3H2O 3H+ + PO43– +
- 10. Взаимодействие фосфорной кислоты с основными оксидами: 2H3PO4 + 3Na2O = 2Na3PO4 + 3H2O 6H+ + 2PO43–
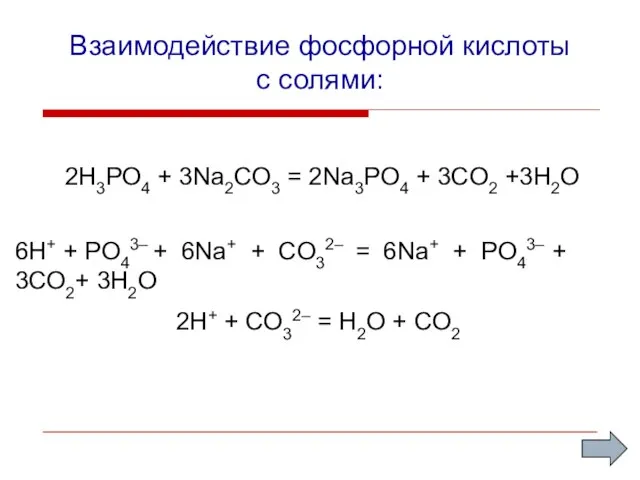
- 11. Взаимодействие фосфорной кислоты с солями: 2H3PO4 + 3Na2CO3 = 2Na3PO4 + 3CO2 +3H2O 2H+ + CO32–
- 12. Качественная реакция на фосфат-ион Лабораторный опыт: Налейте в пробирку 1 мл раствора фосфата натрия и добавьте
- 13. Взаимодействие фосфорной кислоты с металлами Фосфорная кислота может быть слабым окислителем только за счет ионов Н+
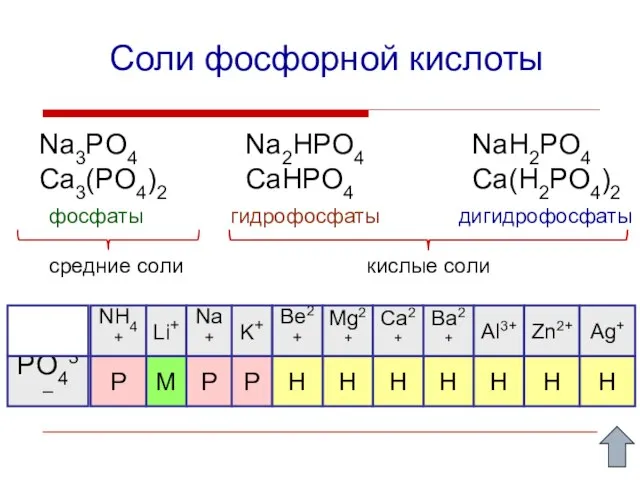
- 14. Соли фосфорной кислоты Na3PO4 Ca3(PO4)2 Na2HPO4 CaHPO4 NaH2PO4 Ca(H2PO4)2 фосфаты гидрофосфаты дигидрофосфаты средние соли кислые соли
- 15. Применение фосфорной кислоты и фосфатов 1 2 3 5 4 7 6 В пищевой промышленности как
- 17. Скачать презентацию








 Растворы. Общая характеристика растворов
Растворы. Общая характеристика растворов Тема 1. Металлы и сплавы
Тема 1. Металлы и сплавы Избыток-недостаток, состав раствора.Типология задач ЕГЭ. Задание 34
Избыток-недостаток, состав раствора.Типология задач ЕГЭ. Задание 34 С + 6 ) ) 2 4 Подготовила: учитель химии Липадкина Г.И.
С + 6 ) ) 2 4 Подготовила: учитель химии Липадкина Г.И. Химическая картина мира
Химическая картина мира Комплексные соединения.
Комплексные соединения. Транспорт веществ через биологические мембраны
Транспорт веществ через биологические мембраны Оксиген
Оксиген Галогены. Способы получения, применение
Галогены. Способы получения, применение Химия и обмен углеводов. Функции углеводов
Химия и обмен углеводов. Функции углеводов Шкала рН
Шкала рН Катализ в химической технологии
Катализ в химической технологии Ядерна зброя. Вплив іонізуючого випромінювання на живий організм
Ядерна зброя. Вплив іонізуючого випромінювання на живий організм Нефть и способы ее переработки
Нефть и способы ее переработки Физическая химия. Химическая термодинамика
Физическая химия. Химическая термодинамика Морфология тел полезных ископаемых
Морфология тел полезных ископаемых Сульфатна кислота. Фізичні та хімічні властивості сульфатної кислоти
Сульфатна кислота. Фізичні та хімічні властивості сульфатної кислоти Регуляция водно-солевого обмена. Обмен кальция и фосфора. Регуляция. (Тема 5)
Регуляция водно-солевого обмена. Обмен кальция и фосфора. Регуляция. (Тема 5) Нитраты в овощах и фруктах
Нитраты в овощах и фруктах Электрохимические системы. Химические источники тока
Электрохимические системы. Химические источники тока Липидтердің метаболизмі
Липидтердің метаболизмі Полимеры, их классификации и способы получения
Полимеры, их классификации и способы получения Растворение. Кристаллогидраты
Растворение. Кристаллогидраты ООО «Ангарский Азотно-туковый завод». Основы производства аммиака
ООО «Ангарский Азотно-туковый завод». Основы производства аммиака Классификация неорганических веществ
Классификация неорганических веществ Кислоты. Состав кислот
Кислоты. Состав кислот Алкадиены. Строение алкадиенов
Алкадиены. Строение алкадиенов Кислородные соединения азота Азотная кислота МБОУ СОШ №30 г.Ростов-на-Дону
Кислородные соединения азота Азотная кислота МБОУ СОШ №30 г.Ростов-на-Дону