Содержание
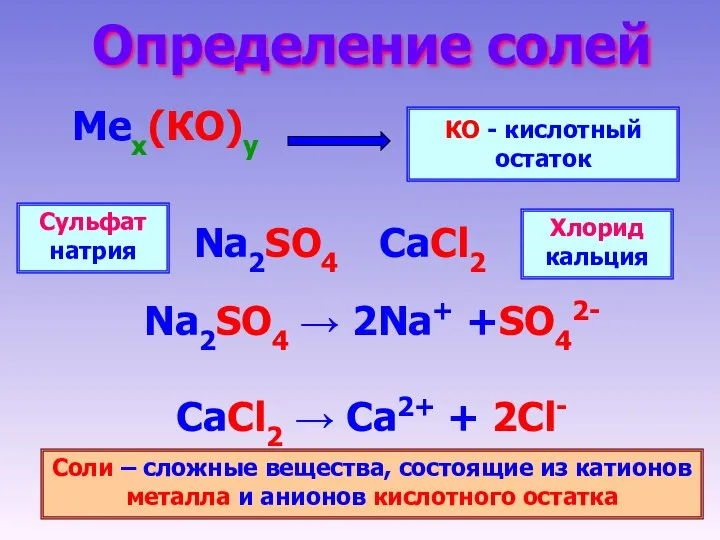
- 2. Определение солей Мех(КО)у КО - кислотный остаток Na2SO4 → 2Na+ +SO42- CaCl2 → Ca2+ + 2Cl-
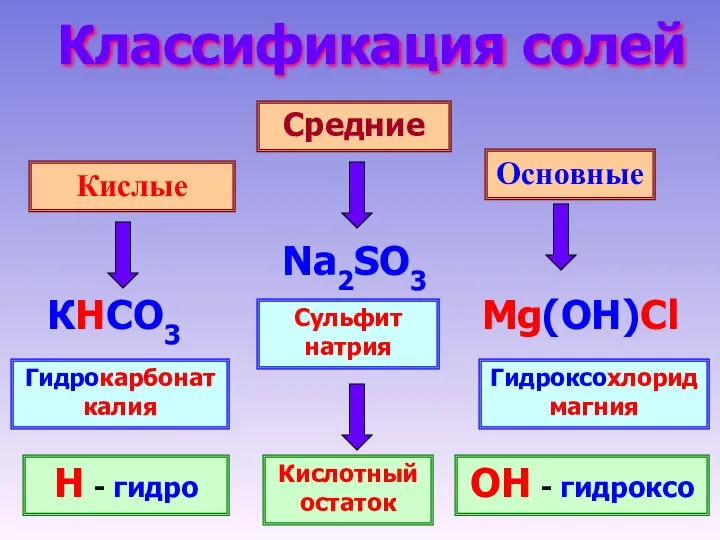
- 3. Классификация солей Кислые Средние Основные Na2SO3 КHCO3 Mg(OH)Cl Сульфит натрия Гидроксохлорид магния Гидрокарбонат калия Н -
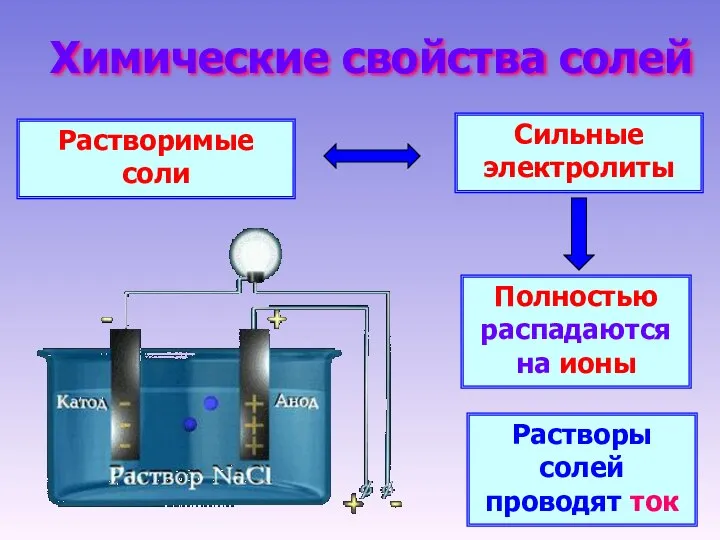
- 5. Химические свойства солей Растворимые соли Сильные электролиты Полностью распадаются на ионы Растворы солей проводят ток
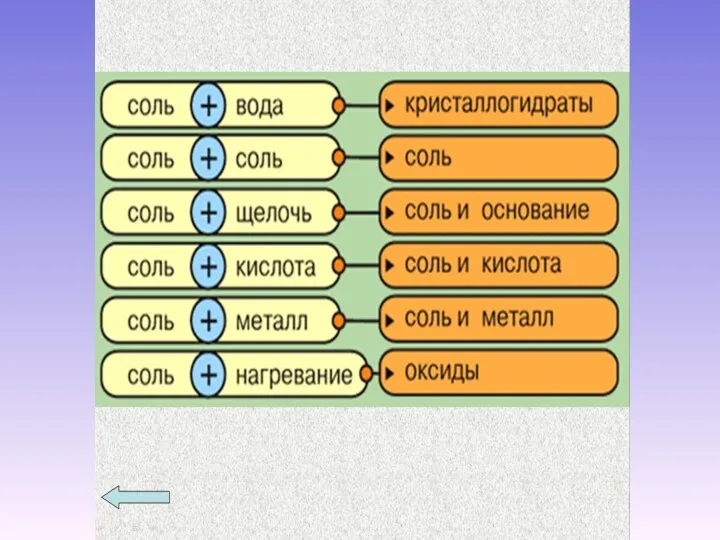
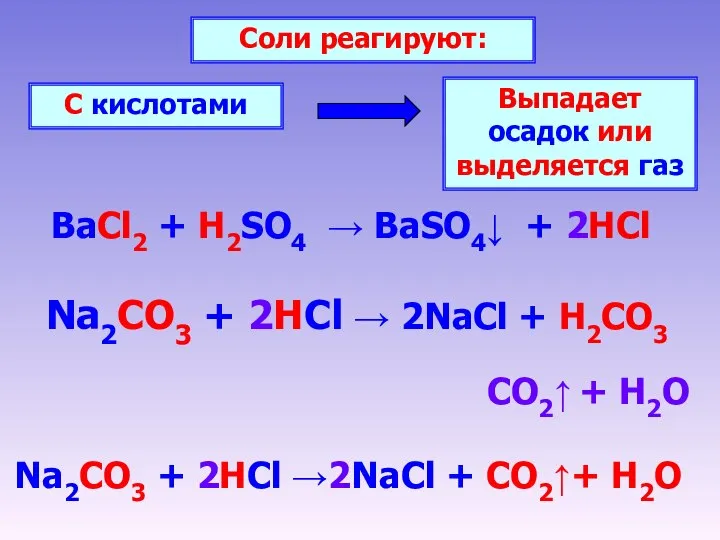
- 6. BaCl2 + H2SO4 → BaSO4↓ + 2HCl Соли реагируют: С кислотами Выпадает осадок или выделяется газ
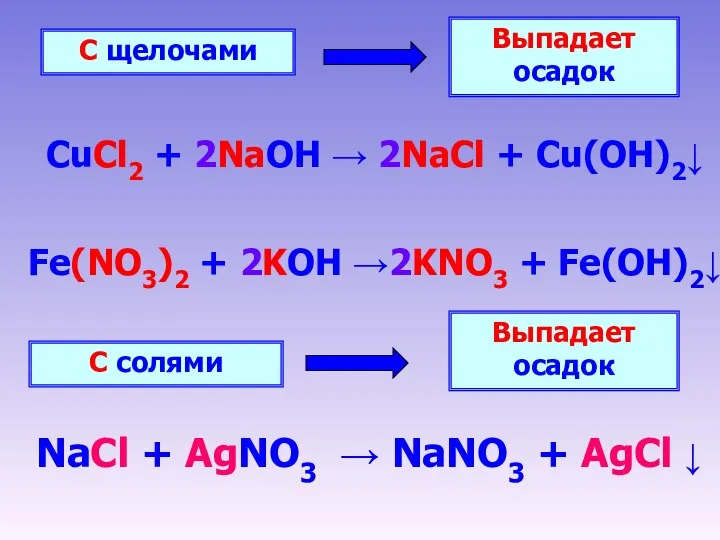
- 7. С щелочами Выпадает осадок CuCl2 + 2NaOH → 2NaCl + Cu(OH)2↓ С солями Выпадает осадок NaCl
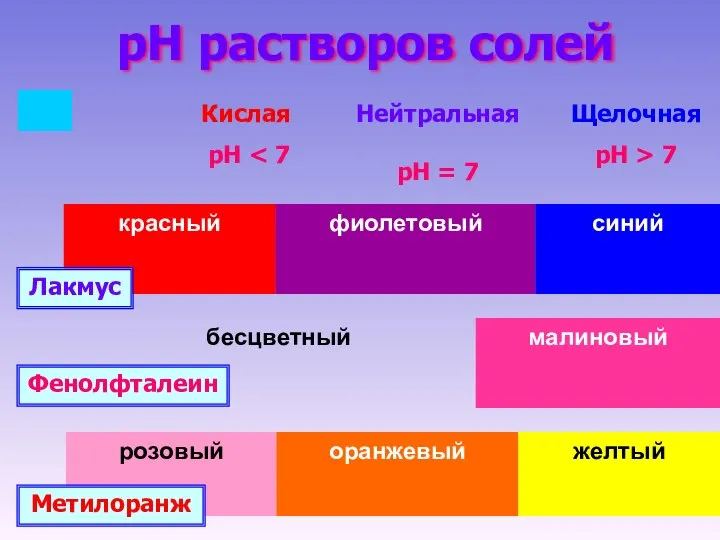
- 8. pH растворов солей Лакмус Фенолфталеин Метилоранж Кислая рН Нейтральная рН = 7 Щелочная рН > 7
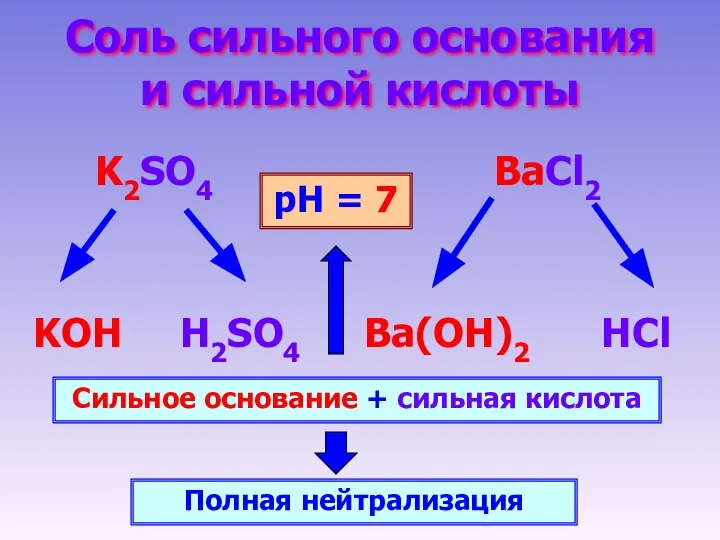
- 9. Соль сильного основания и сильной кислоты K2SO4 BaCl2 KOH H2SO4 HCl Ba(OH)2 Сильное основание + сильная
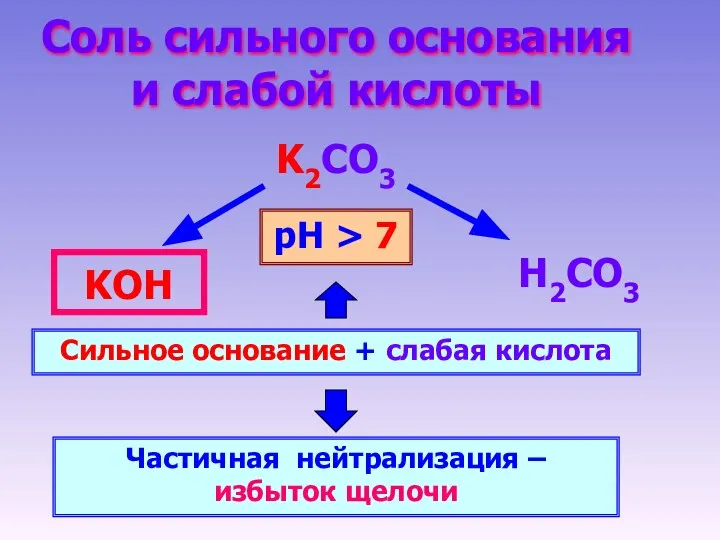
- 11. Соль сильного основания и слабой кислоты K2CO3 Н2CO3 KОН Сильное основание + слабая кислота Частичная нейтрализация
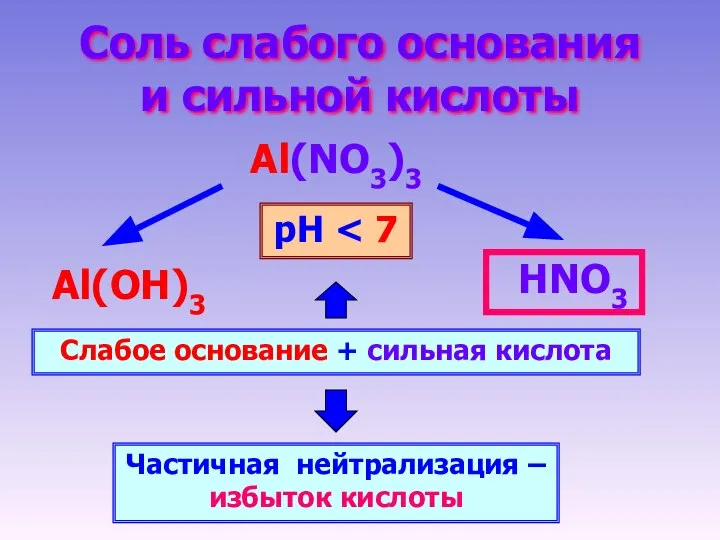
- 12. Соль слабого основания и сильной кислоты Al(NO3)3 НNO3 Al(OН)3 Слабое основание + сильная кислота Частичная нейтрализация
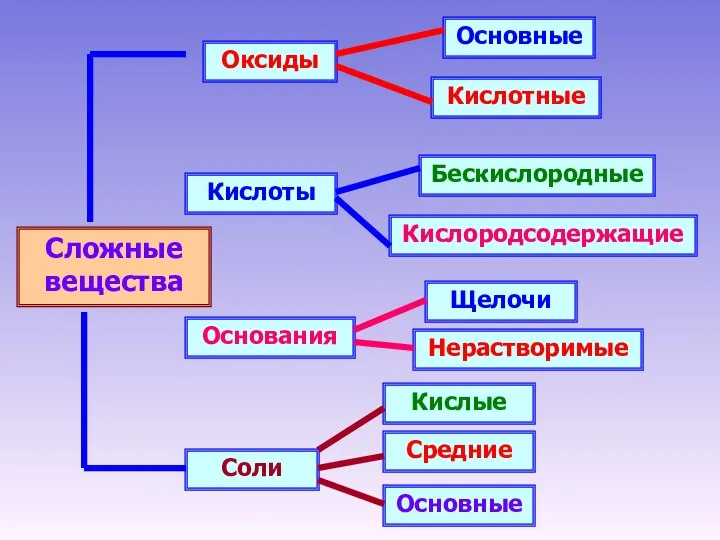
- 13. Сложные вещества Оксиды Кислоты Основания Соли Основные Кислотные Кислородсодержащие Бескислородные Щелочи Нерастворимые Основные Средние Кислые
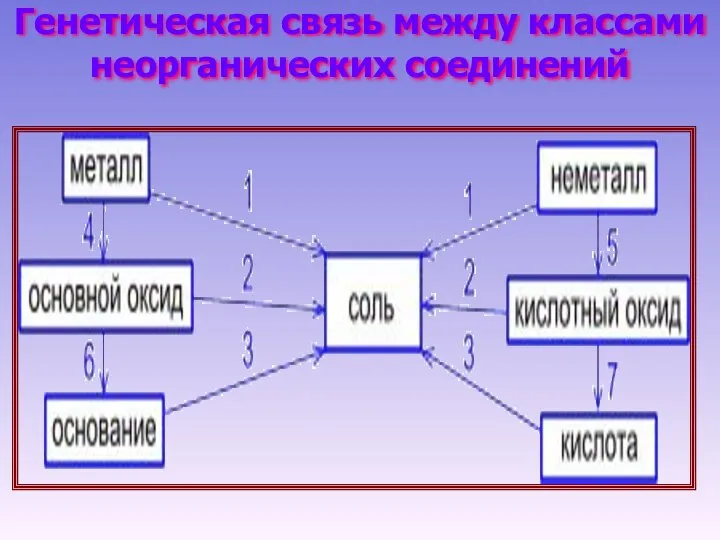
- 16. Генетическая связь между классами неорганических соединений
- 17. Примеры 1. Металл + неметалл → соль Hg + S → HgS 2Al + 3I2 →
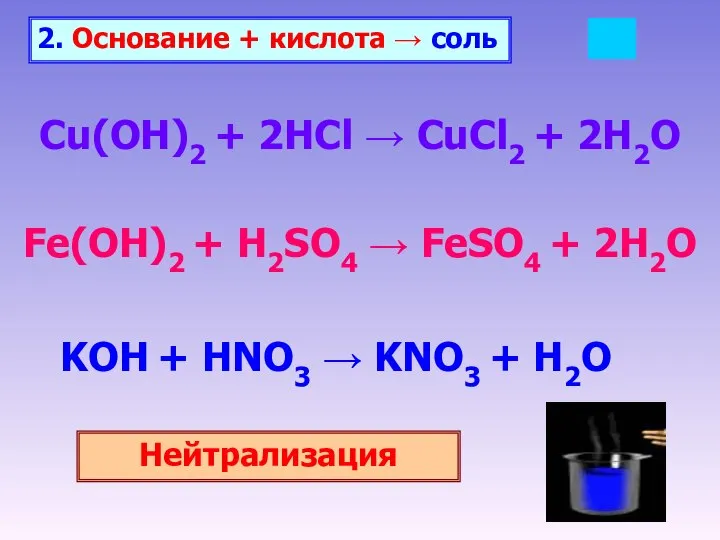
- 18. 2. Основание + кислота → соль Cu(OH)2 + 2HCl → CuCl2 + 2H2O Fe(OH)2 + H2SO4
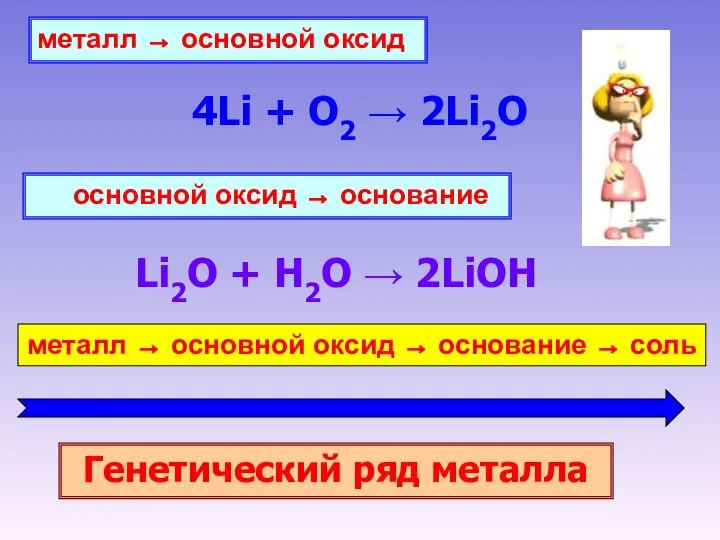
- 19. металл → основной оксид 4Li + O2 → 2Li2O основной оксид → основание Li2O + H2O
- 21. Скачать презентацию




 Аффинаж солей урана. Получение оксидов урана
Аффинаж солей урана. Получение оксидов урана Кристаллография. Точечные группы симметрии, принцип их вывода с помощью понятия о группах. Формы кристаллов низшей категории
Кристаллография. Точечные группы симметрии, принцип их вывода с помощью понятия о группах. Формы кристаллов низшей категории Алкены. Пропилен (пропен)
Алкены. Пропилен (пропен) Хромопротеиды. Патология пигментного обмена. Взаимосвязь обменов
Хромопротеиды. Патология пигментного обмена. Взаимосвязь обменов Теория создание стекла, оптические кристаллы
Теория создание стекла, оптические кристаллы Плазма та її властивості. Практичне застосування плазми. (11 клас)
Плазма та її властивості. Практичне застосування плазми. (11 клас) Мир стекла
Мир стекла Карбоновые кислоты. Строение
Карбоновые кислоты. Строение АВТОР: НАЗАРЕНКО МАКСИМ ВОЛОДИМИРОВИЧ 10-А КЛАС,ГІМНАЗІЯ №32 ПЕЧЕРСЬКИЙ РАЙОН, М. КИЇВ ПЕДАГОГІЧНИЙ КЕРІВНИК: КУЗНЄЦОВА ЛЮДМИ
АВТОР: НАЗАРЕНКО МАКСИМ ВОЛОДИМИРОВИЧ 10-А КЛАС,ГІМНАЗІЯ №32 ПЕЧЕРСЬКИЙ РАЙОН, М. КИЇВ ПЕДАГОГІЧНИЙ КЕРІВНИК: КУЗНЄЦОВА ЛЮДМИ Вещества и их свойства
Вещества и их свойства Презентация по Химии "Привычная и удивительная поваренная соль" - скачать смотреть
Презентация по Химии "Привычная и удивительная поваренная соль" - скачать смотреть  Обменный и донорно-акцепторный механизм образования связи
Обменный и донорно-акцепторный механизм образования связи Элементы 7 группы побочной подгруппы
Элементы 7 группы побочной подгруппы Основные классы неорганических соединений
Основные классы неорганических соединений История одного открытия
История одного открытия  Тема 4- фенолы
Тема 4- фенолы Жиры и масла Выполнила ученица 10 «А» класса Кобылкина Яна
Жиры и масла Выполнила ученица 10 «А» класса Кобылкина Яна  Производство аммиачной селитры под атмосферным давлением
Производство аммиачной селитры под атмосферным давлением Липиды. Классификация липидов
Липиды. Классификация липидов Презентацию составила учитель МОУ «Ягринская гимназия» г.Северодвинска Шапошникова Т.С.
Презентацию составила учитель МОУ «Ягринская гимназия» г.Северодвинска Шапошникова Т.С.  Очистка масляных фракций от смолистых веществ
Очистка масляных фракций от смолистых веществ Окислительно-восстановительные процессы
Окислительно-восстановительные процессы Азотсодержащие органические соединения
Азотсодержащие органические соединения Аминокислоты. Общая формула
Аминокислоты. Общая формула Утилизация отходов
Утилизация отходов Аналитический скрининг
Аналитический скрининг Атомы и молекулы
Атомы и молекулы Покрытие таблеток оболочками
Покрытие таблеток оболочками