Содержание
- 2. Классификация спиртов Спирты классифицируют по различным структурным признакам 1. По числу гидроксильных групп спирты подразделяются на
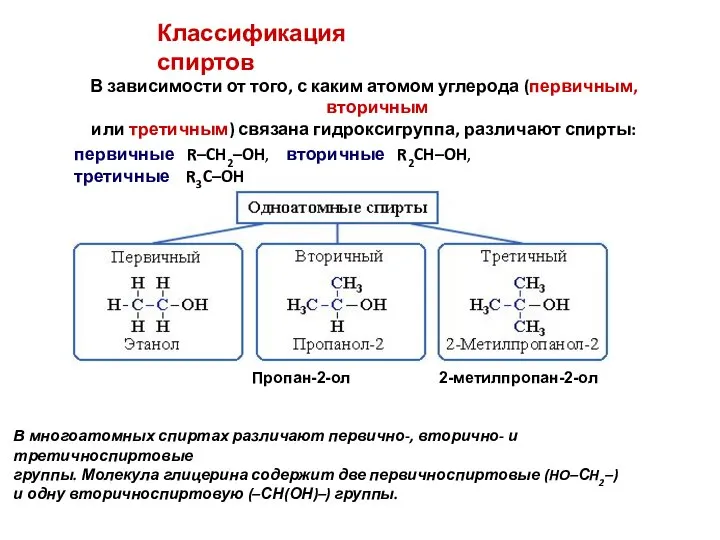
- 3. В зависимости от того, с каким атомом углерода (первичным, вторичным или третичным) связана гидроксигруппа, различают спирты:
- 4. Классификация спиртов По строению радикалов, связанных с атомом кислорода, спирты подразделяются на: предельные, или алканолы R-CH2–OH
- 5. Номенклатура спиртов Систематические названия даются по названию углеводорода с добавлением суффикса -ол и цифры, указывающей положение
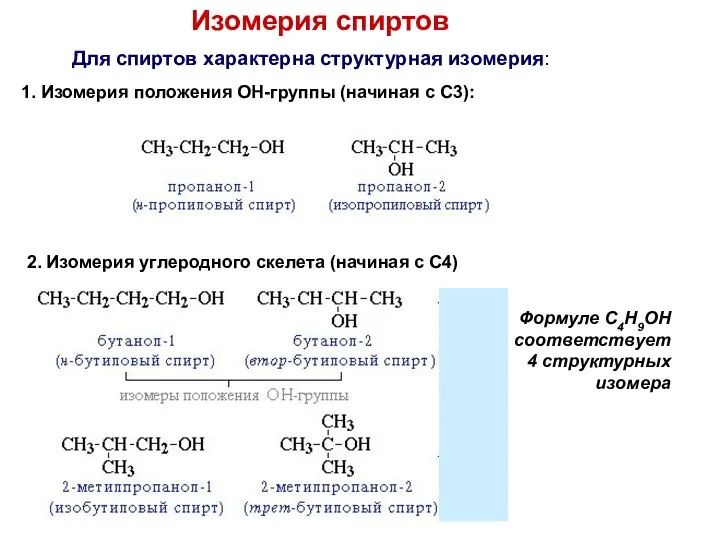
- 6. Изомерия спиртов Для спиртов характерна структурная изомерия: 1. Изомерия положения ОН-группы (начиная с С3): 2. Изомерия
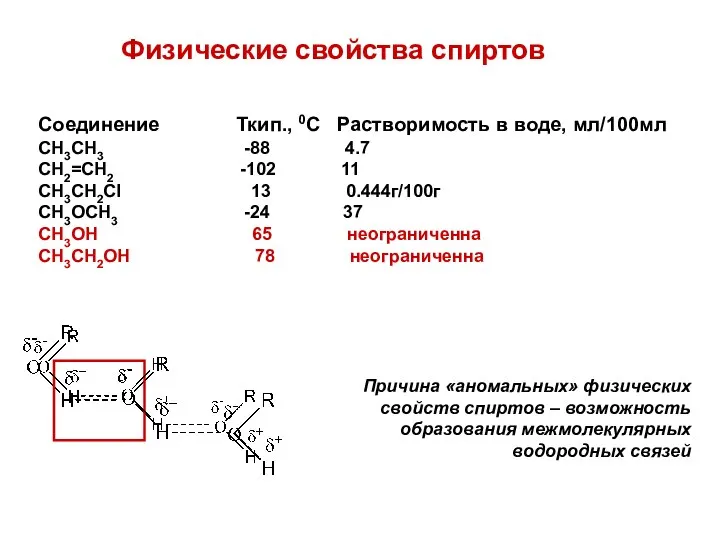
- 7. Физические свойства спиртов Соединение Ткип., 0С Растворимость в воде, мл/100мл CH3CH3 -88 4.7 CH2=CH2 -102 11
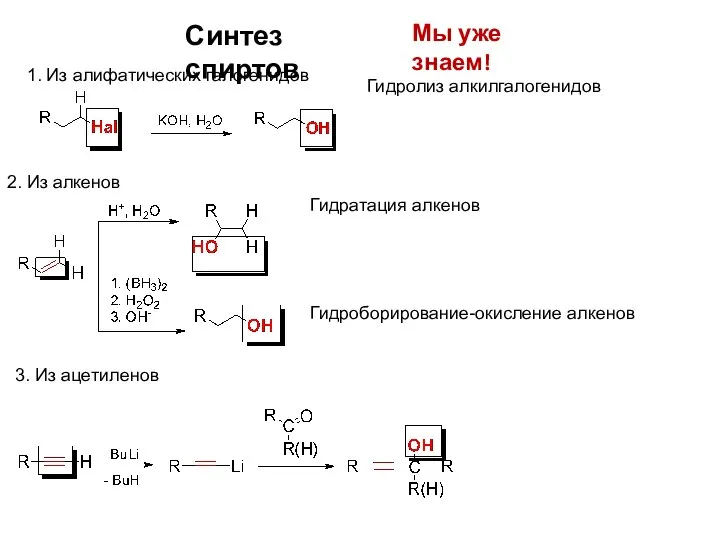
- 8. Синтез спиртов Мы уже знаем! 1. Из алифатических галогенидов 2. Из алкенов Гидратация алкенов Гидролиз алкилгалогенидов
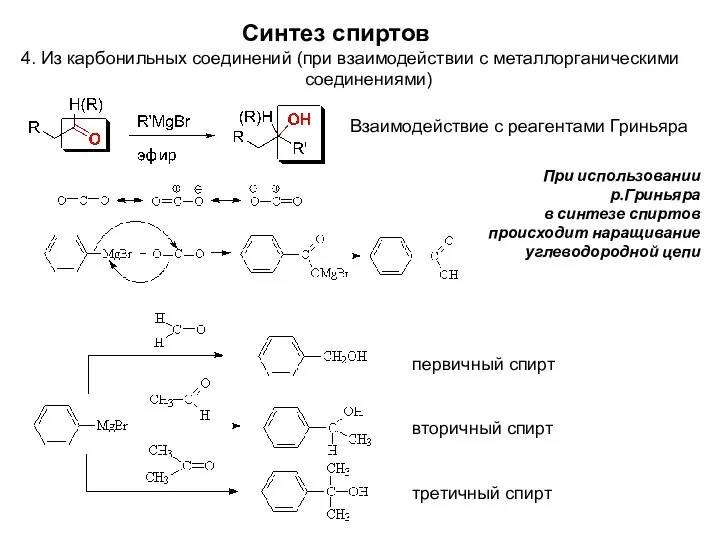
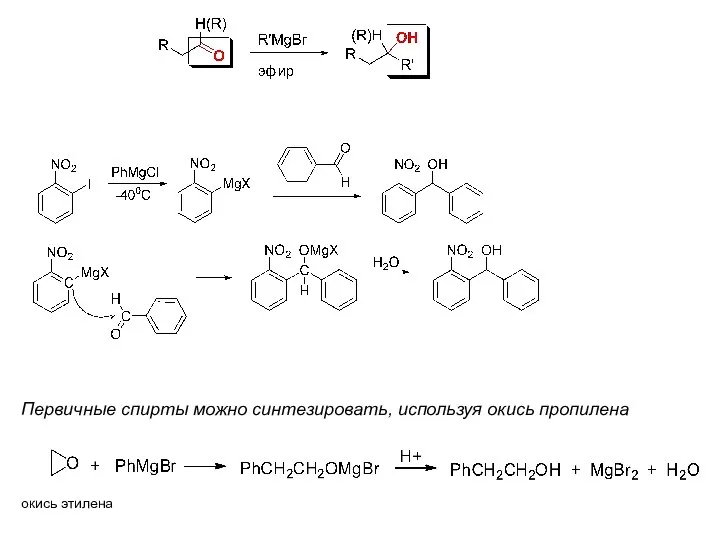
- 9. При использовании р.Гриньяра в синтезе спиртов происходит наращивание углеводородной цепи Синтез спиртов 4. Из карбонильных соединений
- 10. окись этилена Первичные спирты можно синтезировать, используя окись пропилена
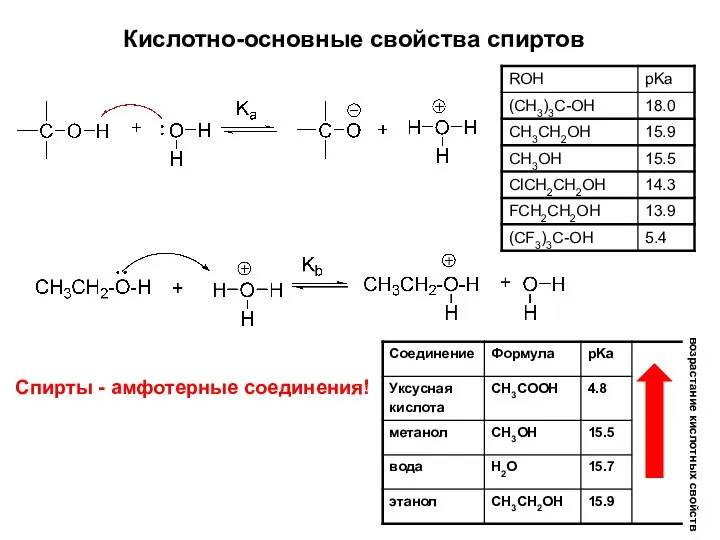
- 11. Кислотно-основные свойства спиртов возрастание кислотных свойств Спирты - амфотерные соединения!
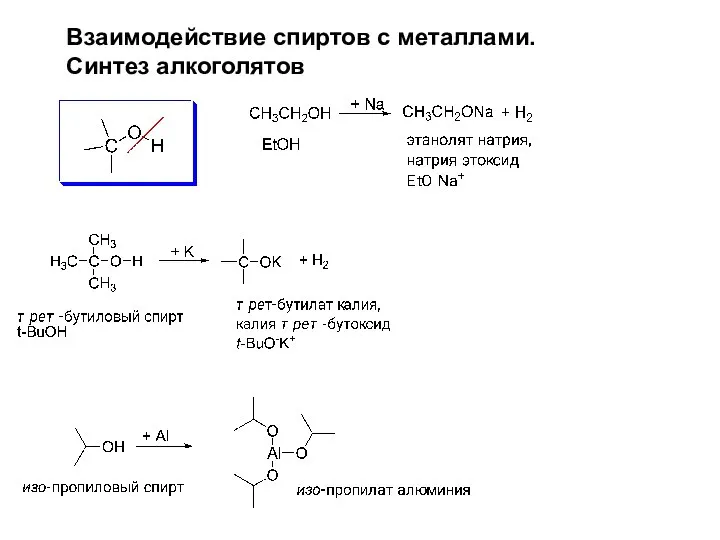
- 12. Взаимодействие спиртов с металлами. Синтез алкоголятов
- 13. Синтез простых эфиров. Реакция Вильямсона
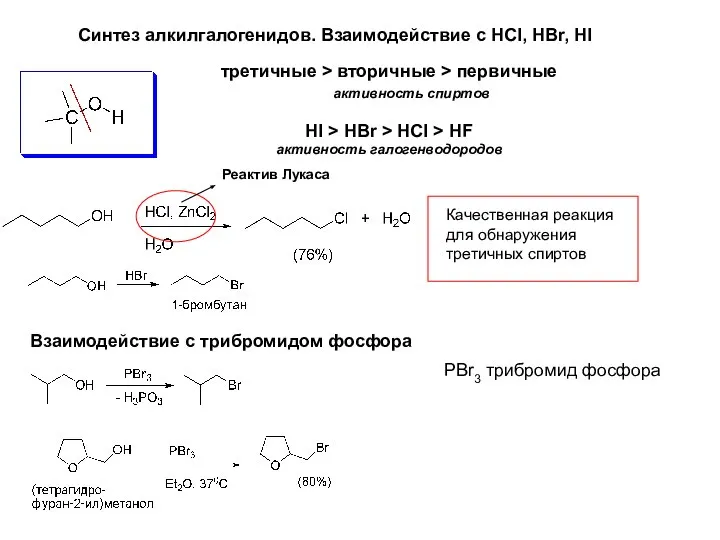
- 14. Синтез алкилгалогенидов. Взаимодействие с HCl, HBr, HI Реактив Лукаса Качественная реакция для обнаружения третичных спиртов третичные
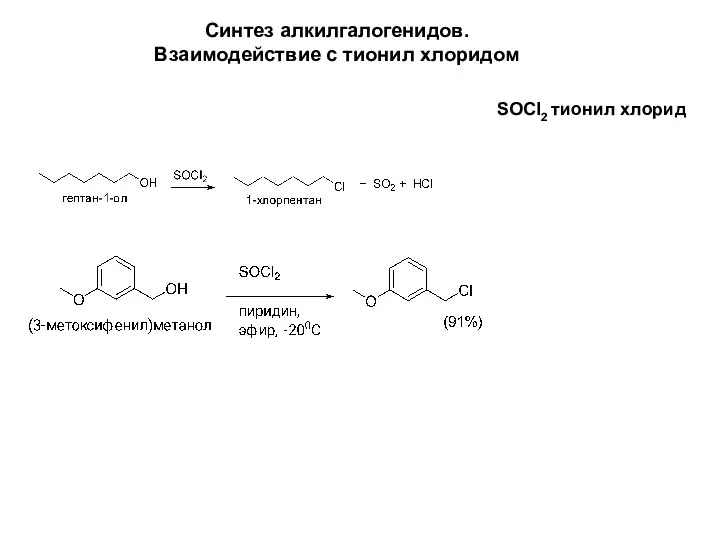
- 15. Синтез алкилгалогенидов. Взаимодействие с тионил хлоридом SOCl2 тионил хлорид
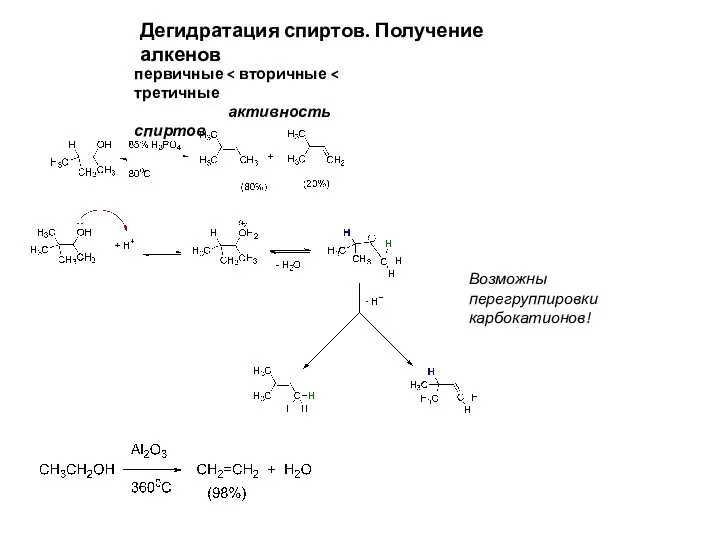
- 16. Дегидратация спиртов. Получение алкенов первичные активность спиртов Возможны перегруппировки карбокатионов!
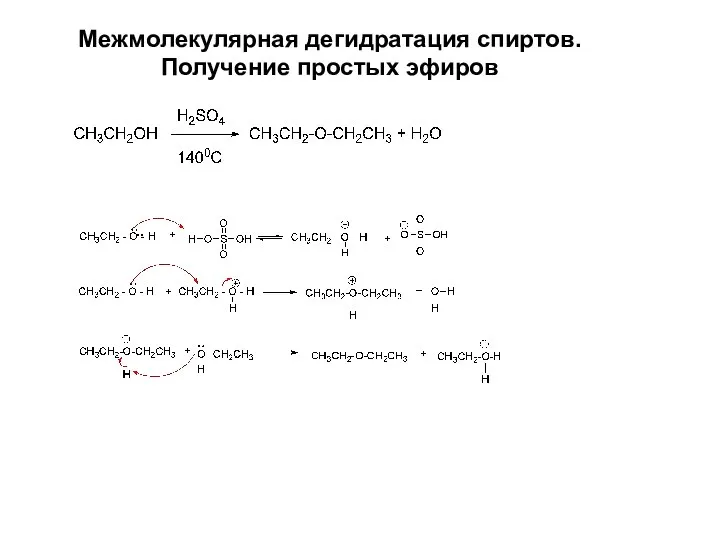
- 17. Межмолекулярная дегидратация спиртов. Получение простых эфиров
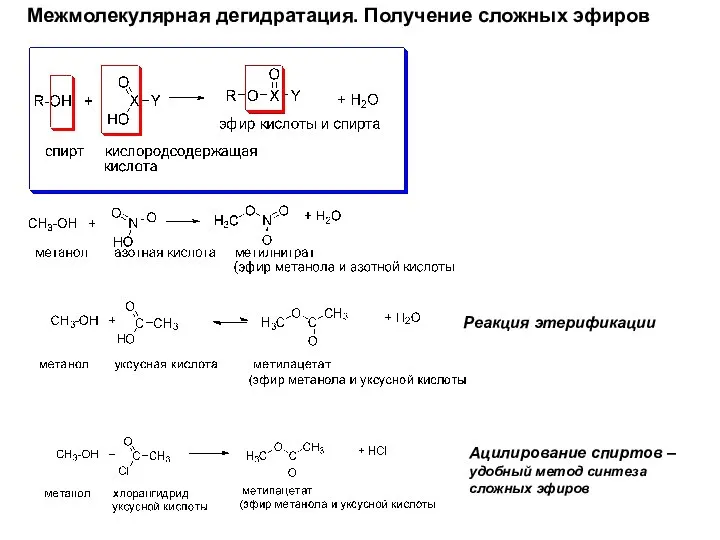
- 18. Межмолекулярная дегидратация. Получение сложных эфиров Реакция этерификации Ацилирование спиртов – удобный метод синтеза сложных эфиров
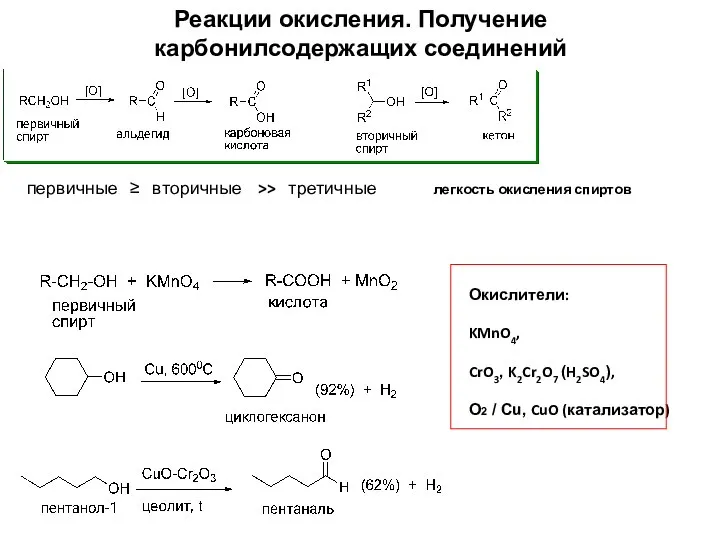
- 19. Реакции окисления. Получение карбонилсодержащих соединений Окислители: KMnO4, CrO3, K2Cr2O7 (H2SO4), О2 / Сu, CuO (катализатор) первичные
- 21. Скачать презентацию




 Строение алканов. Физические и химические свойства алканов. Получение алканов
Строение алканов. Физические и химические свойства алканов. Получение алканов Основания – сложные вещества. (11 класс)
Основания – сложные вещества. (11 класс) Неметаллы 9 класс
Неметаллы 9 класс Индикаторная бумага
Индикаторная бумага Синтез 2,4-диметил-3,5-ди(этоксикарбонил)пиррола
Синтез 2,4-диметил-3,5-ди(этоксикарбонил)пиррола Биосинтез ДНК
Биосинтез ДНК Комплексиметрическое титрование. (Лекция 12)
Комплексиметрическое титрование. (Лекция 12) Лекция 6. Химическая кинетика
Лекция 6. Химическая кинетика Определение качественного состава минеральных вод
Определение качественного состава минеральных вод Аттестационная работа. Программа внеурочной деятельности по химии “Занимательная химия”. (8 класс)
Аттестационная работа. Программа внеурочной деятельности по химии “Занимательная химия”. (8 класс) Тест по химии
Тест по химии «Системно – деятельностный подход как механизм реализации ФГОС нового поколения» обучающий семинар МБОУ «СОШ №15», п.Аршан – 2015г
«Системно – деятельностный подход как механизм реализации ФГОС нового поколения» обучающий семинар МБОУ «СОШ №15», п.Аршан – 2015г Атомы и молекулы. Простые и сложные вещества. 8 класс
Атомы и молекулы. Простые и сложные вещества. 8 класс Химические элементы и организм человека
Химические элементы и организм человека Занятие по познавательному развитию на тему: «Где спрятался воздух?» в средней группе.
Занятие по познавательному развитию на тему: «Где спрятался воздух?» в средней группе.  Регуляция и патология липидного обмена
Регуляция и патология липидного обмена Stereoselective total syntheses of guanacastepenes N and O
Stereoselective total syntheses of guanacastepenes N and O Биохимические аспекты рационального питания
Биохимические аспекты рационального питания Липиды. Химия липидов. Переваривание липидов в ЖКТ. Нарушение переваривания и всасывания
Липиды. Химия липидов. Переваривание липидов в ЖКТ. Нарушение переваривания и всасывания Химия S - элементов
Химия S - элементов Anti-food. Classification of food additives
Anti-food. Classification of food additives Щелочной металл натрий
Щелочной металл натрий Исследование остаточной концентрации моющих средств на посуде
Исследование остаточной концентрации моющих средств на посуде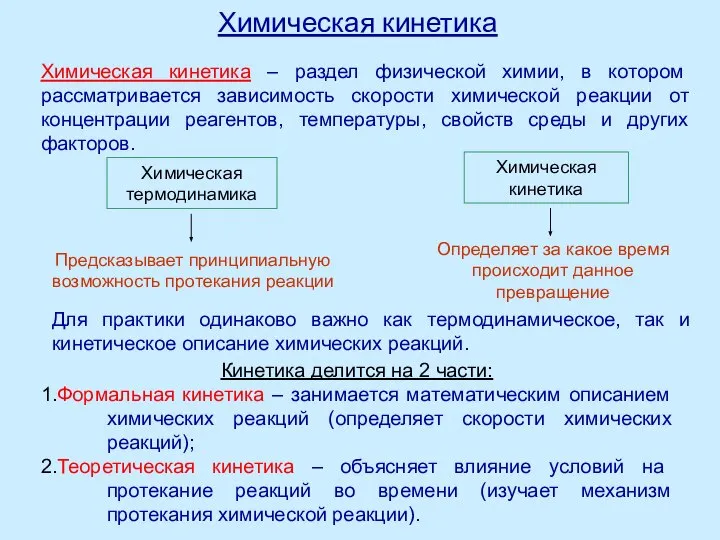 Химическая кинетика
Химическая кинетика Хімічні волокна
Хімічні волокна  Д. И. Менделеев
Д. И. Менделеев Сложные эфиры. Жиры. Мыла. (10 класс)
Сложные эфиры. Жиры. Мыла. (10 класс) Полипропилен. Молекулалық құрылымы
Полипропилен. Молекулалық құрылымы