Содержание
- 2. Цели урока: Ознакомиться с понятием гидролиза солей. Рассмотреть типы гидролиза. Научиться составлять ионные уравнения гидролиза солей.
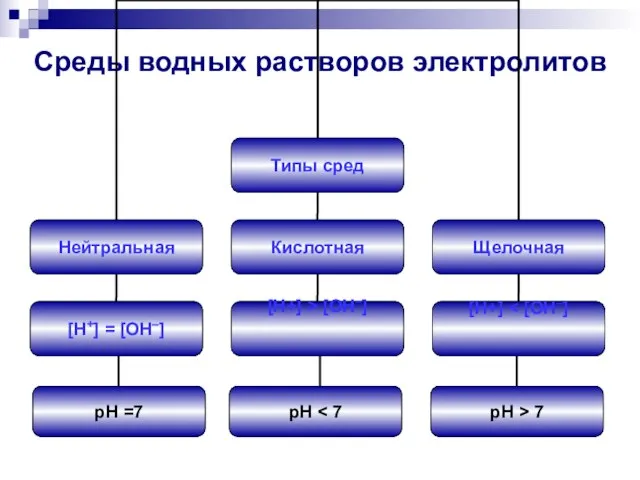
- 4. Среды водных растворов электролитов pH =7 pH pH > 7
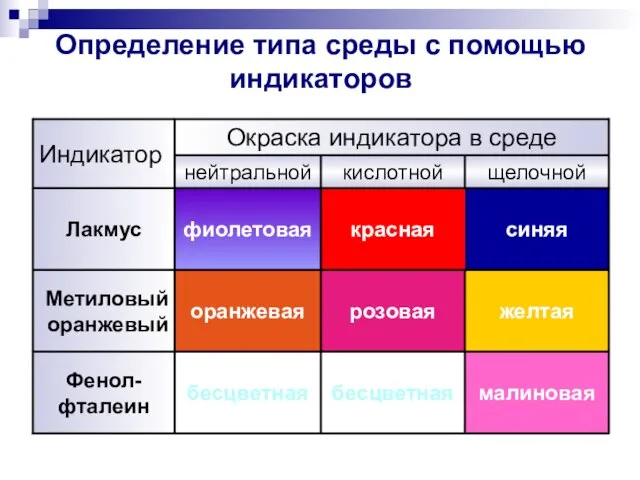
- 5. Определение типа среды с помощью индикаторов синяя красная фиолетовая Лакмус малиновая бесцветная бесцветная Фенол- фталеин желтая
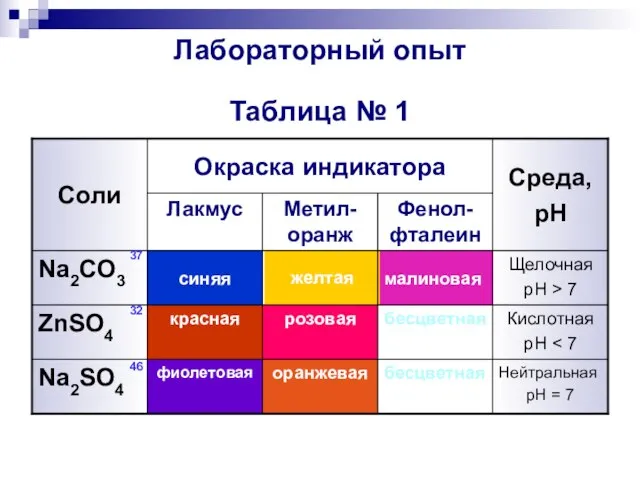
- 6. Лабораторный опыт Таблица № 1 Нейтральная pH = 7 бесцветная оранжевая фиолетовая Na2SO4 Кислотная pH бесцветная
- 7. Что такое гидролиз? Гидролиз (от греческого hydro – вода; lysis – разложение)
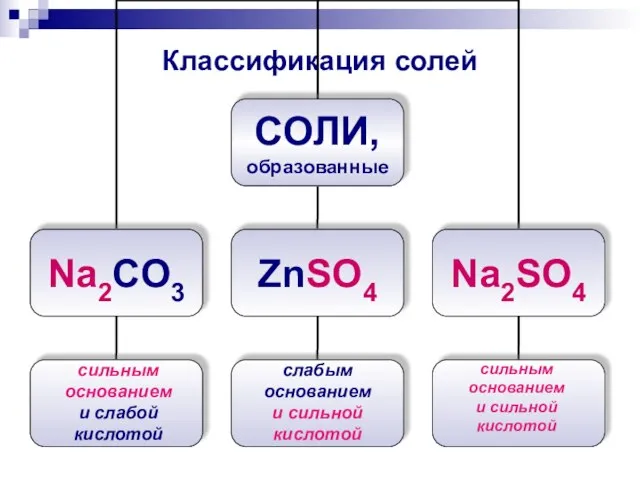
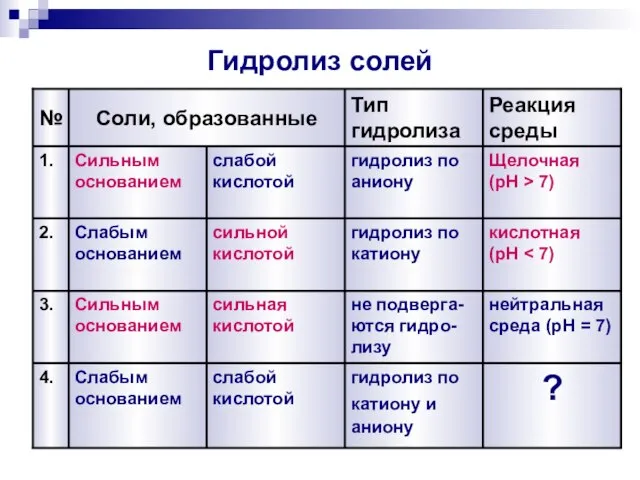
- 8. Классификация солей сильным основанием и слабой кислотой слабым основанием и сильной кислотой сильным основанием и сильной
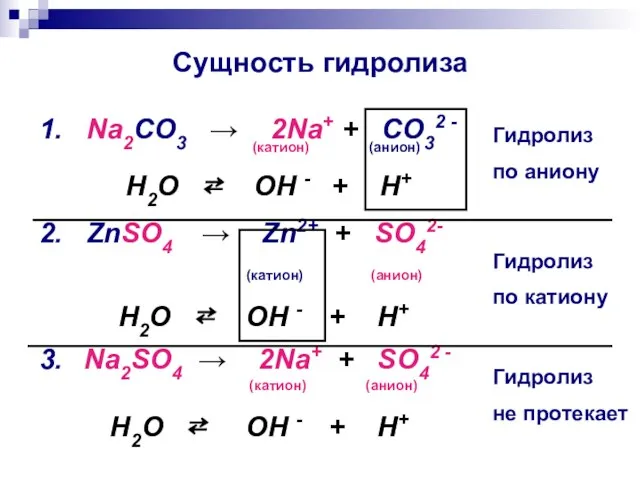
- 9. Сущность гидролиза 1. Na2CO3 → 2Na+ + CO32 - (катион) (анион) H2O ⇄ OH - +
- 10. Определение гидролиза Гидролиз соли – это химическая реакция обмена соли с водой, в результате которой ионы
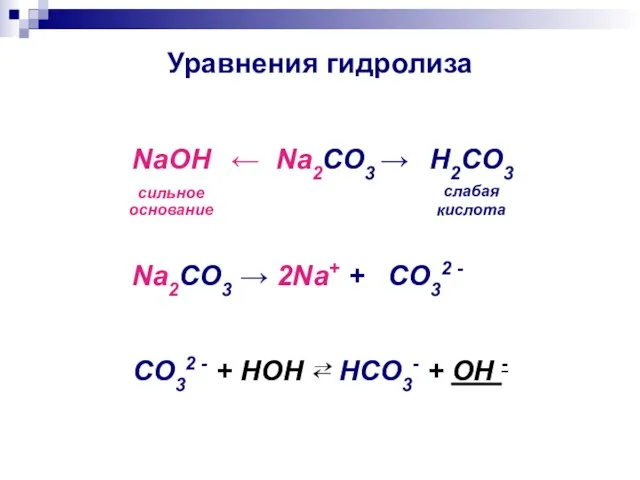
- 11. Уравнения гидролиза ← Na2CO3 → NaOH сильное основание H2CO3 слабая кислота Na2CO3 → 2Na+ + CO32
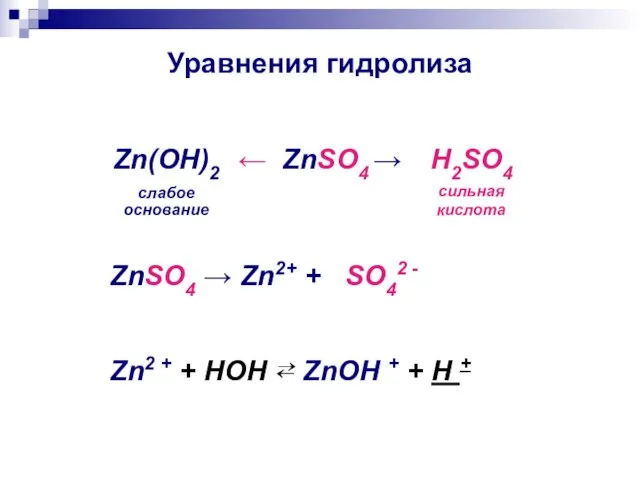
- 12. Уравнения гидролиза ← ZnSO4 → Zn(ОН)2 слабое основание H2SO4 сильная кислота ZnSO4 → Zn2+ + SO42
- 13. Гидролиз солей 3. 2. 1. № Реакция среды, pH Тип гидролиза Соли, образованные нейтральная среда (pH
- 14. Задание. Определите реакцию среды водных растворов солей. Таблица № 2 NaNO3 K2S Na2SiO3 5. NH4NO3 LiNO3
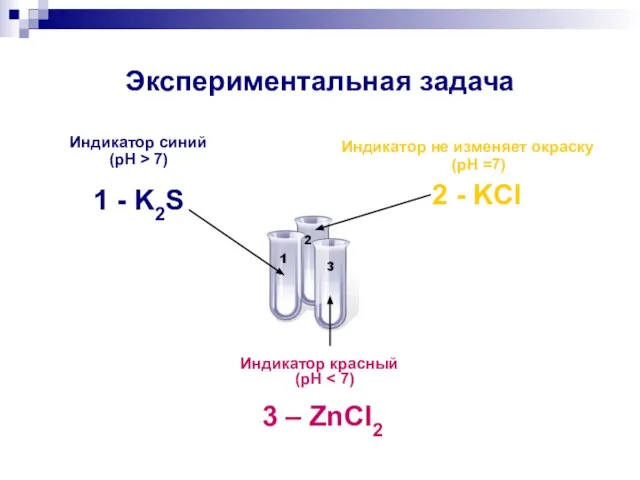
- 15. Экспериментальная задача В трех пронумерованных пробирках даны растворы солей: ZnCl2, K2S, KCl. а) Исследуйте каждый из
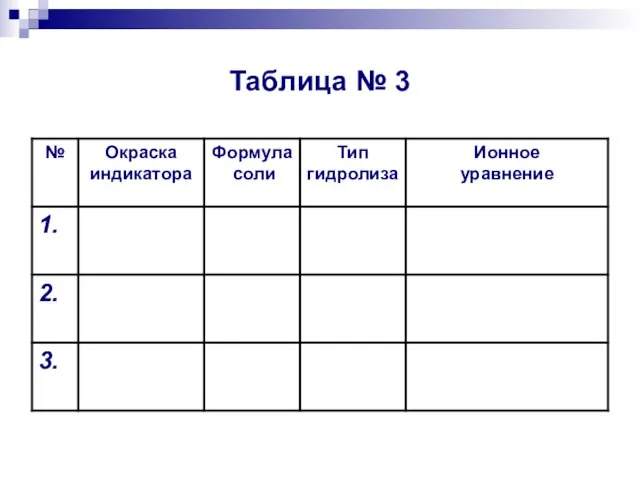
- 16. Таблица № 3
- 17. Экспериментальная задача Индикатор синий (pH > 7) 1 - K2S Индикатор не изменяет окраску (pH =7)
- 18. Гидролиз солей 4. 3. 2. 1. № Реакция среды Тип гидролиза Соли, образованные ? гидролиз по
- 20. Скачать презентацию







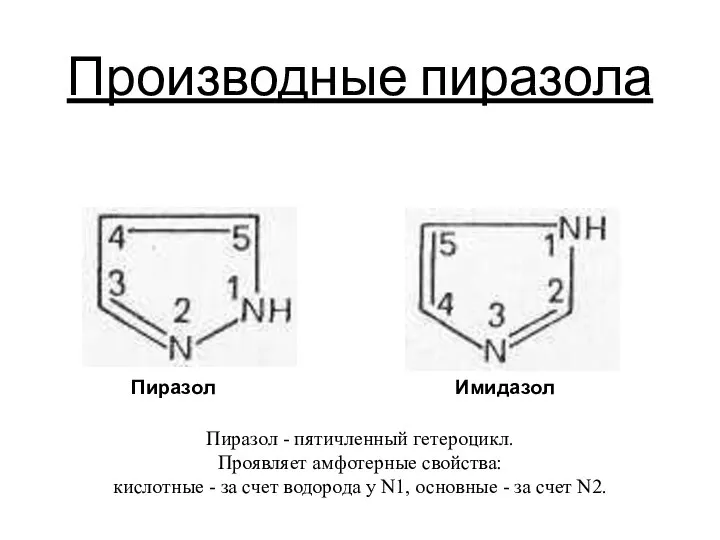 Производные пиразола
Производные пиразола Параметры токсичности продуктов горения материала. (Задача 3)
Параметры токсичности продуктов горения материала. (Задача 3) Ліпіди
Ліпіди Нанодисперсный политетрафторэтилен. Инертные, антифрикционные, противоизносные покрытия
Нанодисперсный политетрафторэтилен. Инертные, антифрикционные, противоизносные покрытия Акцепторы катионов и анионов. Хиральные краунэфиры. Гетерокрауны, гетерокриптанды, циклофаны
Акцепторы катионов и анионов. Хиральные краунэфиры. Гетерокрауны, гетерокриптанды, циклофаны Союз химии и медицины
Союз химии и медицины Химический элемент гелий
Химический элемент гелий Викторина «Что это?»
Викторина «Что это?» Принцип Паули. Периодическая система элементов Д.И. Менделеева
Принцип Паули. Периодическая система элементов Д.И. Менделеева Химические элементы
Химические элементы Альдегиды и кетоны
Альдегиды и кетоны Ароматические углеводороды (арены)
Ароматические углеводороды (арены) № 12.
№ 12.  Люминесценция
Люминесценция Экстракция
Экстракция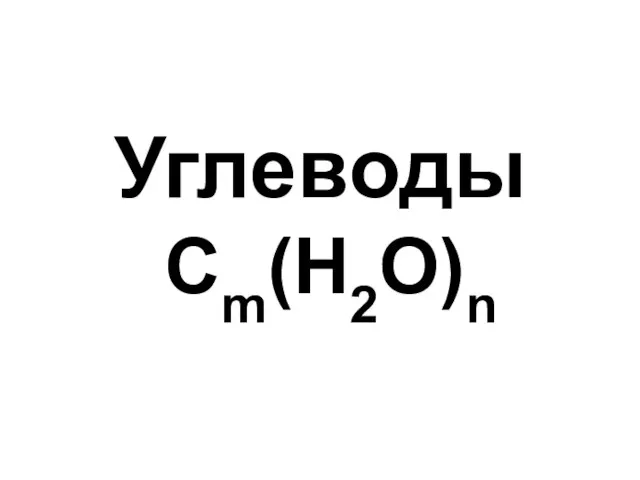 Углеводы. Моносахариды
Углеводы. Моносахариды Пластмассы в автомобилестроении
Пластмассы в автомобилестроении Colloid chemistry
Colloid chemistry Презентация подготовлена учителем химии ош № 33 г. Симферополя Филиной Лесей Игоревной. Каменный уголь.
Презентация подготовлена учителем химии ош № 33 г. Симферополя Филиной Лесей Игоревной. Каменный уголь.  Кристаллические решетки
Кристаллические решетки «Кремний и его соединения» Автор: учитель химии и биологии МБОУ Летуновской СОШ Короткова Фаина Алексеевна
«Кремний и его соединения» Автор: учитель химии и биологии МБОУ Летуновской СОШ Короткова Фаина Алексеевна Азот в природе
Азот в природе Электрохимические методы анализа
Электрохимические методы анализа Введение в кристаллографию
Введение в кристаллографию Магматические и метаморфические горные породы. (Лекция 7)
Магматические и метаморфические горные породы. (Лекция 7) Предмет органической Химии. Классификация Органических соединений
Предмет органической Химии. Классификация Органических соединений Химическая кинетика
Химическая кинетика Решение задач на долю вещества в растворе с участием кристаллогидратов
Решение задач на долю вещества в растворе с участием кристаллогидратов