Содержание
- 2. Статистическая обработка результатов анализа Для стандартизованного представления результата измерения необходимы следующие исходные данные: n – число
- 3. Алгоритм расчета результата измерения включает:
- 6. Методы аналитической химии
- 8. Классификация аналитических методов по целям и решаемым задачам
- 9. Классификация методов по количеству анализируемого вещества
- 10. Диапазон концентраций (содержания) вещества в анализируемой пробе и общепринятый термин, характеризующий количество определяемого компонента, взаимосвязаны: а)
- 11. Классификация химических веществ по содержанию примесей
- 13. Достоинства и недостатки ХМА Основными достоинствами химических методов являются: простота выполнения анализа, отсутствие сложного аппаратурного оформления
- 14. Достоинства и недостатки ИМА ИМА обладают рядом преимуществ, это: высокая экспрессность; хорошая чувствительность; объективность результатов анализа;
- 15. КОЛИЧЕСТВЕННЫЙ ХИМИЧЕСКИЙ АНАЛИЗ Химические методы анализа основаны на протекании химической реакции: Х + R → Р,
- 16. Основные термины и определения Количество – величина, пропорциональная числу элементарных объектов. Единицей количества вещества является моль.
- 17. Масса единицы количества вещества (1 моля) называется молярной массой обозначается через М(X), обычно имеет размерность -
- 18. В основе проведения всех количественных расчетов лежит принцип (закон) эквивалентности или эквивалентных соотношений, в соответствии с
- 19. Обозначение химического эквивалента для некоторого вещества Х записывают в виде , называют фактором эквивалентности (число, показывающее,
- 20. Закон эквивалентов или эквивалентных соотношений можно выразить в виде математического уравнения: Молярная масса эквивалента связана с
- 21. В реакциях кислотно-основного взаимодействия фактор эквивалентности рассчитывают исходя из количества протонов (z), участвующих в реакции с
- 22. Концентрация показывает, какое количество вещества находится в единице объема (в г/мл, мг/м3, моль/л, ммоль/л и др.),
- 23. Способы выражения концентраций 1. Молярная концентрация С(X) показывает количество растворенного вещества (моль) в единице объема раствора
- 25. Скачать презентацию






















 Сложные эфиры
Сложные эфиры Фазовое равновесие в насыщенном растворе малорастворимого электролита. (Глава 4. Задача 10)
Фазовое равновесие в насыщенном растворе малорастворимого электролита. (Глава 4. Задача 10) фізичні властивості полімеру спиртів та карбонових кислот
фізичні властивості полімеру спиртів та карбонових кислот  Химические индикаторы
Химические индикаторы Обмен липидов
Обмен липидов Технология производства простых полиэфиров
Технология производства простых полиэфиров Презентация по Химии "Форфор" - скачать смотреть
Презентация по Химии "Форфор" - скачать смотреть  Вода ценный дар природы. Биологическая роль воды
Вода ценный дар природы. Биологическая роль воды Геохимия урана и тория в карбонатитовом процессе
Геохимия урана и тория в карбонатитовом процессе Физическая и коллоидная химия
Физическая и коллоидная химия Физические явления в химии (8 класс)
Физические явления в химии (8 класс) Қабаттағы мұнай
Қабаттағы мұнай Як прості речовини
Як прості речовини  Цинк. Знаходження в періодичній системі і основні характеристики
Цинк. Знаходження в періодичній системі і основні характеристики Адам мен жануар организміне бордың әсері
Адам мен жануар организміне бордың әсері Высокомолекулярные вещества полимеры
Высокомолекулярные вещества полимеры Окислительно-восстановительные процессы. Лекция 8
Окислительно-восстановительные процессы. Лекция 8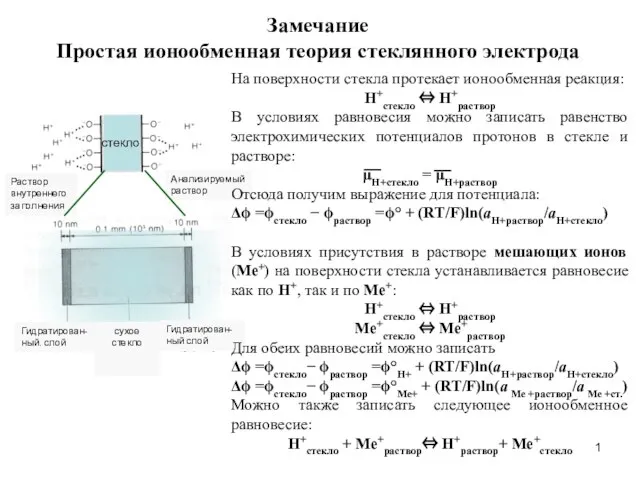 Простая ионообменная теория стеклянного электрода
Простая ионообменная теория стеклянного электрода Биологический метод исследования. Определение патогенности и вирулентности микроорганизмов
Биологический метод исследования. Определение патогенности и вирулентности микроорганизмов Работа выполнена обучающейся 9 «А» класса МОУ «СОШ №2» Мусафировой Анастасией
Работа выполнена обучающейся 9 «А» класса МОУ «СОШ №2» Мусафировой Анастасией Химия, 8. Урок 1
Химия, 8. Урок 1 Биопластики: область применения
Биопластики: область применения Производные карбоновых кислот. Ненасыщенные карбоновые кислоты
Производные карбоновых кислот. Ненасыщенные карбоновые кислоты Caustic Soda
Caustic Soda Презентация по Химии "Неметаллы" - скачать смотреть
Презентация по Химии "Неметаллы" - скачать смотреть  Презентация по Химии "Биополимеры" - скачать смотреть
Презентация по Химии "Биополимеры" - скачать смотреть  Химия в пищевой промышленности
Химия в пищевой промышленности Интересные факты о нефти
Интересные факты о нефти