Содержание
- 2. Понятие "атом" пришло к нам из далекой античности ( в переводе с греческого "атом" означает "
- 3. I. Доказательства сложности строения атома. 1891г. - ирландский физик Стони ввёл понятие "электрон" для обозначения частиц,
- 4. II. Модели строения атома. - - - - - - - - - - - +
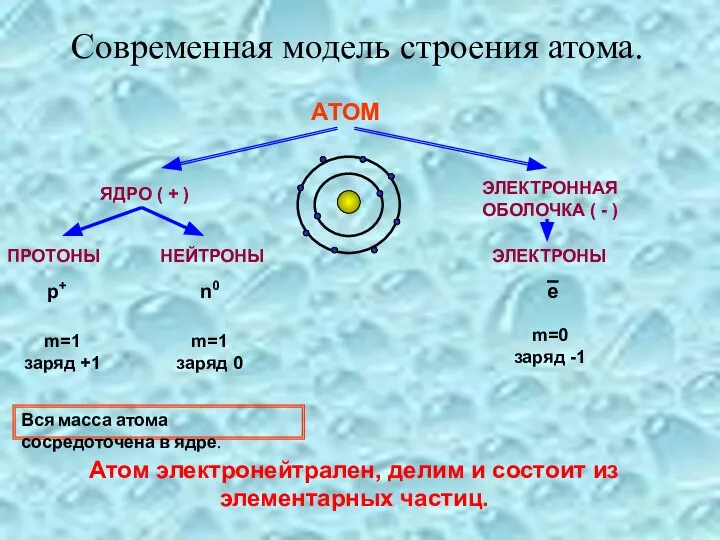
- 5. Современная модель строения атома. АТОМ ЯДРО ( + ) ЭЛЕКТРОННАЯ ОБОЛОЧКА ( - ) ПРОТОНЫ НЕЙТРОНЫ
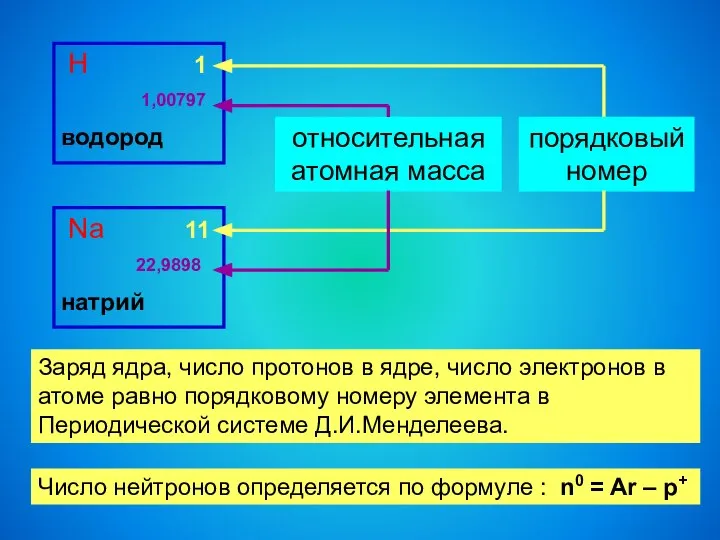
- 6. Н 1 1,00797 водород Na 11 22,9898 натрий порядковый номер относительная атомная масса Заряд ядра, число
- 7. H p+ 1 ē 1 n0 0 Na p+ 11 ē 11 n0 12 Определите число
- 8. ? Что произойдет, если изменить число протонов в ядре, т.е. заряд атомного ядра ? Ответ :
- 9. Строение электронных оболочек атомов. Каждый электрон в атоме обладает запасом энергии ( Е связи). Электроны, имеющие
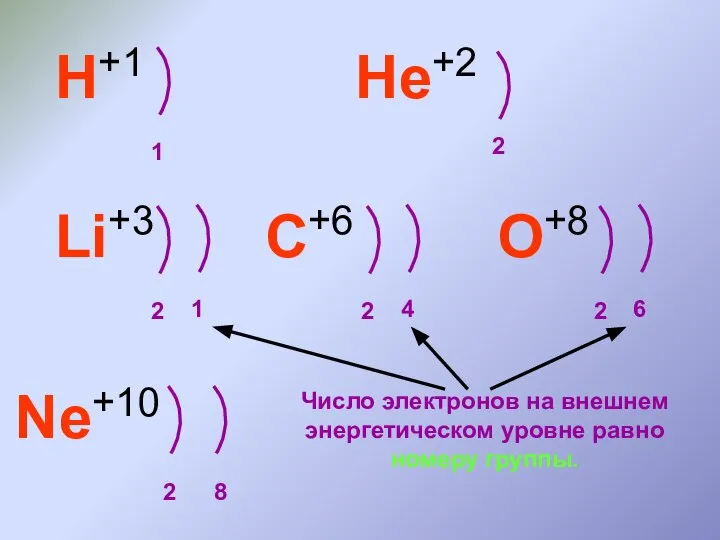
- 10. H+1 1 He+2 2 Li+3 2 1 C+6 2 4 O+8 2 6 Ne+10 8 2
- 11. H+1 1 He+2 2 Li+3 2 1 C+6 2 4 O+8 2 6 Ne+10 8 2
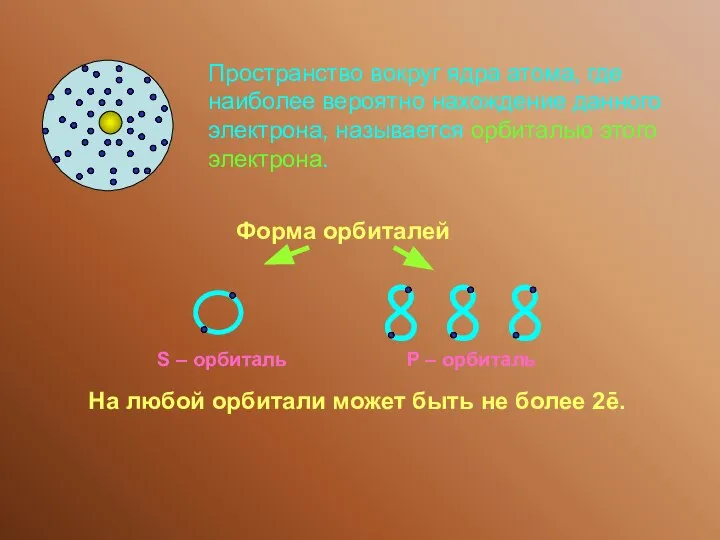
- 12. ∞ Пространство вокруг ядра атома, где наиболее вероятно нахождение данного электрона, называется орбиталью этого электрона. Форма
- 13. Электронные формулы. H+1 1 1S1 № эн. уровня форма орбитали число ē на данной орбитали He+2
- 14. Напишите распределение электронов по энергетическим уровням и электронные формулы для следующих атомов. Mg+12 2 8 2
- 16. Скачать презентацию









 Olbaltumvielas
Olbaltumvielas Биохимия крови. Биохимия печени
Биохимия крови. Биохимия печени Презентация по Химии "Щелочные металлы" - скачать смотреть _
Презентация по Химии "Щелочные металлы" - скачать смотреть _ Углеводороды. Алкены
Углеводороды. Алкены Коагуляция в дисперсных системах
Коагуляция в дисперсных системах Штучні і синтетичні волокна
Штучні і синтетичні волокна  Простой борный суперфосфат
Простой борный суперфосфат Buffer solutions
Buffer solutions Полимеры. Протезы трахеи
Полимеры. Протезы трахеи Количество вещества. Молярная масса
Количество вещества. Молярная масса Полезные продукты на основе 4-хлоризотиазолов
Полезные продукты на основе 4-хлоризотиазолов Новые вещества и материалы Презентация по химии Ученицы 11 класса Закатаевой Тани_
Новые вещества и материалы Презентация по химии Ученицы 11 класса Закатаевой Тани_ Микробты липидтерді алу
Микробты липидтерді алу Ионные уравнения
Ионные уравнения Производство серной кислоты H2SO4 « Едва найдется другое, искусственно добываемое вещество, столь часто применяемое в технике, как серная кислота…» (Д. И. Менделеев)
Производство серной кислоты H2SO4 « Едва найдется другое, искусственно добываемое вещество, столь часто применяемое в технике, как серная кислота…» (Д. И. Менделеев) Промышленное получение аммиака
Промышленное получение аммиака Менделєєв Дмитро Іванович Роботу виконав: Учень 11 - Б класу Вдовіченко І. Вчитель інформатики: Трибко О.Б.
Менделєєв Дмитро Іванович Роботу виконав: Учень 11 - Б класу Вдовіченко І. Вчитель інформатики: Трибко О.Б.  Материаловедение. Деформация и разрушение материалов. (Тема 4)
Материаловедение. Деформация и разрушение материалов. (Тема 4) Презентация по химии Химия в криминалистике
Презентация по химии Химия в криминалистике  Типы химических реакций в неорганической и органической химии
Типы химических реакций в неорганической и органической химии Признаки химических реакций. (Практическая работа 5,4)
Признаки химических реакций. (Практическая работа 5,4) Токсичность. Параметры токсичности
Токсичность. Параметры токсичности Молекулярно-кинетические свойства дисперсных систем. Лекция 09
Молекулярно-кинетические свойства дисперсных систем. Лекция 09 “Физикалық химия” курсы бойынша жеке бағдарланған индивидуалды зерттеу жұмысы
“Физикалық химия” курсы бойынша жеке бағдарланған индивидуалды зерттеу жұмысы Основные классы органических соединений: циклические соединения
Основные классы органических соединений: циклические соединения Граниты. Происхождение гранитов
Граниты. Происхождение гранитов Азот. Нахождение азота в природе
Азот. Нахождение азота в природе Химический состав растений
Химический состав растений