Содержание
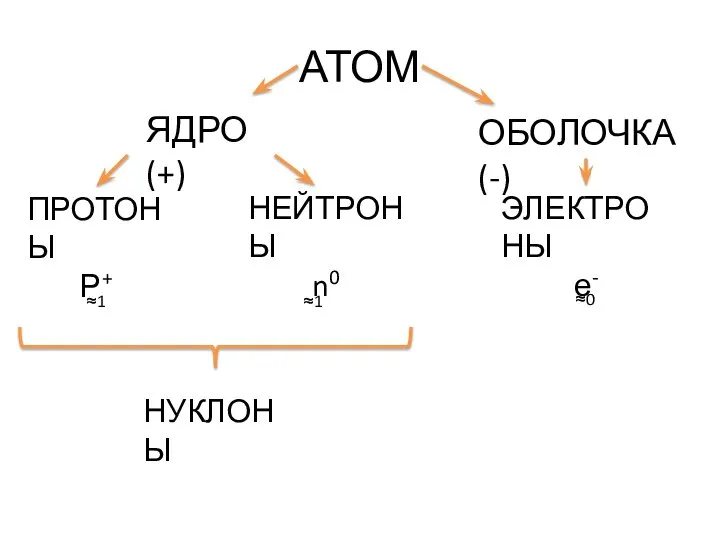
- 2. АТОМ ЯДРО (+) ОБОЛОЧКА (-) ПРОТОНЫ Р+ НЕЙТРОНЫ n0 ЭЛЕКТРОНЫ е- ≈1 ≈1 ≈0 НУКЛОНЫ
- 3. Число нуклонов в ядре атома равно массовому числу А: А = N(p+) + N(n0) Число протонов
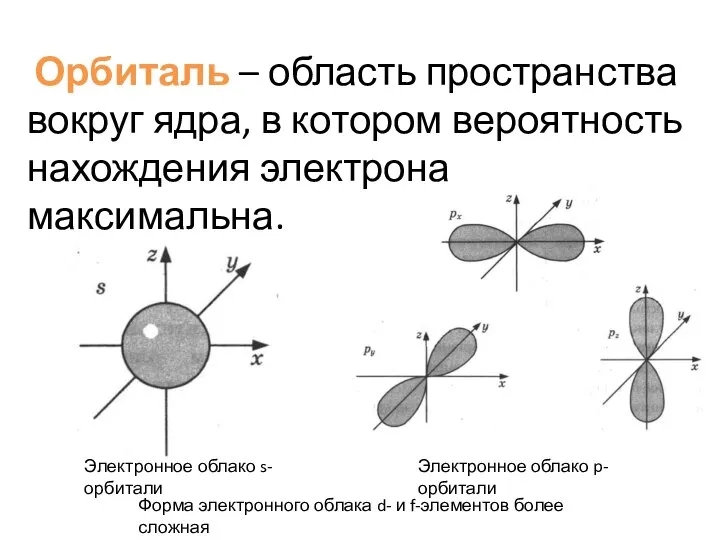
- 4. Электронное облако s-орбитали Электронное облако p-орбитали Орбиталь – область пространства вокруг ядра, в котором вероятность нахождения
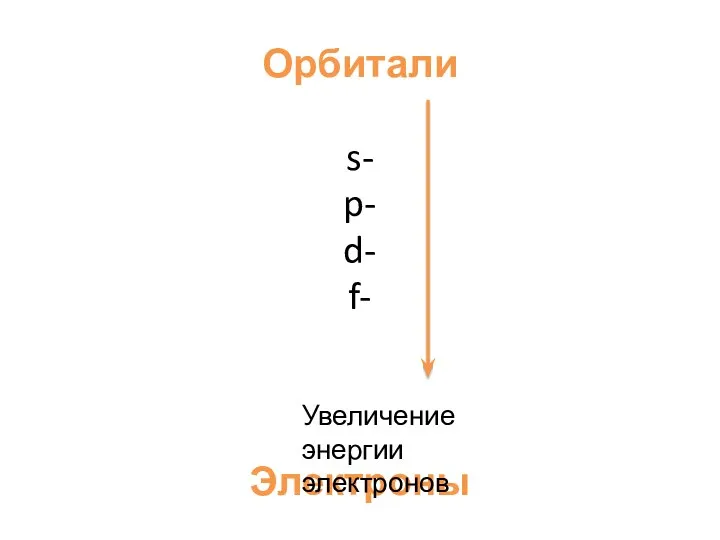
- 5. Орбитали s- p- d- f- Электроны s- p- d- f- Увеличение энергии электронов
- 6. Электроны в атоме обладают разным запасом энергии и поэтому распределяются по различным энергетическим уровням и подуровням
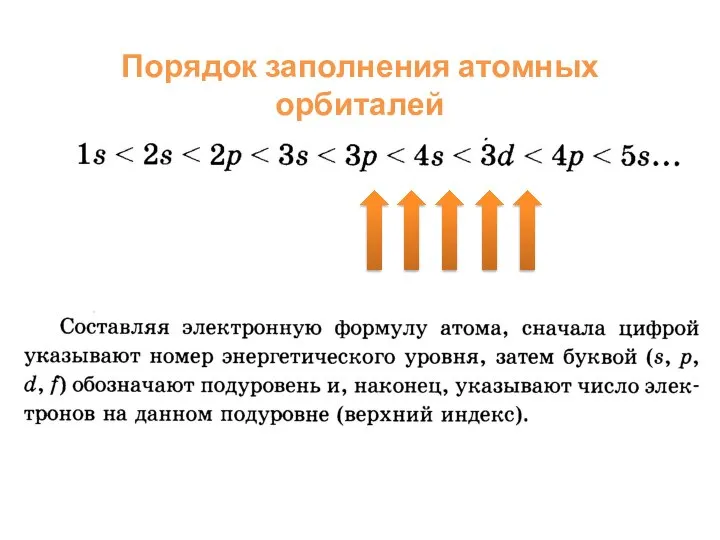
- 7. Электронная конфигурация показывает распределение электронов в атоме по энергетическим уровням (1 ур., 2 ур.), подуровням (2s,
- 8. Порядок заполнения атомных орбиталей
- 17. Скачать презентацию









 Урок в 7 класі КЗ Верхівцевського НВК Учитель Кукса Наталія Миколаївна
Урок в 7 класі КЗ Верхівцевського НВК Учитель Кукса Наталія Миколаївна  Производство чугуна. (9 и 11 класс)
Производство чугуна. (9 и 11 класс) Положение в периодической таблице
Положение в периодической таблице Мониторинги по химии
Мониторинги по химии Изохинолин туындыларының дәрілік заттарын талдау
Изохинолин туындыларының дәрілік заттарын талдау Минералы
Минералы Презентация Характеристика щелочных металлов 9 класс
Презентация Характеристика щелочных металлов 9 класс  Характеризовать химический элемент по положению в периодической системе. Групповые задания
Характеризовать химический элемент по положению в периодической системе. Групповые задания Конструкционные и функциональные материалы: конструкционные материалы. Введение
Конструкционные и функциональные материалы: конструкционные материалы. Введение Производство бензола
Производство бензола Презентация по Химии "Вода – важнейшая составляющая жизни на Земле" - скачать смотреть
Презентация по Химии "Вода – важнейшая составляющая жизни на Земле" - скачать смотреть  “Су. Ерітінділер” тарауын қорытындылау
“Су. Ерітінділер” тарауын қорытындылау Концепция метанольной экономики
Концепция метанольной экономики Жидкостная хроматография
Жидкостная хроматография Введение в биохимию
Введение в биохимию “ КОРОЗІЯ МЕТАЛІВ. ЗАХИСТ ВІД КОРОЗІЇ ” Підготував: Учень 10-А класу ЗОШ №25 м. Луцька Матвійчук Роман
“ КОРОЗІЯ МЕТАЛІВ. ЗАХИСТ ВІД КОРОЗІЇ ” Підготував: Учень 10-А класу ЗОШ №25 м. Луцька Матвійчук Роман  Предмет электрохимии
Предмет электрохимии Презентация по Химии "Презентация Металлы в организме человека" - скачать смотреть
Презентация по Химии "Презентация Металлы в организме человека" - скачать смотреть  Оксиды углерода Волкова Наталья Мироновна учитель химии МОУ СОШ № 138 с углубленным изучением отдельных предметов Октябрьског
Оксиды углерода Волкова Наталья Мироновна учитель химии МОУ СОШ № 138 с углубленным изучением отдельных предметов Октябрьског Тема урока: Решение генетических цепочек
Тема урока: Решение генетических цепочек  p-элементы 17 группы периодической системы: галогены
p-элементы 17 группы периодической системы: галогены Кам’яне вугілля, продукти його переробки
Кам’яне вугілля, продукти його переробки Тест по теме: Алкины
Тест по теме: Алкины Поверхностно-активные вещества (ПАВ). Классификация, свойства и условия применения
Поверхностно-активные вещества (ПАВ). Классификация, свойства и условия применения Електронна природа хімічного зв'язку. Поняття про електронегативність
Електронна природа хімічного зв'язку. Поняття про електронегативність Синтез и исследование метилольных и хлорметильных производных аллантоина
Синтез и исследование метилольных и хлорметильных производных аллантоина Коррозия железа
Коррозия железа Анализ ассортимента и экспертиза качества одноразовой посуды из полимерных и комбинированных материалов
Анализ ассортимента и экспертиза качества одноразовой посуды из полимерных и комбинированных материалов