Содержание
- 2. Физические свойства Агрегатное состояние: С1- С11- жидкости С12 - С…- твердые вещества Запах С1 - С3
- 3. Водородная связь - связь между атомами водорода одной молекулы и атомами сильно электроотрицательных элементов (кислорода, азота,
- 4. Влияние водородной связи на физические свойства соединений [ УВ и УВНаl] Одноатомные спирты Многоатомные спирты
- 5. Химические свойства спиртов I. Реакции замещения Реакции, идущие с участием атома водорода гидроксильной группы
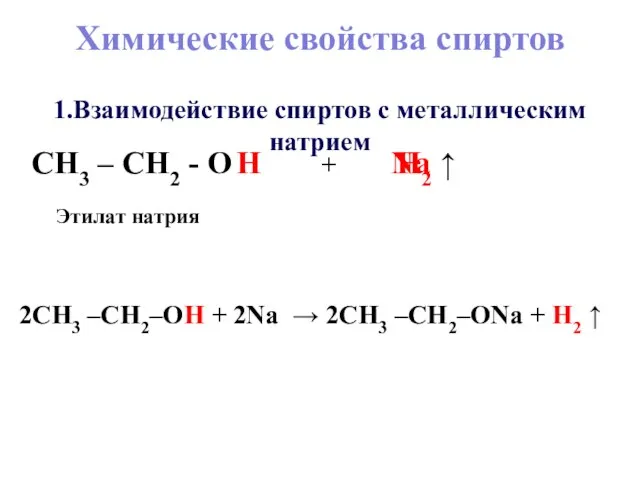
- 6. CH3 – CH2 - O H Na H2 ↑ 1.Взаимодействие спиртов с металлическим натрием Этилат натрия
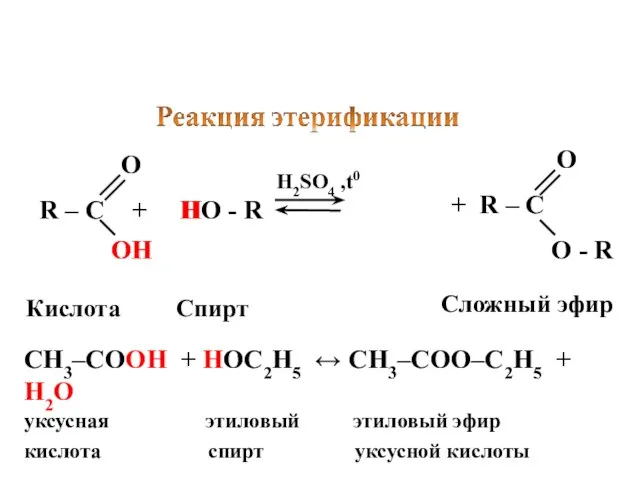
- 7. R – C + HO - R H2SO4 ,t0 O ОH OH H Кислота Спирт Сложный
- 8. Реакции, идущие с участием гидроксильной группы 3.Взаимодействие с галогеноводородами C2H5OH+HBr →C2H5Br +HOH
- 9. Назовите продукты реакций. II. Реакции отщепления Дегидрирование(стр.146) Составьте уравнения реакций, заменив радикал R на СН3. 2.
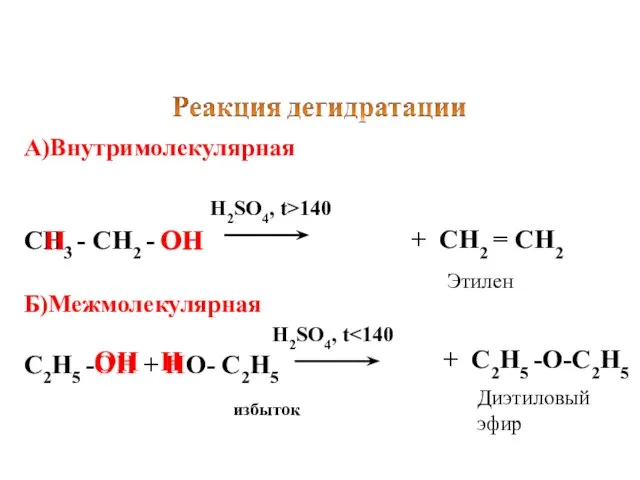
- 10. А)Внутримолекулярная H2SO4, t>140 СН3 - СН2 - ОН ОН Б)Межмолекулярная H2SO4, t С2Н5 -ОН + НО-
- 11. Горение спирта 1.Горение С2Н5ОН + 3О2 → 2СО2 + 3Н2О +1374 кДЖ III.Реакции окисления
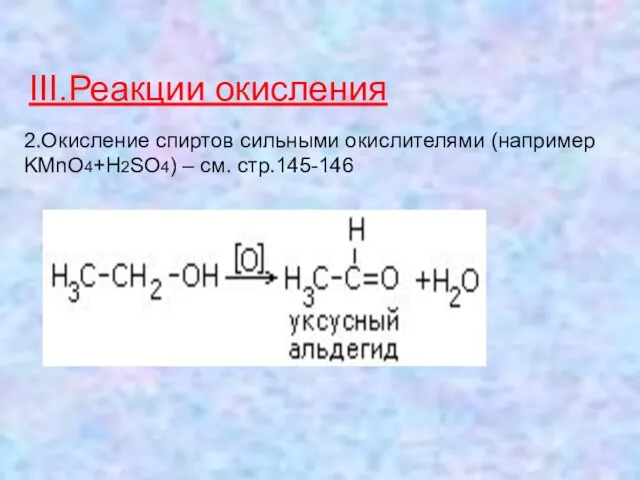
- 12. III.Реакции окисления 2.Окисление спиртов сильными окислителями (например KMnO4+H2SO4) – см. стр.145-146
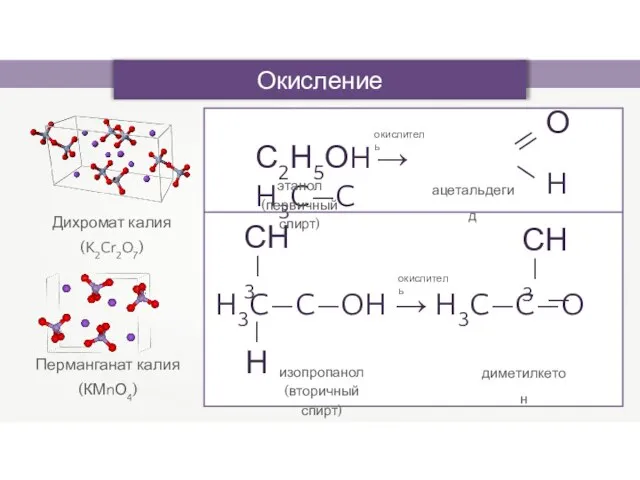
- 13. Окисление спиртов Дихромат калия (K2Cr2O7) Перманганат калия (КМnО4) С2Н5ОH → H3C—C — — H О —
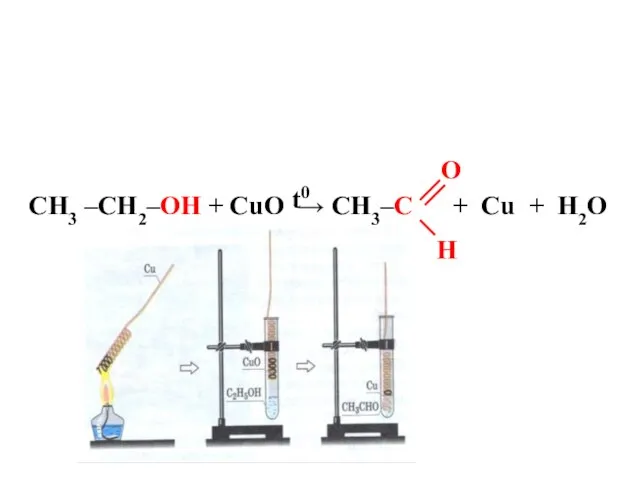
- 14. 3. Окисление оксидом меди(II) – качественная реакция на метиловый и этиловый спирты. t t CH3 –
- 15. CH3 –CH2–OH + CuO → CH3–C + Cu + H2O t0 O H
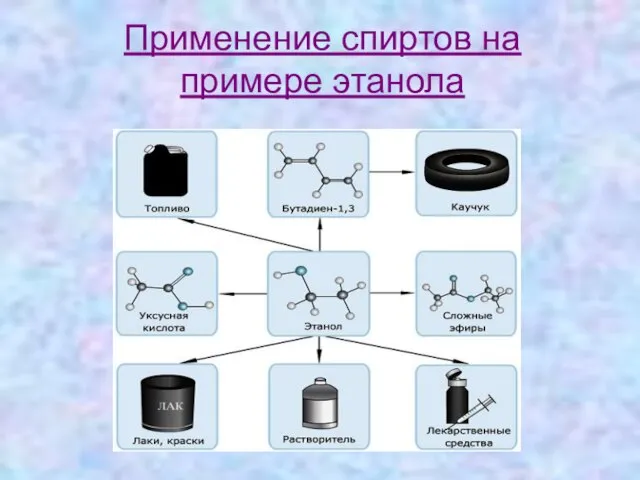
- 16. Применение спиртов на примере этанола
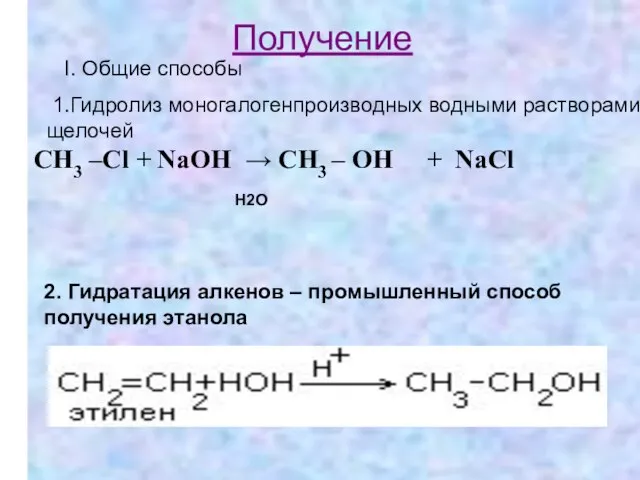
- 17. CH3 –Сl + NaOH → CH3 – OH + NaCl Н2О Получение I. Общие способы 1.Гидролиз
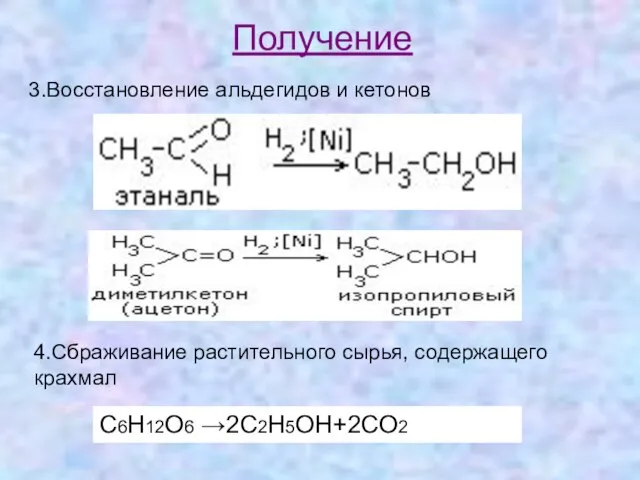
- 18. Получение 3.Восстановление альдегидов и кетонов 4.Сбраживание растительного сырья, содержащего крахмал С6H12O6 →2C2H5OH+2CO2
- 19. см. уравнение стр.149. 2. Сбраживание растительного сырья, содержащего крахмал и целлюлозу. Крахмал + Н2О → глюкоза
- 21. Скачать презентацию


![Влияние водородной связи на физические свойства соединений [ УВ и УВНаl] Одноатомные спирты Многоатомные спирты](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/505363/slide-3.jpg)






 Оксиди
Оксиди Задача №2 «Спящий Амур». Команда гимназии №1 «Берлинская лазурь»
Задача №2 «Спящий Амур». Команда гимназии №1 «Берлинская лазурь» Алканы. Предельные углеводороды. Парафины. Насыщенные углеводороды
Алканы. Предельные углеводороды. Парафины. Насыщенные углеводороды Симметрия кристаллов, текстур и элементы кристаллофизики
Симметрия кристаллов, текстур и элементы кристаллофизики Кинетика сложных реакций
Кинетика сложных реакций Механизмы органических реакций
Механизмы органических реакций Простые вещества неметаллы
Простые вещества неметаллы Химия вокруг нас
Химия вокруг нас Фармацевтические эмульсии
Фармацевтические эмульсии Қазіргі кезде қолданылатын дезинсектицидтер
Қазіргі кезде қолданылатын дезинсектицидтер Полимеры
Полимеры Материаловедение и технология обработки материалов
Материаловедение и технология обработки материалов Выращивание кристаллов в домашних условиях
Выращивание кристаллов в домашних условиях Органическая химия: «Жиры» Орлова Ольга Николаевна Школа №357 Приморского р-на.
Органическая химия: «Жиры» Орлова Ольга Николаевна Школа №357 Приморского р-на.  Цветные реакции белков Качественные реакции на остатки аминокислот
Цветные реакции белков Качественные реакции на остатки аминокислот  Сера. Свойства серы
Сера. Свойства серы Синтез реакционноспособных олигомеров и полимеров на их основе. Лекция 1
Синтез реакционноспособных олигомеров и полимеров на их основе. Лекция 1 Вычисление массы растворённого вещества, содержащегося в определённой массе раствора с известной массовой долей
Вычисление массы растворённого вещества, содержащегося в определённой массе раствора с известной массовой долей Презентация по Химии "кпк" - скачать смотреть бесплатно
Презентация по Химии "кпк" - скачать смотреть бесплатно Открытия в области химии во время Великой Отечественной войны
Открытия в области химии во время Великой Отечественной войны Необходимые навыки для составления уравнений ОВР
Необходимые навыки для составления уравнений ОВР Периодический закон, периодическая система. Формулировка периодического закона Д.И. Менделеева
Периодический закон, периодическая система. Формулировка периодического закона Д.И. Менделеева Пестициды (ядохимикаты)
Пестициды (ядохимикаты) Химическое оборудование в быту. Урок №3
Химическое оборудование в быту. Урок №3 6-членные гетероциклы с одним гетероатомом
6-членные гетероциклы с одним гетероатомом Карбоновые кислоты
Карбоновые кислоты Арены. Природные источники углеводородов
Арены. Природные источники углеводородов Синтез сополимеров с заданным порядком присоединения звеньев в цепи методом интербиполиконденсации
Синтез сополимеров с заданным порядком присоединения звеньев в цепи методом интербиполиконденсации