Содержание
- 2. Все вещества по отношению к элект- рическому току можно разделить на : их растворы или расплавы
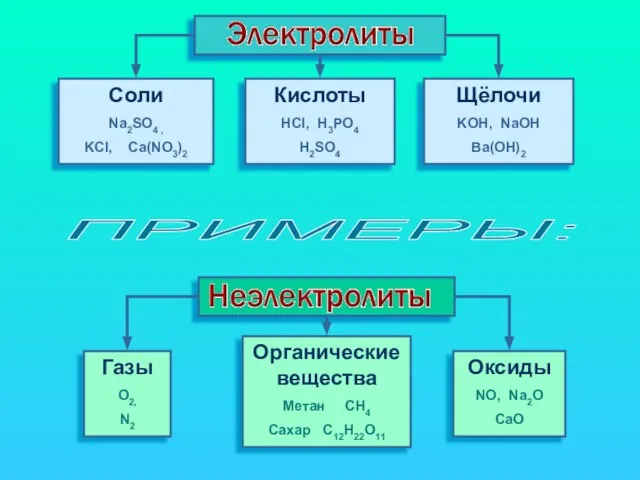
- 3. Cоли Na2SO4 , KCl, Ca(NO3)2 Кислоты HCl, H3PO4 H2SO4 Щёлочи KOH, NaOH Ba(OH)2 Газы O2, N2
- 4. Классы неоргани-ческих веществ с точки зрения ТЭД
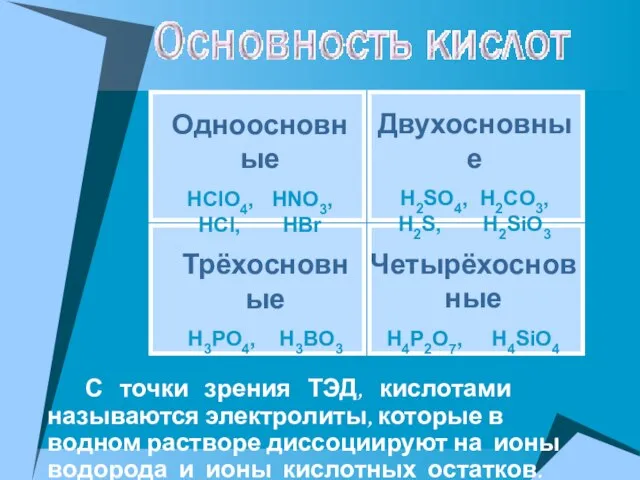
- 5. С точки зрения ТЭД, кислотами называются электролиты, которые в водном растворе диссоциируют на ионы водорода и
- 6. HCl = H+ + Cl- HNO3 = H+ + NO3- H2 SO4 = 2H+ + SO4
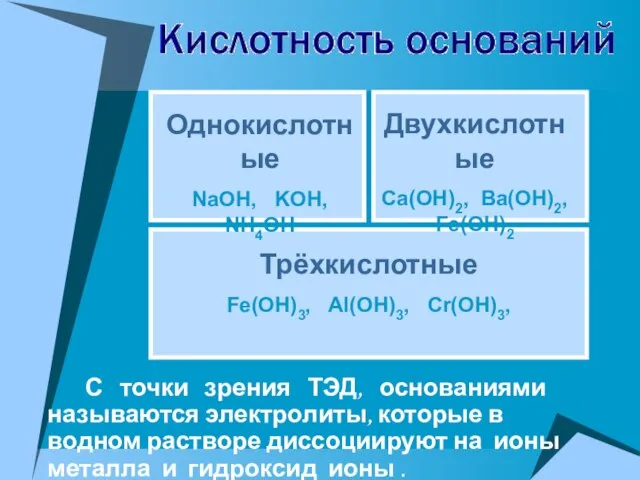
- 7. С точки зрения ТЭД, основаниями называются электролиты, которые в водном растворе диссоциируют на ионы металла и
- 8. NaOH = Na+ + OH- Ba(OH)2 = Ba2+ + 2OH- KOH = K+ + OH- Основания
- 9. Соли – это электролиты, которые диссоциируют на катионы металла или аммония NH4+ и анионы кислотных остатков
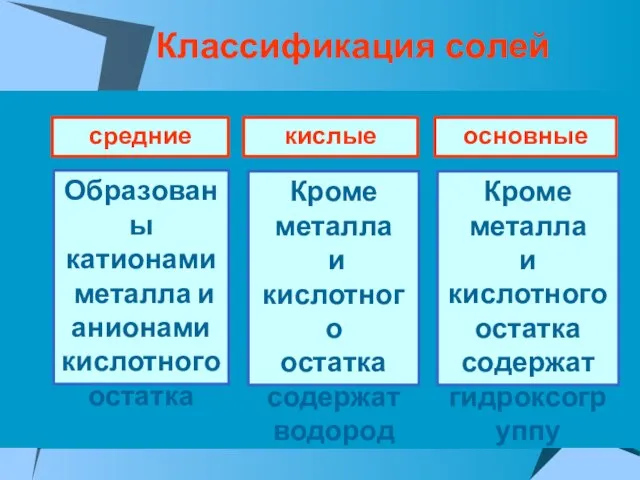
- 10. Классификация солей средние кислые основные Образованы катионами металла и анионами кислотного остатка Кроме металла и кислотного
- 11. С точки зрения ТЭД, средними солями называются электролиты, которые в водном растворе диссоциируют на ионы металла
- 12. С точки зрения ТЭД, кислыми солями называются электролиты, которые в водном растворе диссоциируют на ионы металла
- 13. Ba(OH)Cl = BaOH+ + Cl- BaOH- ⮀ Ba2+ + OH- С точки зрения ТЭД, основными солями
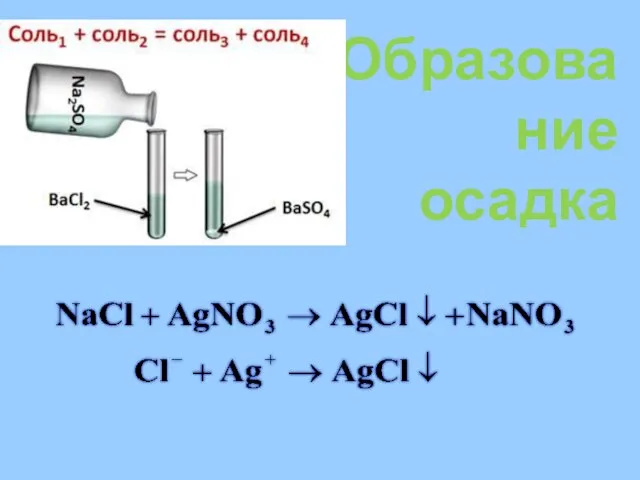
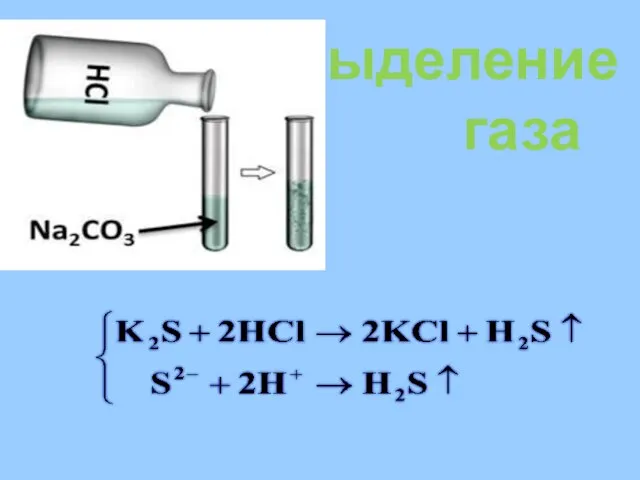
- 15. Реакции в растворах электролитов протекают когда: Образуется или растворяется осадок; Выделяется газ; Образуется малодиссоциирующее вещество (например
- 18. Образование осадка
- 20. Выделение газа
- 23. Скачать презентацию














 ИСКУССТВЕННЫЕ ПОЛИМЕРЫ
ИСКУССТВЕННЫЕ ПОЛИМЕРЫ Альдегіди
Альдегіди  Титриметрический анализ
Титриметрический анализ Насыщенные (предельные) углеводороды. Алканы (парафины)
Насыщенные (предельные) углеводороды. Алканы (парафины) Хімія та обмін вуглеводів
Хімія та обмін вуглеводів Липиды. Функции липидов
Липиды. Функции липидов Чистые вещества и смеси. Урок с использованием здоровьесберегающих технологии в 7 классе
Чистые вещества и смеси. Урок с использованием здоровьесберегающих технологии в 7 классе Омега 3
Омега 3 Бензол и его свойства
Бензол и его свойства Курсовая работа: синтез 3,5-диметилпиразола
Курсовая работа: синтез 3,5-диметилпиразола Геохимия природных процессов. Мономинеральный баланс рубидия в гранодиорите. (Лекция 4)
Геохимия природных процессов. Мономинеральный баланс рубидия в гранодиорите. (Лекция 4) Карбоновые кислоты 11 класс - Презентация по Химии_
Карбоновые кислоты 11 класс - Презентация по Химии_ Современные методы обработки продуктов. Молекулярная кухня
Современные методы обработки продуктов. Молекулярная кухня Аналитические реакции катионов I аналитической группы. Лекция 3
Аналитические реакции катионов I аналитической группы. Лекция 3 Презентация по Химии "ГАЗ" - скачать смотреть бесплатно
Презентация по Химии "ГАЗ" - скачать смотреть бесплатно ЧИСТЫЕ ВЕЩЕСТВА СМЕСИ
ЧИСТЫЕ ВЕЩЕСТВА СМЕСИ Энтропия. Изменение энтропии в изопроцессах
Энтропия. Изменение энтропии в изопроцессах Лучший способ избавиться от искушения – поддаться ему Оскар Уайльд
Лучший способ избавиться от искушения – поддаться ему Оскар Уайльд Презентация по Химии "ПЛАСТМАССЫ" - скачать смотреть бесплатно
Презентация по Химии "ПЛАСТМАССЫ" - скачать смотреть бесплатно Метаболизм нуклеиновых кислот
Метаболизм нуклеиновых кислот Российские химические технологии
Российские химические технологии Гибридизация орбиталей и строение молекул этана, этилена и ацетилена
Гибридизация орбиталей и строение молекул этана, этилена и ацетилена Химические вещества парабены
Химические вещества парабены Гидролиз неорганических веществ - солей
Гидролиз неорганических веществ - солей Природный и попутный нефтяной газы
Природный и попутный нефтяной газы Значення хімічних процесів у природі Виконала учениця 9-А класу, Велітченко Юлія
Значення хімічних процесів у природі Виконала учениця 9-А класу, Велітченко Юлія  Көмірсутектерді пиролиздеу арқылы қарапайым олефиндер алу
Көмірсутектерді пиролиздеу арқылы қарапайым олефиндер алу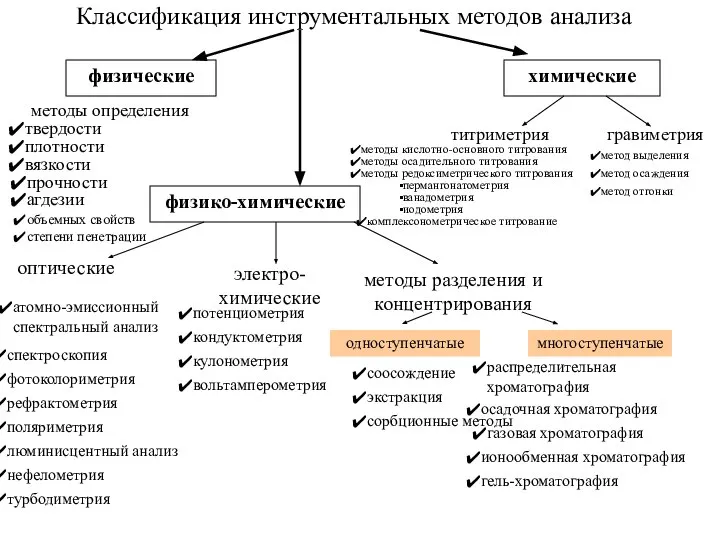 Классификация инструментальных методов анализа
Классификация инструментальных методов анализа