Содержание
- 2. Курс лекций по общей химии для студентов ФМХФ читает Болейко Гелена Михайловна к.б.н., доцент кафедры Общей
- 3. Рекомендуемая литература: *дадут на семинаре...
- 4. Рекомендуемая литература: *дадут на семинаре...
- 5. Рекомендуемая литература: *надо взять в библиотеке
- 6. 2. Смеси. Классификация по размеру частиц растворенного вещества. Чем отличаются смеси от химических соединений?
- 7. 1. Введение. Особенности химии как науки • Отсутствие собственных законов • Многообразие объектов • Создание собственного
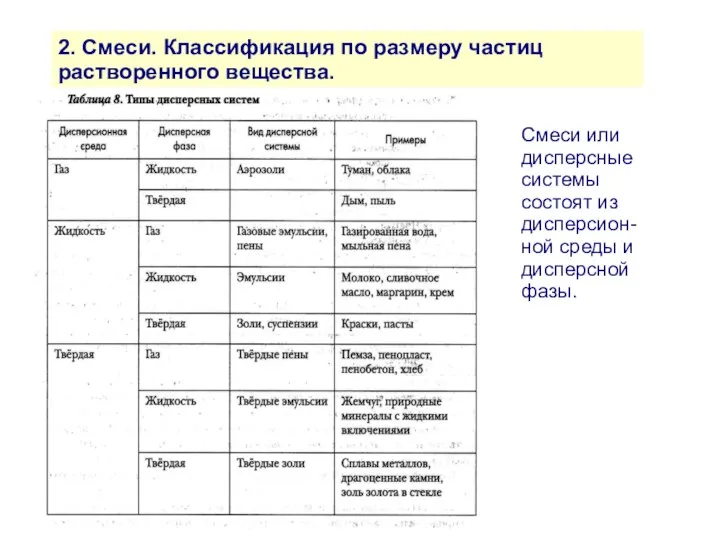
- 8. 2. Смеси. Классификация по размеру частиц растворенного вещества. Смеси или дисперсные системы состоят из дисперсион-ной среды
- 9. 2. Смеси. Классификация по размеру частиц растворенного вещества. По размерам частиц дисперсной фазы смеси можно разделить
- 10. 2. Смеси. Классификация по размеру частиц растворенного вещества. Эффект Тиндаля
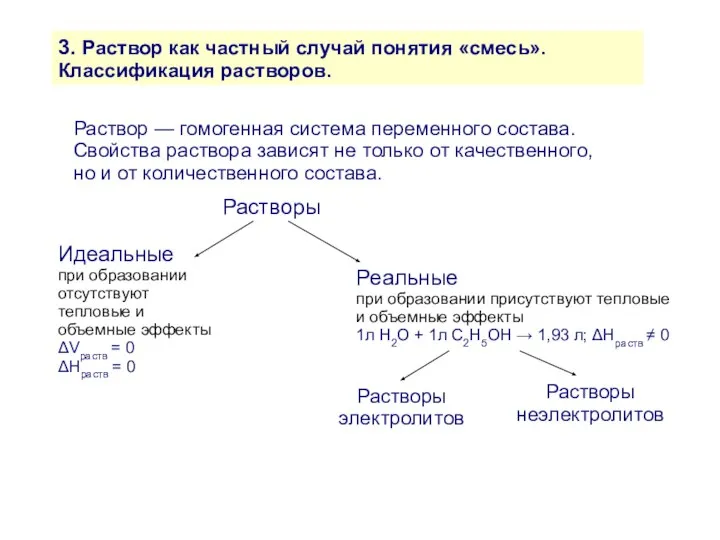
- 11. 3. Раствор как частный случай понятия «смесь». Классификация растворов. Раствор — гомогенная система переменного состава. Свойства
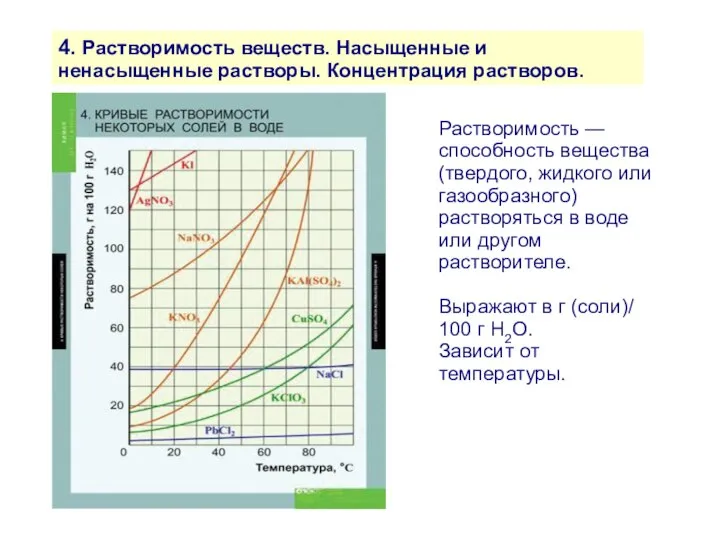
- 12. 4. Растворимость веществ. Насыщенные и ненасыщенные растворы. Концентрация растворов. Растворимость — способность вещества (твердого, жидкого или
- 13. 4. Растворимость веществ. Насыщенные и ненасыщенные растворы. Концентрация растворов. Насыщенный раствор — раствор, находящийся в контакте
- 14. 4. Растворимость веществ. Насыщенные и ненасыщенные растворы. Концентрация растворов. Ненасыщенные растворы Концентрированные Разбавленные Концентрация раствора —
- 15. 5. Способы выражения концентрации растворов. Безразмерные: ω = φ = X = Размерные: Молярная концентрация [моль/л]
- 16. 6. Растворы электролитов. Сильные и слабые электролиты. Электролиты — это вещества с ионными или полярными связями,
- 17. 6. Растворы электролитов. Сильные и слабые электролиты. Золотое правило алхимиков: подобное растворяется в подобном. Вода —
- 18. 6. Растворы электролитов. Сильные и слабые электролиты. Электролиты Сильные Слабые диссоциируют полностью частично необратимо обратимо KA
- 19. 6. Растворы электролитов. Сильные и слабые электролиты. Сильные электролиты: 1. Практически все соли. 2. Минеральные кислоты:
- 20. 7. Диссоциация сильных электролитов. Понятие «активности».. Сильные электролиты диссоциируют полностью и необратимо => - в растворе
- 21. 7. Диссоциация сильных электролитов. Понятие «активности».. Уравнения диссоциации сильных электролитов: HNO3 → H+ + NO3- Ba(OH)2
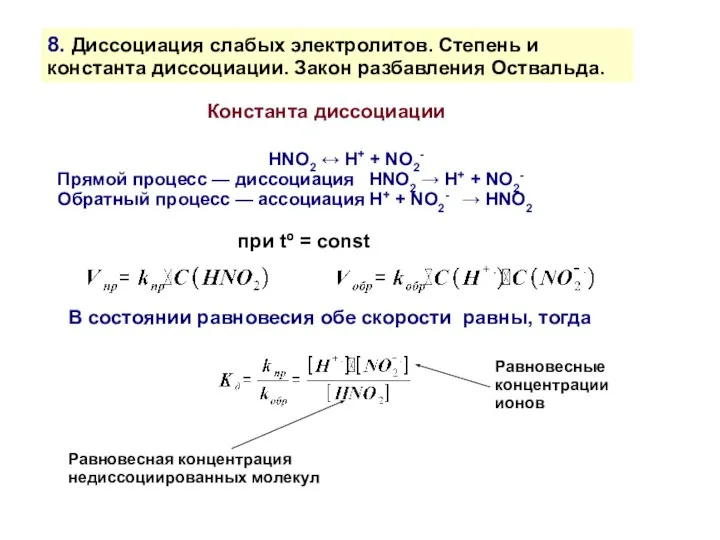
- 22. 8. Диссоциация слабых электролитов. Степень и константа диссоциации. Закон разбавления Оствальда. HNO2 ↔ H+ + NO2-
- 23. 8. Диссоциация слабых электролитов. Степень и константа диссоциации. Закон разбавления Оствальда. HNO2 ↔ H+ + NO2-
- 24. 8. Диссоциация слабых электролитов. Степень и константа диссоциации. Закон разбавления Оствальда. HNO2 ↔ H+ + NO2-
- 25. 8. Диссоциация слабых электролитов. Степень и константа диссоциации. Закон разбавления Оствальда. HNO2 ↔ H+ + NO2-
- 26. 9. Ионное произведение воды. Водородный и гидроксильный показатели. H2O ↔ H+ + OН- Вода — слабый
- 27. 9. Ионное произведение воды. Водородный и гидроксильный показатели. H2O ↔ H+ + OН- Кw = [H+]·[ОН-]
- 28. 9. Ионное произведение воды. Водородный и гидроксильный показатели. H2O ↔ H+ + OН- Кw = [H+]·[ОН-]
- 29. 9. Ионное произведение воды. Водородный и гидроксильный показатели. H2O ↔ H+ + OН- Кw = [H+]·[ОН-]
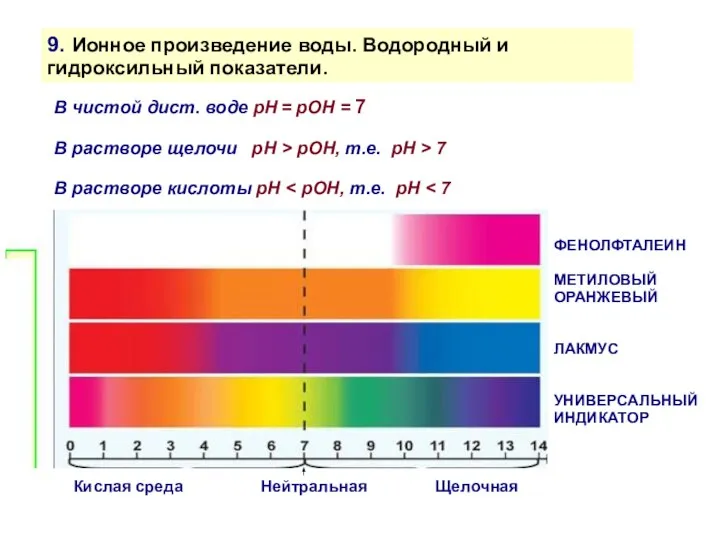
- 30. 9. Ионное произведение воды. Водородный и гидроксильный показатели. В чистой дист. воде рH = рОН =
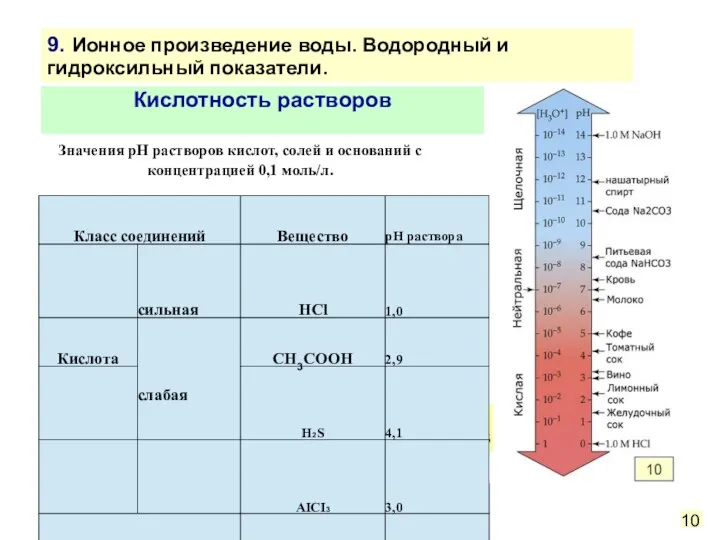
- 31. Кислотность растворов Значения pH растворов кислот, солей и оснований с концентрацией 0,1 моль/л. 10 9. Ионное
- 32. Произведение растворимости: Произведение растворимости (ПР) — это произведение равновесных концентраций ионов электролита в НАСЫЩЕННОМ растворе, взятых
- 33. Произведение растворимости: Как определить РАСТВОРИМОСТЬ труднорастворимого электролита, зная его ПР? PbI2 (тв) ↔ Pb2+ (раств) +
- 34. Условия выпадения и растворения осадков: Если в некотором произвольном растворе произведение концентраций (ПК) ионов меньше, чем
- 35. Определение рН сильных электролитов: Для сильных электролитов активность средообразующих ионов равна активности самого электролита. 1. Записываем
- 36. 9. Ионное произведение воды. Водородный и гидроксильный показатели. ЗАДАЧИ: 1. Определите рН 0,05М раствора HCl. 2.
- 38. Скачать презентацию





























 Теория строения химических соединений А.М. Бутлерова
Теория строения химических соединений А.М. Бутлерова Возведение наземных стальных резервуаров
Возведение наземных стальных резервуаров Пируватдегидрогеназный комплекс
Пируватдегидрогеназный комплекс Повышение эффективности разработки низкопродуктивных коллекторов самотлорского месторождения
Повышение эффективности разработки низкопродуктивных коллекторов самотлорского месторождения Штучні і синтетичні волокна
Штучні і синтетичні волокна  Теория горения горючих дисперсных материалов
Теория горения горючих дисперсных материалов  Вода. Растворы. Растворение
Вода. Растворы. Растворение Получение и применение порфиринов и их аналогов
Получение и применение порфиринов и их аналогов Реакции иммунного лизиса. Реакция связывания комплемента (РСК)
Реакции иммунного лизиса. Реакция связывания комплемента (РСК) Химическая Кинетика
Химическая Кинетика Классификация химических реакций в органической и неорганической химии
Классификация химических реакций в органической и неорганической химии Сера в таблице Д.И. Менделеева
Сера в таблице Д.И. Менделеева Инертные газы
Инертные газы Этиленгликоль. Физические свойства
Этиленгликоль. Физические свойства Практическое применение метанола
Практическое применение метанола Тиімді қоректенудің биохимиялық негіздері. Қоректік заттар катаболизмінің жалпы жолдары
Тиімді қоректенудің биохимиялық негіздері. Қоректік заттар катаболизмінің жалпы жолдары Презентация по Химии "портфоліо" - скачать смотреть
Презентация по Химии "портфоліо" - скачать смотреть  Предельные углеводороды и их галогенопроизводные. Спирты, эфиры, альдегиды и их производные
Предельные углеводороды и их галогенопроизводные. Спирты, эфиры, альдегиды и их производные Растворы. Основные понятия. Концентрация. Законы Рауля
Растворы. Основные понятия. Концентрация. Законы Рауля Көпатомды спирттер. Химиялық қасиеттері
Көпатомды спирттер. Химиялық қасиеттері Эволюция антропогенных загрязнений в окружающей среде. Роль физико-химических явлений
Эволюция антропогенных загрязнений в окружающей среде. Роль физико-химических явлений Свободное окисление и токсические формы кислорода
Свободное окисление и токсические формы кислорода Углеводороды. Алкены
Углеводороды. Алкены Дезодоранты. Выполнили: Ученицы 11-В класса МОУ «Лицей №3» Доровских Алёна Чучуменко Анастасия
Дезодоранты. Выполнили: Ученицы 11-В класса МОУ «Лицей №3» Доровских Алёна Чучуменко Анастасия Состав энергетических напитков
Состав энергетических напитков Природній та супутній нафтові гази, їх склад, використання
Природній та супутній нафтові гази, їх склад, використання Наполненные полимеры. Структура и физико-химические свойства. Введение
Наполненные полимеры. Структура и физико-химические свойства. Введение Биохимия печени
Биохимия печени