Содержание
- 2. Нормативное обеспечение Федеральный закон от 29.12.2013 № 273-ФЗ «Об образовании в Российской Федерации» Приказ Минобрнауки России
- 3. Итоговая аттестация Основные задачи: объективность проведения создание условий для участников с ОВЗ снижение уровня психологической нагрузки
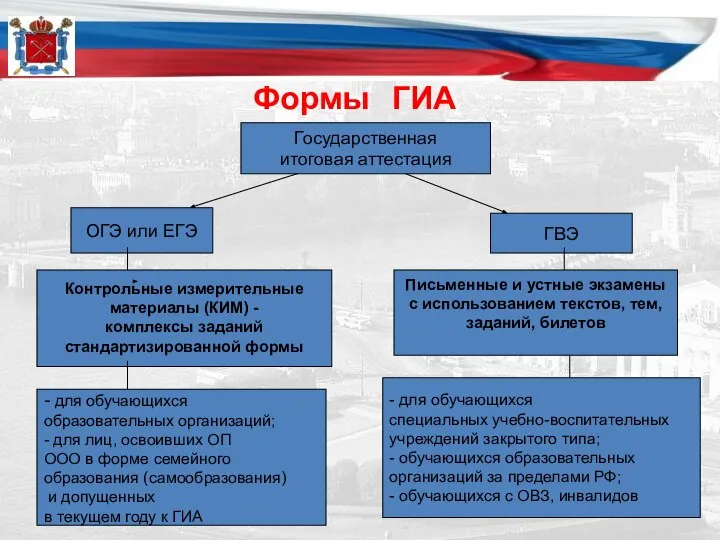
- 4. Формы ГИА ОГЭ или ЕГЭ ГВЭ Государственная итоговая аттестация Контрольные измерительные материалы (КИМ) - комплексы заданий
- 5. К ГИА допускаются обучающиеся не имеющие академической задолженности в полном объеме выполнившие учебный план либо получившие
- 6. ГИА – 9 включает в себя: обязательные экзамены по русскому языку и математике обязательные экзамены по
- 7. В 2016 году результаты экзаменов по выбору (в том числе неудовлетворительные) не влияют на получение аттестата
- 8. Механизм обеспечения объективности проведения ГИА увеличение количества аудиторий с наблюдением в режиме oн-лайн расширение практики общественного
- 9. НОВОВЕДЕНИЯ по снижению уровня психологической нагрузки для обучающихся, не прошедших ГИА в основные сроки, возможность пересдать
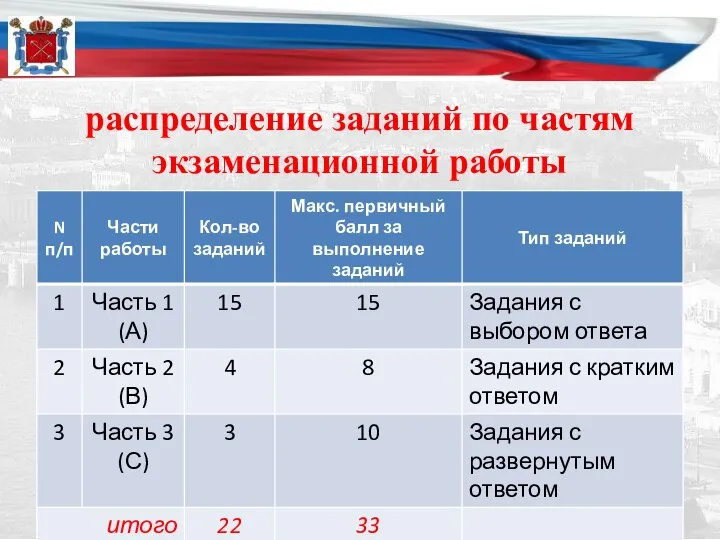
- 10. распределение заданий по частям экзаменационной работы
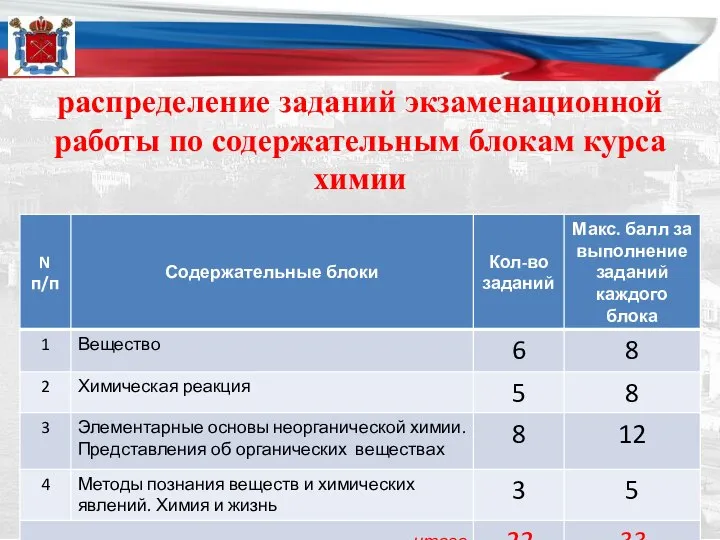
- 11. распределение заданий экзаменационной работы по содержательным блокам курса химии
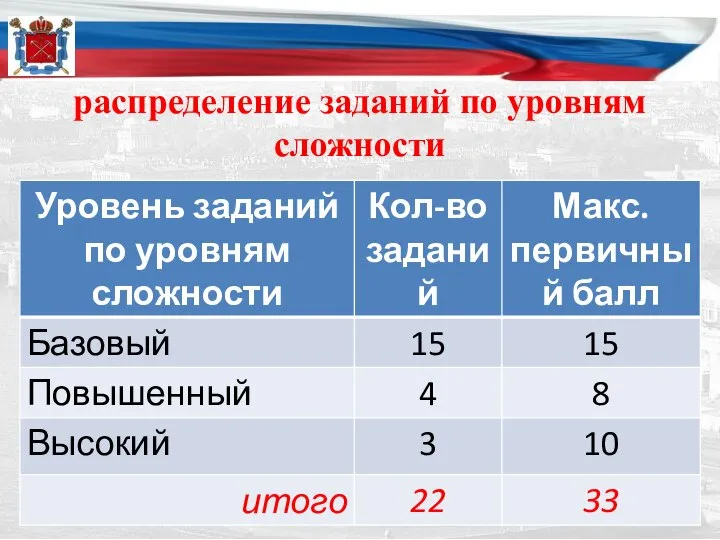
- 12. распределение заданий по уровням сложности
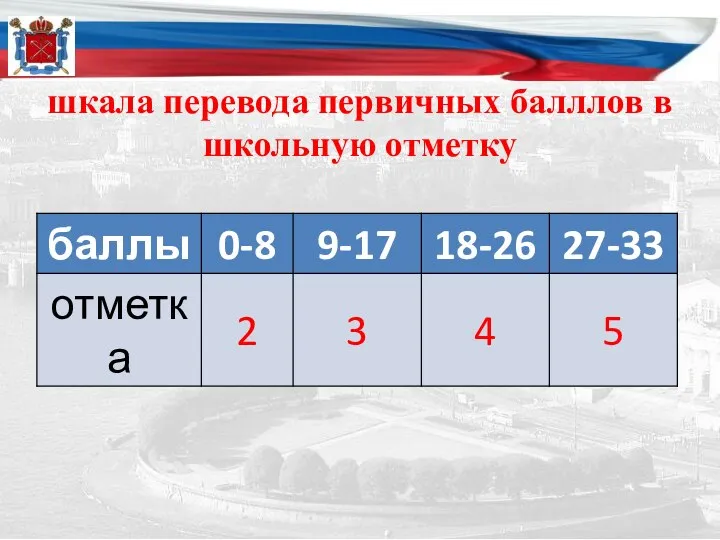
- 13. шкала перевода первичных балллов в школьную отметку
- 14. сведения об участниках ОГЭ по химии 2014 – 124 человека 2015 – 72 человека 2016 –
- 15. структура работы ОГЭ по химии 1-15 - на выбор одного правильного ответа 16 -17 - на
- 16. время на написание работы ОГЭ по химии 120 минут
- 17. наиболее типичные ошибки, выявленные в знаниях базового уровня 9. Химические свойства простых веществ: металлов и неметаллов
- 18. наиболее типичные ошибки, выявленные в знаниях базового уровня 13. Чистые вещества и смеси. Правила безопасной работы
- 19. наиболее типичные ошибки, выявленные в знаниях повышенного уровня 17. Первоначальные сведения об органических веществах… 19. Химические
- 20. Задание 20 (С1) Используя метод электронного баланса, составьте уравнение реакции: KNO3 + KI + H2SO4 →
- 21. Требования к выполнению задания 20 (С1) Составлен электронный баланс 2 N+3 + 1 е → N+2
- 22. Посмотрим варианты решения учащимися задания 20 (С1) 2 Ученик №1
- 23. Посмотрим варианты решения учащимися задания 20 (С1) 2 Ученик №2
- 24. Задание 21 (С2) Через раствор нитрата меди (II) массой 37,6 г и массовой долей 5% пропустили
- 25. Требования к выполнению задания 21 (С2) Составлено уравнение реакции: Cu(NO3)2 + H2S→ CuS + 2HNO3 2)
- 26. Посмотрим варианты решения учащимися задания 21 (С2) 3 Ученик №1
- 27. Посмотрим варианты решения учащимися задания 21 (С2) 3 Ученик №2
- 28. Посмотрим варианты решения учащимися задания 21 (С2) 1 Ученик №3
- 29. Посмотрим варианты решения учащимися задания 21 (С2) 3 Ученик №4
- 30. Посмотрим варианты решения учащимися задания 21 (С2) 1 Ученик №5
- 31. Задание 22 (С3) Для проведения эксперимента предло-жены следующие реактивы: Cu, CuO, растворы: NaCl, AgNO3, HNO3, HCl.
- 32. Требования к выполнению задания 21 (С2) Составлены 2 уравнения реакции: 1) CuO +2 HCl = CuCl2
- 33. Посмотрим варианты решения учащимися задания 22 (С3) 0 Ученик №1
- 34. Посмотрим варианты решения учащимися задания 22 (С3) 2 Ученик №2
- 35. Посмотрим варианты решения учащимися задания 22 (С3) 4 Ученик №3
- 37. Скачать презентацию





























 Физика древесины
Физика древесины Полиэтилен - термопластичный полимер этилена
Полиэтилен - термопластичный полимер этилена Алкины. Ацетилен (Этин) – С2Н2
Алкины. Ацетилен (Этин) – С2Н2 Характеристика химического элемента по положению в периодической системе химических элементов
Характеристика химического элемента по положению в периодической системе химических элементов Петрография некоторых распространенных метаморфических пород
Петрография некоторых распространенных метаморфических пород Хімія як наука
Хімія як наука Рибосомы, генетический код, трансляция. (Лекция 7)
Рибосомы, генетический код, трансляция. (Лекция 7) Новые вещества и материалы Презентация по химии Ученицы 11 класса Закатаевой Тани_
Новые вещества и материалы Презентация по химии Ученицы 11 класса Закатаевой Тани_ Вода в організмах
Вода в організмах “ КОРОЗІЯ МЕТАЛІВ. ЗАХИСТ ВІД КОРОЗІЇ ” Підготував: Учень 10-А класу ЗОШ №25 м. Луцька Матвійчук Роман
“ КОРОЗІЯ МЕТАЛІВ. ЗАХИСТ ВІД КОРОЗІЇ ” Підготував: Учень 10-А класу ЗОШ №25 м. Луцька Матвійчук Роман  Кремний и его соединения. Кристаллическая решётка кремния
Кремний и его соединения. Кристаллическая решётка кремния Химические свойства полимеров
Химические свойства полимеров Классификация минералов по химическому принципу. Занятие 14
Классификация минералов по химическому принципу. Занятие 14 Учебно-познавательный проект на тему: «Физико-химические процессы, происходящие при выпечке и хранении хлеба и хлебобулочных изде
Учебно-познавательный проект на тему: «Физико-химические процессы, происходящие при выпечке и хранении хлеба и хлебобулочных изде Металлы и сплавы
Металлы и сплавы Мас-спектр кластерів вуглецю
Мас-спектр кластерів вуглецю Ферменты 3. Медицинская энзимология. (Лекция 3)
Ферменты 3. Медицинская энзимология. (Лекция 3) Мел - полезное ископаемое моего села
Мел - полезное ископаемое моего села Вращательная энергия молекул
Вращательная энергия молекул Презентация по Химии "Насичені одноатомні спирти" - скачать смотреть бесплатно
Презентация по Химии "Насичені одноатомні спирти" - скачать смотреть бесплатно Лекция 5. Красные пигменты
Лекция 5. Красные пигменты Рентгеноструктуралық анализ. Лауе тәжірибесі, Брегг-Вульф теңдеуі, оны шығару жолдары
Рентгеноструктуралық анализ. Лауе тәжірибесі, Брегг-Вульф теңдеуі, оны шығару жолдары Металлы Общая характеристика
Металлы Общая характеристика π-комплексы металлов. Природа связи металлуглерод в π-комплексах металлов. Отличия в свойствах от обычной σ-связи
π-комплексы металлов. Природа связи металлуглерод в π-комплексах металлов. Отличия в свойствах от обычной σ-связи Сырьё для получения фенолальдегидных полимеров
Сырьё для получения фенолальдегидных полимеров Основания, кислоты, соли в свете ТЭД
Основания, кислоты, соли в свете ТЭД Презентация по Химии "«Увлекательные факты из жизни Менделеева»" - скачать смотреть
Презентация по Химии "«Увлекательные факты из жизни Менделеева»" - скачать смотреть  Исследование остаточной концентрации моющих средств на посуде
Исследование остаточной концентрации моющих средств на посуде