Содержание
- 2. Оксид углерода (II) Оксид углерода (II) – ядовитый газ без цвета и запаха, горит голубоватым пламенем,
- 3. Оксид углерода (II) При обычных температурах СО не вступает в реакции с водой, щелочами, кислотами. При
- 4. Оксид углерода (II) При обычных температурах СО не вступает в реакции с водой, щелочами, кислотами. При
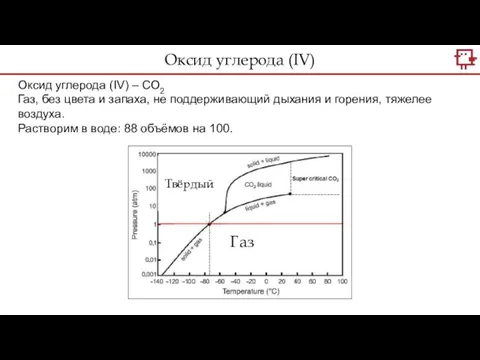
- 5. Оксид углерода (IV) Оксид углерода (IV) – CO2 Газ, без цвета и запаха, не поддерживающий дыхания
- 6. Оксид углерода (IV) При больших концентрациях оксид углерода (IV) – яд! При концентрациях около 3% в
- 7. Оксид углерода (IV) СО2 – ангидрид угольной кислоты Н2СО3. При растворении СО2 в воде частично образуется
- 8. Оксид углерода (IV) Соли угольно кислоты – карбонаты и гидрокарбонаты. Качественная реакция на соли действие сильных
- 9. Оксид углерода (IV) Наибольшее значение из карбонатов имеет – сода: Na2CO3*10H2O; Na2CO3*7H2O; Na2CO3*H2O. Cоду получают методом
- 10. Кремний Неметалл кремний в самородном виде имеет металлический облик. SiO2 + 2Mg ? Si + 2MgO
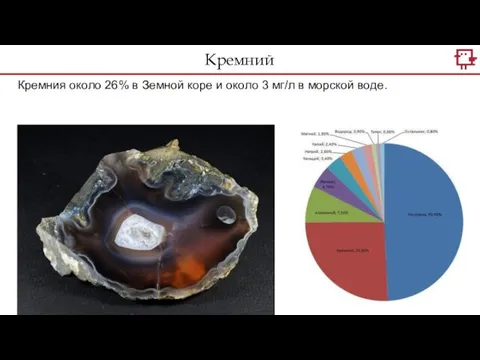
- 11. Кремний Кремния около 26% в Земной коре и около 3 мг/л в морской воде.
- 12. Кремний Гранат Са3Fe3+2[SiO4]3 Оливин Mg2[SiO4] Серпентин Mg3Si2O5(OH)4
- 13. Кремний Кремний – типичный восстановитель. Si + O2 = SiO2 SiO2 + Si = 2SiO 2Si
- 14. Кремний растворяется в смеси концентрированных азотной и плавиковой кислот: 3Si + 4HNO3 + 12HF = 3SiF4
- 15. Бесцветные кристаллы с температурой плавления около +1728 °C, обладающие высокой твёрдостью и прочностью. SiO2 + H2O
- 16. На самом деле группа кислот с общей формулой mH2O*nSiO2 Из кремниевых кислот известны: метакремниевая H2SiO3, ортокремниевая
- 17. Промышленное применение кремния и его производных: Силикатная промышленность: Кремний
- 18. Германий – типичный полупроводник. Валентность 2, 4. Общее содержание германия в земной коре 7.10—4% по массе,
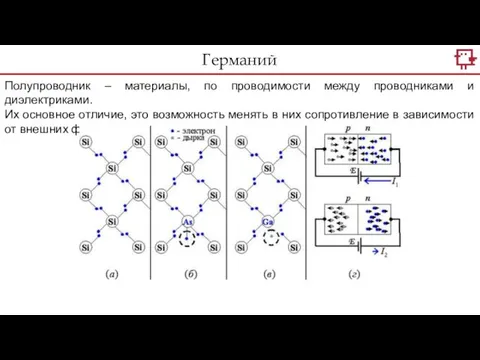
- 19. Полупроводник – материалы, по проводимости между проводниками и диэлектриками. Их основное отличие, это возможность менять в
- 20. Полупроводник – материалы, по проводимости между проводниками и диэлектриками. Их основное отличие, это возможность менять в
- 21. Основное применение Германия – в электротехнике, а точнее в диодах. Германий
- 22. Свинец Свинец – типичный металл. Для него характерны валентности 2, 4. Этот металл очень давно известен
- 23. Аккумуляторы Свинцовые аккумуляторы имеют широкое применение, особенно в транспортный средствах. Реакции (слева направо – работа, справа
- 24. Сколько лет Земле? Цепочка радиоактивного распада:
- 25. Металлы
- 26. Щелочные металлы Щелочноземельные металлы Металлы
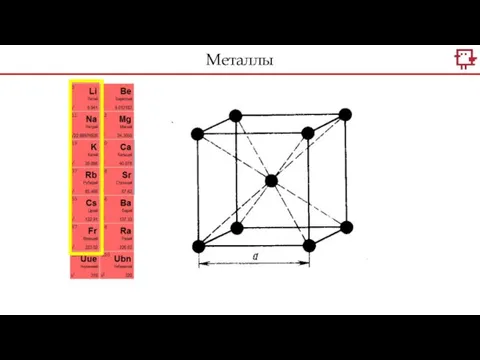
- 27. Металлы
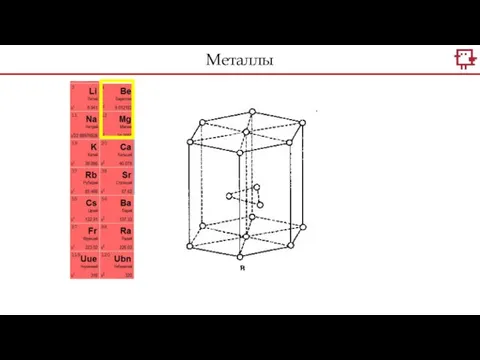
- 28. Металлы
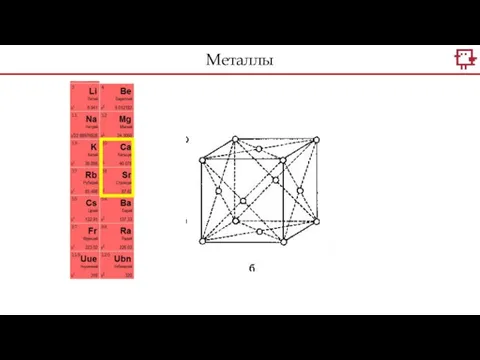
- 29. Металлы
- 31. Скачать презентацию








![Кремний Гранат Са3Fe3+2[SiO4]3 Оливин Mg2[SiO4] Серпентин Mg3Si2O5(OH)4](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/558404/slide-11.jpg)












 Сложные эфиры
Сложные эфиры Химические свойства оксидов
Химические свойства оксидов Плотнейшие упаковки одинаковых сфер
Плотнейшие упаковки одинаковых сфер Базы для кислых и щелочных сред
Базы для кислых и щелочных сред VII группа периодической системы Д.И.Менделеева. Кислота хлористоводородная. Натрия и калия хлориды. Натрия и калия бромиды
VII группа периодической системы Д.И.Менделеева. Кислота хлористоводородная. Натрия и калия хлориды. Натрия и калия бромиды Биохимия почвообразования. Кора выветривания. Круговорот веществ в природе. Гранулометрический состав почвы. (Лекция 2)
Биохимия почвообразования. Кора выветривания. Круговорот веществ в природе. Гранулометрический состав почвы. (Лекция 2) Вода. Химические и физические свойства воды
Вода. Химические и физические свойства воды Емульсії. Основні типи емульсій
Емульсії. Основні типи емульсій Галогены
Галогены Ионное произведение воды. Понятие о рН раствора
Ионное произведение воды. Понятие о рН раствора Абсорбция, адсорбция, конденсация
Абсорбция, адсорбция, конденсация Тренажер Знаки Хэ
Тренажер Знаки Хэ Сульфатна кислота
Сульфатна кислота  Водорастворимые витамины. 7 свойств водорастворимых витаминов
Водорастворимые витамины. 7 свойств водорастворимых витаминов Схема интеграции пентозофосфатного шунта с гликолизом
Схема интеграции пентозофосфатного шунта с гликолизом Урок – сказка Первоначальные сведения о строении вещества
Урок – сказка Первоначальные сведения о строении вещества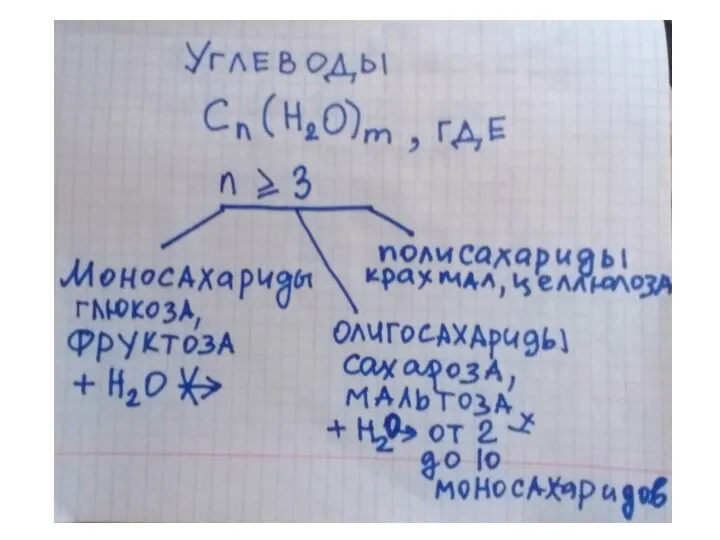 Крахмал и целлюлоза
Крахмал и целлюлоза Алкины — углеводороды, содержащие тройную связь между атомами углерода
Алкины — углеводороды, содержащие тройную связь между атомами углерода Шестичленні гетероцикли з одним гетероатомом. Піридин
Шестичленні гетероцикли з одним гетероатомом. Піридин Горение. Подводный факел
Горение. Подводный факел Классы неорганических соединений
Классы неорганических соединений Физико-химические методы исследования (анализа) строения и реакционной способности органических соединений
Физико-химические методы исследования (анализа) строения и реакционной способности органических соединений Предмет и задачи биохимии. Белки. (Лекция 1)
Предмет и задачи биохимии. Белки. (Лекция 1) Карбоновые кислоты
Карбоновые кислоты Основы легирования стали. Классификация и маркировка легированных сталей
Основы легирования стали. Классификация и маркировка легированных сталей Влияние этилового спирта на организм детей
Влияние этилового спирта на организм детей Метаболизм белков и аминокислот
Метаболизм белков и аминокислот Основы минералогии. Характеристика минералов
Основы минералогии. Характеристика минералов