Содержание
- 2. ВВЕДЕНИЕ (2) * ЦЕЛИ КУРСА создать основу для дальнейшего изучения химических дисциплин, сформировать элементарные навыки работы
- 3. ПРЕДМЕТ ХИМИИ (1) Химия – естественная наука, изучающая вещества, их строение, свойства и превращения. Вещество –
- 4. ПРЕДМЕТ ХИМИИ (2) Материя находится в непрерывном движении (филос.: материя не существует без движения). Формы движения
- 5. * Основы химии. ПРЕДМЕТ ХИМИИ (3) Мерой движения и взаимодействия различных видов материи служит энергия Мерой
- 6. ПРЕДМЕТ ХИМИИ (4) * Основы химии. 20 млн. органических веществ 0,5 млн. неорганических веществ Каждое из
- 7. ПРЕДМЕТ ХИМИИ (5) * Основы химии. Превращения веществ, сопровождающиеся изменением состава, называются химическими реакциями. Химические реакции
- 8. СКОЛЬКО ХИМИЙ НА СВЕТЕ? Журнал «Химия и жизнь - XXI век». №№ 5 и 6, 2009
- 9. РАЗДЕЛЫ ХИМИИ (1) * Основы химии. Общая химия - изучает общетеоретические вопросы химии: основные понятия и
- 10. РАЗДЕЛЫ ХИМИИ (2) * Основы химии. Неорганическая химия - занимается изучением химической природы элементов и их
- 11. РАЗДЕЛЫ ХИМИИ (3) * Основы химии. Физическая химия использует физические методы для изучения химических систем. Важное
- 12. РАЗДЕЛЫ ХИМИИ (4) * Основы химии. Биохимия изучает сложнейшие химические процессы, протекающие в живых организмах Геохимия
- 13. ОБЪЕКТЫ ИЗУЧЕНИЯ (1) * Основы химии. Объектом изучения в химии являются химические элементы и их соединения
- 14. ОБЪЕКТЫ ИЗУЧЕНИЯ (2) * Основы химии. Химический элемент (лат. elementum - часть чего-то) – совокупность (вид)
- 15. ОБЪЕКТЫ ИЗУЧЕНИЯ (3) * Основы химии. Каждый элемент обозначается символом из одной или двух латинских букв
- 16. ОБЪЕКТЫ ИЗУЧЕНИЯ (4) * Основы химии. Химические элементы существуют в виде простых веществ, состоящих из атомов
- 17. ПРОСТЫЕ И СЛОЖНЫЕ ВЕЩЕСТВА * Основы химии.
- 18. АЛЛОТРОПИЯ (1) * Основы химии. Аллотропия – способность химического элемента образовывать несколько простых веществ, называемых аллотропными
- 19. АЛЛОТРОПИЯ(2) Аллотропные модификации олова: α-Sn (серое олово, полупроводник со структурой алмаза) и β-Sn (обычное белое олово,
- 20. АЛЛОТРОПИЯ (3) Аллотропные модификации фосфора Р: белый (желтый), красный и черный * Основы химии.
- 21. АЛЛОТРОПИЯ (4) Аллотропные модификации серы (S): ромбическая, моноклинная и пластическая (аморфная) Аллотропные модификации кислорода: молекулярный кислород
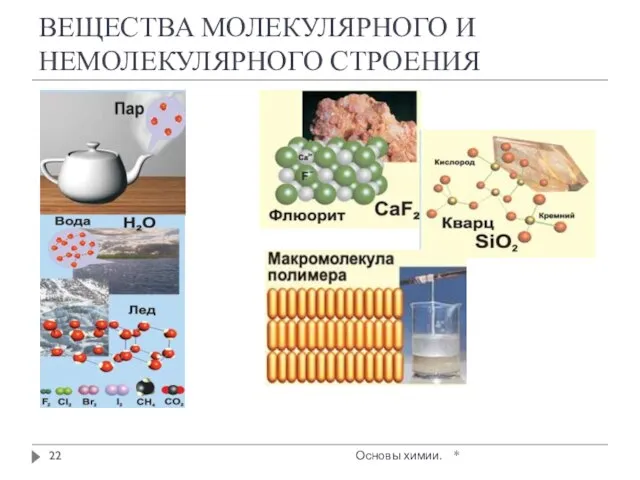
- 22. ВЕЩЕСТВА МОЛЕКУЛЯРНОГО И НЕМОЛЕКУЛЯРНОГО СТРОЕНИЯ * Основы химии.
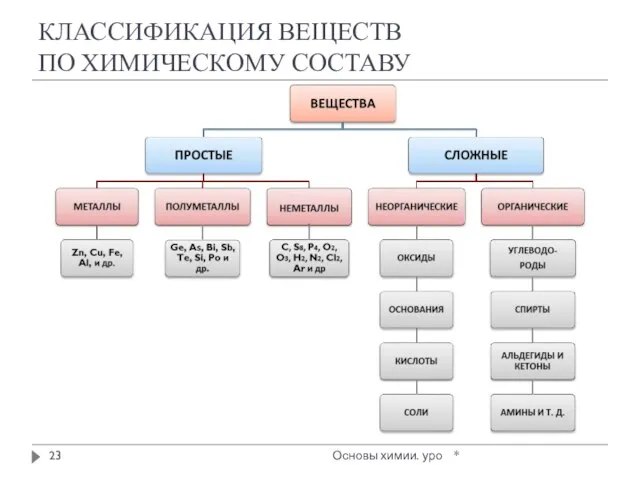
- 23. КЛАССИФИКАЦИЯ ВЕЩЕСТВ ПО ХИМИЧЕСКОМУ СОСТАВУ * Основы химии. уро
- 24. ОСНОВНЫЕ ЗАКОНЫ ХИМИИ (1) * Основы химии. Закон сохранения материи и энергии Если в одном месте
- 25. ОСНОВНЫЕ ЗАКОНЫ ХИМИИ (2) * Основы химии. Закон постоянства состава вещества Всякое чистое вещество независимо от
- 26. ОСНОВНЫЕ ЗАКОНЫ ХИМИИ (3) Закон кратных отношений Если два химических элемента дают несколько соединений, то массовые
- 27. ОСНОВНЫЕ ЗАКОНЫ ХИМИИ (4) Закон объемных отношений Объемы газов, вступающих в химическую реакцию, и объемы газов,
- 28. ОСНОВНЫЕ ПОНЯТИЯ (1) Атом – электронейтральная частица, состоящая из положительно заряженного ядра и вращающихся вокруг него
- 29. ОСНОВНЫЕ ПОНЯТИЯ (2) Масса атомов и молекул очень мала, 10-24 – 10-23 г Например, масса атома
- 30. ОСНОВНЫЕ ПОНЯТИЯ (3) Относительная атомная масса элемента Ar (или просто атомная масса) – масса атома, выраженная
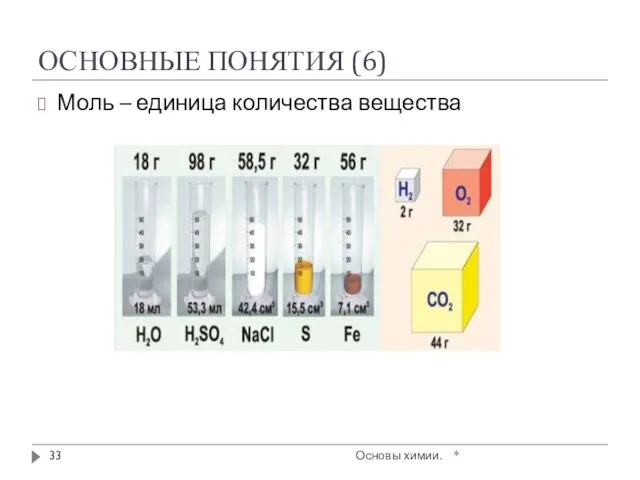
- 31. ОСНОВНЫЕ ПОНЯТИЯ (4) МОЛЬ - это количество вещества, содержащее столько частиц (атомов, молекул, ионов, электронов или
- 32. ОСНОВНЫЕ ПОНЯТИЯ (5) Молярная масса (М) – масса 1 моля вещества в граммах [М] = [г/моль]
- 33. ОСНОВНЫЕ ПОНЯТИЯ (6) Моль – единица количества вещества * Основы химии.
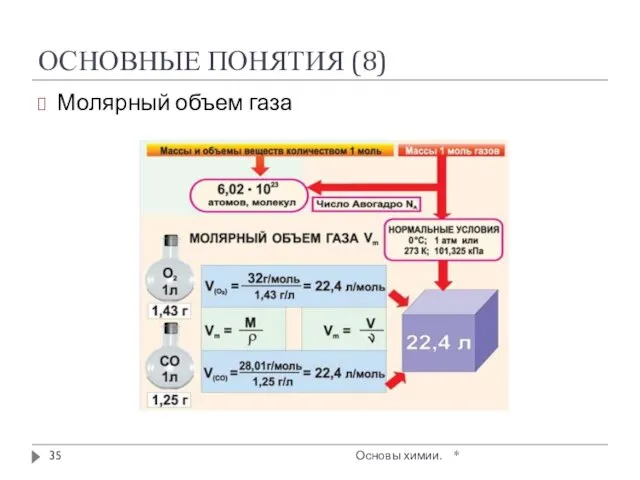
- 34. ОСНОВНЫЕ ПОНЯТИЯ (7) * Основы химии. Молярный объем газа VM – объем одного моля газа при
- 35. ОСНОВНЫЕ ПОНЯТИЯ (8) Молярный объем газа * Основы химии.
- 36. ОСНОВНЫЕ ПОНЯТИЯ (7) Моль это: 6,02•1023 частиц масса вещества в граммах, численно равная молярной массе вещества
- 38. Скачать презентацию































 Кислоты
Кислоты Фенолдар. Анықтама
Фенолдар. Анықтама Одноатомные спирты. Состав. Строение. Свойства.
Одноатомные спирты. Состав. Строение. Свойства.  Общая и неорганическая химия. Строение атома и периодическая система. Химическая связь и строение вещества
Общая и неорганическая химия. Строение атома и периодическая система. Химическая связь и строение вещества Металлы
Металлы Презентация по химии Презентация
Презентация по химии Презентация Окислительно-восстановительные реакции
Окислительно-восстановительные реакции СОСТАВ И СВОЙСТВА ЗУБНЫХ ПАСТ «Полезность любого исследования измеряется не присущими ему качествами, а способностью тех, кто пол
СОСТАВ И СВОЙСТВА ЗУБНЫХ ПАСТ «Полезность любого исследования измеряется не присущими ему качествами, а способностью тех, кто пол Изменение агрегатных состояний вещества
Изменение агрегатных состояний вещества Презентация по Химии "История открытия периодического закона и его экспериментальное подтверждение" - скачать смотреть
Презентация по Химии "История открытия периодического закона и его экспериментальное подтверждение" - скачать смотреть  История мыловарения. Мыло своими руками
История мыловарения. Мыло своими руками Классификация материалов
Классификация материалов Введение. Источники сырья для лекарственных веществ и препаратов. Понятие органический синтез. Полный органический синтез
Введение. Источники сырья для лекарственных веществ и препаратов. Понятие органический синтез. Полный органический синтез Поліетелен. Застосування поліетилену
Поліетелен. Застосування поліетилену Раствор. Типы растворов. Способы выражения концентрации растворов. Теория электролитической диссоциации
Раствор. Типы растворов. Способы выражения концентрации растворов. Теория электролитической диссоциации Химическая картина мира
Химическая картина мира Закономерности управления простым обратимым гомогенным процессом
Закономерности управления простым обратимым гомогенным процессом Месторождения турмалина
Месторождения турмалина Серная кислота
Серная кислота Презентация на тему: Фенол Выполнила ученица 11-б класса: Зануда Татьяна Проверила: учитель химии: Тисленко.Л.А
Презентация на тему: Фенол Выполнила ученица 11-б класса: Зануда Татьяна Проверила: учитель химии: Тисленко.Л.А  Классификация электродов. (Лекция 4)
Классификация электродов. (Лекция 4) Химическая термодинамика и кинетика
Химическая термодинамика и кинетика Закономерности химических реакций
Закономерности химических реакций Органическая геохимия
Органическая геохимия Важнейшие химические понятия и законы
Важнейшие химические понятия и законы Урок химии в 8 классе
Урок химии в 8 классе Предмет, задачи и значение физической химии
Предмет, задачи и значение физической химии Альдегиды и кетоны
Альдегиды и кетоны