Содержание
- 2. УГЛЕРОД И ЕГО СОЕДИНЕНИЯ
- 3. Углерод С сталь сельское хозяйство топливо медицина типография ювелирные изделия адсорбент резина крем обуви ПРИМЕНЕНИЕ
- 4. ЦЕЛИ УРОКА: – установить строение атома углерода по его положению в ПС; – изучить аллотропные модификации
- 5. Учитывая положение углерода в Периодической системе, ответьте на вопросы: Каков химический знак углерода? Каков атомный номер
- 6. 1) С 2) 6, +6 3) Ar(C) = 12 4) 6 5) 12 – 6 =
- 7. Аллотропные модификации углерода Алмаз Графит Карбин Фуллерен Ограненный алмаз – бриллиант
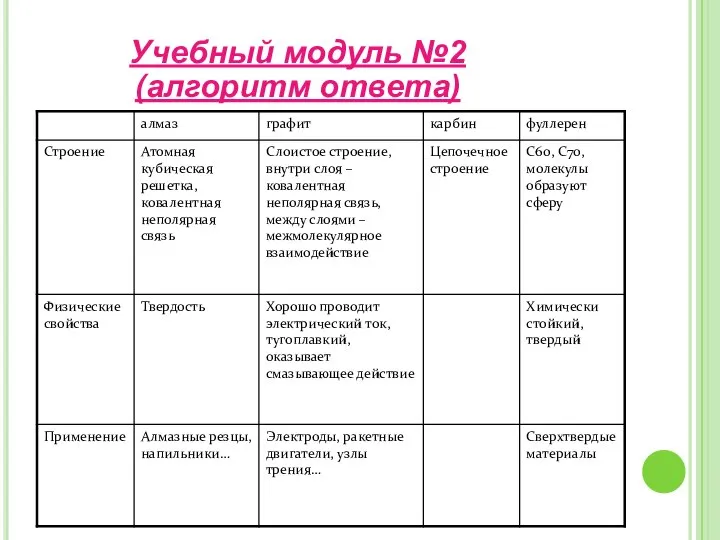
- 8. Изучите аллотропные модификации углерода (послушав докладчиков) и заполните таблицу: Важнейшие аллотропные модификации углерода. Учебный модуль №2
- 9. АЛМАЗ Бесцветный Прозрачный Не проводит электрический ток Прочный Твердый Алмаз имеет кубическую элементарную ячейку. В структуре
- 10. ГРАФИТ Темно-серый Непрозрачный Проводит электрический ток Мягкий Металлический блеск Оставляет след на бумаге Жирный на ощупь
- 11. Карбин представляет собой мелкокристаллический порошок чёрного цвета, обладает полупроводниковыми свойствами. Получен в искусственных условиях из длинных
- 12. Фуллере́ны— молекулярные соединения,представляющие собой выпуклые замкнутые многогранники, составленные из чётного числа трёхкоординированных атомов углерода. Используют для
- 13. Учебный модуль №2 (алгоритм ответа)
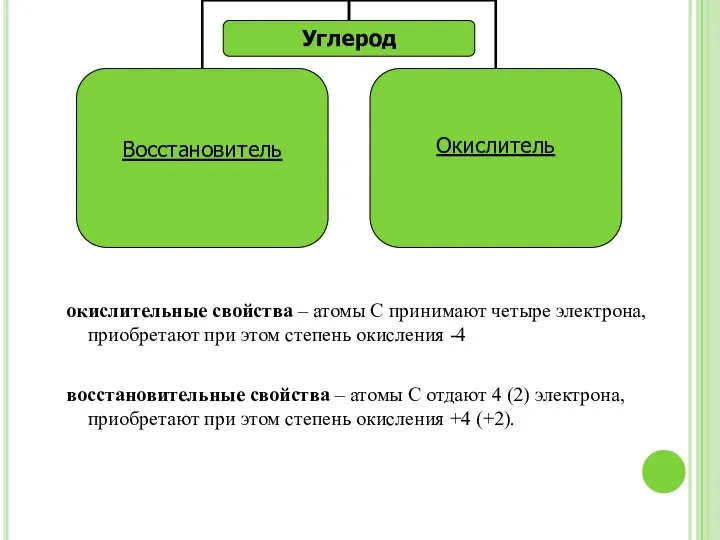
- 14. окислительные свойства – атомы С принимают четыре электрона, приобретают при этом степень окисления -4 восстановительные свойства
- 15. Окислительные свойства 1.При нагревании углерод соединяется с кислородом, образуя оксид углерода (IV), или углекислый газ: С
- 16. Восстановительные свойства 1. При нагревании с водяным паром он вытесняет из воды водород: Н2O + С
- 17. C + O2 = C + O2 = C + H2 = C + Ca =
- 18. 2C + O2 = 2СО C + O2 = СО2 C + 2H2 = СН4 2C
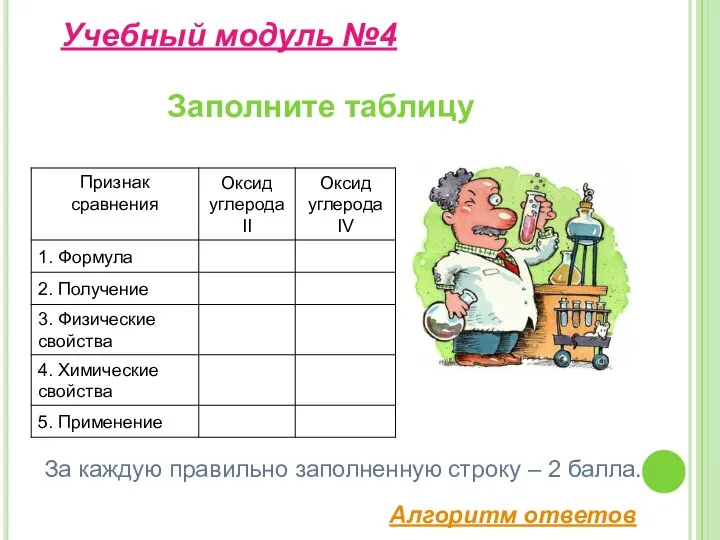
- 19. Заполните таблицу Учебный модуль №4 За каждую правильно заполненную строку – 2 балла. Алгоритм ответов
- 20. 2CO + O2 = 2CO2 + Q Fe2O3 + 3CO = 2Fe + 3CO2 CO +
- 21. CO2 + H2O = H2CO3 Na2O + CO2 = Na2CO3 Ca(OH)2 + CO2 = CaCO3 +
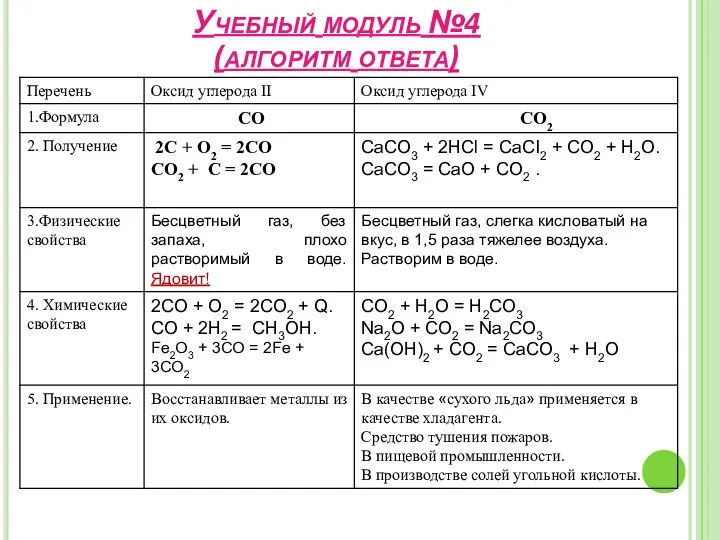
- 22. Учебный модуль №4 (алгоритм ответа)
- 23. Угольная кислота H2CO3 Угольная кислота́ — слабая двухосновная кислота. В чистом виде не выделена. Образуется в
- 25. Применение Угольная кислота всегда присутствует в водных растворах углекислого газа (газированная вода). Угольную кислоту мы в
- 26. Осуществите превращение Учебный модуль №5 За каждую правильную реакцию – 1 балл. С→СО→СО2 →Na2CO3→ NaHCO3→CO2 Алгоритм
- 27. Учебный модуль №5 (алгоритм ответа) 1. 2С + О2 = 2СО 2. 2CO + O2 =
- 28. Подведение итогов урока. Оцените свою работу на уроке (подсчитайте количество баллов, набранных за выполнение учебных модудей
- 30. Скачать презентацию























 Реакционная способность фенольных антиоксидантов при взаимодействии с пероксирадикалами
Реакционная способность фенольных антиоксидантов при взаимодействии с пероксирадикалами Химия
Химия Железо и его соединения
Железо и его соединения Физико-химические методы анализа
Физико-химические методы анализа Дисперсные системы в медицине и пищевой промышленности
Дисперсные системы в медицине и пищевой промышленности Выполнил: А. М. Галенко, учитель химии МОУ СОШ № 67 г. Волгограда
Выполнил: А. М. Галенко, учитель химии МОУ СОШ № 67 г. Волгограда  Хроматографические методы анализа. Метод газовой хроматографии
Хроматографические методы анализа. Метод газовой хроматографии Схема катаболизма углеродного скилета аминокислот
Схема катаболизма углеродного скилета аминокислот Коллоидты жүйелердің коагуляциялық және кристаллизациялық құрылымдары
Коллоидты жүйелердің коагуляциялық және кристаллизациялық құрылымдары Строение атома алюминия. Физические и химические свойства алюминия
Строение атома алюминия. Физические и химические свойства алюминия Цифровые лаборатории «Архимед» в изучении биологии и химии
Цифровые лаборатории «Архимед» в изучении биологии и химии Термодинамика. Химическая термодинамика
Термодинамика. Химическая термодинамика Химический состав продуктов питания
Химический состав продуктов питания Цинк и его сплавы. Антифрикционные сплавы, их маркировка и область применения. Олово, свинец и их свойства. (Тема 10)
Цинк и его сплавы. Антифрикционные сплавы, их маркировка и область применения. Олово, свинец и их свойства. (Тема 10) Решение задач в химии (ОГЭ, ЕГЭ, Олимпиады)
Решение задач в химии (ОГЭ, ЕГЭ, Олимпиады) Химические элементы O2 и N2
Химические элементы O2 и N2 Колообіг нітрогену Колообіг речовин — основна властивість, характерна риса біосфери.
Колообіг нітрогену Колообіг речовин — основна властивість, характерна риса біосфери.  Карбоновые кислоты
Карбоновые кислоты Сущность процесса электролитической диссоциации
Сущность процесса электролитической диссоциации 6 классов ферментов и тривиальные названия некоторых основных групп
6 классов ферментов и тривиальные названия некоторых основных групп Методы контроля и анализа веществ
Методы контроля и анализа веществ Интегрированный урок биологии и химии с применением информационных технологий
Интегрированный урок биологии и химии с применением информационных технологий Химический элемент алюминий
Химический элемент алюминий Дисперсные системы
Дисперсные системы Химия. Введение
Химия. Введение Кристаллы вокруг нас
Кристаллы вокруг нас Свойства нейтральных атомов. Лекция 4
Свойства нейтральных атомов. Лекция 4 Молекулы и атомы. Простые и сложные вещества
Молекулы и атомы. Простые и сложные вещества