Содержание
- 3. Алканы Алканы – это органические ациклические соединения, состоящие из атомов химических элементов углерода и водорода. С1
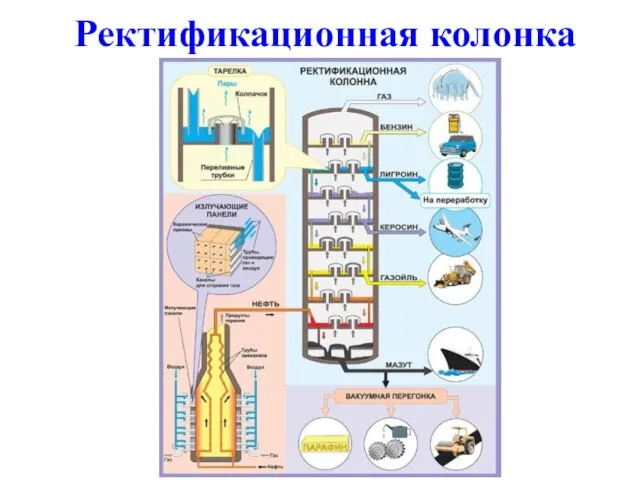
- 4. Ректификационная колонка
- 5. Гомологический ряд алканов.
- 6. Номенклатура ИЮПАК Правила при составлении названий алканов: В структурной формуле выбирают самую длинную цепь атомов углерода
- 7. Примечание Если в молекуле присутствует несколько одинаковых радикалов два, три. четыре и. т. д. (например –CH3),
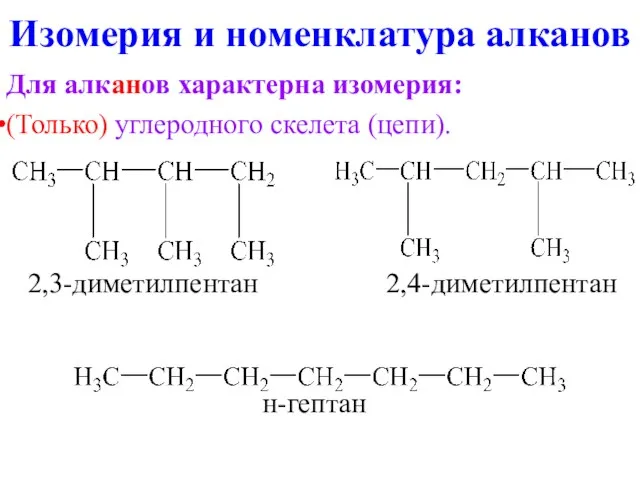
- 8. Изомерия и номенклатура алканов Для алканов характерна изомерия: (Только) углеродного скелета (цепи). 2,3-диметилпентан 2,4-диметилпентан н-гептан
- 9. Способы получения алканов 1) Крекинг нефтепродуктов: C16H34 → C8H18 + C8H16 2) Изомеризация: н-октан 2,2,4-триметилпентан 3)
- 10. 4) Декарбоксилирование натриевых солей карбоновых кислот (р-я Дюма): СН3СОONа + NаОН → СН4 + Nа2СO3 ацетат
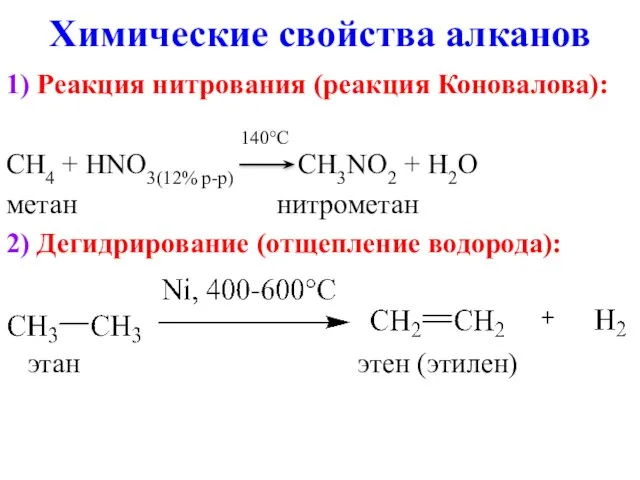
- 11. Химические свойства алканов 1) Реакция нитрования (реакция Коновалова): 140°C CH4 + HNO3(12% р-р) CH3NO2 + H2O
- 12. Химические свойства алканов 3) Галогенирование (Cl2, Br2) на свету: hv CH4 + Cl2 → CH3Cl +
- 13. 4) Горение (полное окисление): t°C C2H6 + 7O2 → 4СO2↑ + 6H2O + Q кДж При
- 14. 6) Изомеризация: н-пентан 2,2-диметилпропан 7) Ароматизация: н-гексан бензол Химические свойства алканов
- 16. Скачать презентацию










 Гидрокрекинг нефтяного сырья
Гидрокрекинг нефтяного сырья Презентация Алкины Ацетилен
Презентация Алкины Ацетилен Застосування вуглеводів. Їх біологічна роль
Застосування вуглеводів. Їх біологічна роль Аммиак NH3
Аммиак NH3 Лаборатория мирового уровня в области термического анализа и физико-химии процессов тепловых методов добычи
Лаборатория мирового уровня в области термического анализа и физико-химии процессов тепловых методов добычи Классическая теория гармонического кристалла. Гармоническое приближение. Адиабатическое приближение
Классическая теория гармонического кристалла. Гармоническое приближение. Адиабатическое приближение Великий Ломоносов Работу выполнила учитель химии МБОУ «СОШ №27 с углубленным изучением отдельных предметов» Карташова Л.А.
Великий Ломоносов Работу выполнила учитель химии МБОУ «СОШ №27 с углубленным изучением отдельных предметов» Карташова Л.А. Вакуумная перегонка мазута
Вакуумная перегонка мазута Подгруппа селена
Подгруппа селена Электрические свойства дисперсных систем. (Лекция 5)
Электрические свойства дисперсных систем. (Лекция 5) Автомобильные бензины и дизельное топливо
Автомобильные бензины и дизельное топливо Обобщающее повторение по теме Неметаллы. Урок №7
Обобщающее повторение по теме Неметаллы. Урок №7 Полярография және оның фармацияда қолданылуы
Полярография және оның фармацияда қолданылуы Эмульсиялардың тұрақтылығына полиэтиленгликоль-баз композицияларының әсері
Эмульсиялардың тұрақтылығына полиэтиленгликоль-баз композицияларының әсері Полімери
Полімери  Тест- тренажер по теме: Основные классы неорганических веществ «Оксиды»
Тест- тренажер по теме: Основные классы неорганических веществ «Оксиды» Периодическая Система Д. И. Менделеева в свете учения о строении атома
Периодическая Система Д. И. Менделеева в свете учения о строении атома Счастливы вместе с химией
Счастливы вместе с химией Тема урока: Сложные эфиры.
Тема урока: Сложные эфиры. Применение s-, p-, d- элементов в медицине
Применение s-, p-, d- элементов в медицине Валентність
Валентність  Реологические свойства полимерных материалов
Реологические свойства полимерных материалов Кислородосодержащие органические соединения (2 часть) Муравьева Н.А. – учитель химии МОУ «Арбузовская сош»
Кислородосодержащие органические соединения (2 часть) Муравьева Н.А. – учитель химии МОУ «Арбузовская сош»  «Химия и цвет» Интегрированный урок по изобразительному искусству и химии Запольская О.А. Учитель МКОУ СОШ №1 п.Сосьва
«Химия и цвет» Интегрированный урок по изобразительному искусству и химии Запольская О.А. Учитель МКОУ СОШ №1 п.Сосьва Микрофлора и биохимические реакции подземных вод
Микрофлора и биохимические реакции подземных вод Номенклатура органических соединений
Номенклатура органических соединений Силікон Корєшкова А. В. 11-М
Силікон Корєшкова А. В. 11-М  Становление органической химии как отдельной науки. (Модуль 1)
Становление органической химии как отдельной науки. (Модуль 1)