Содержание
- 2. Функции углеводов: структурная (целлюлоза в растениях, хитин в грибах); энергетическая (крахмал в растениях, гликоген в животных
- 3. Углеводы составляют до 80% сухого вещества массы растений и 2% сухого вещества массы животных, на долю
- 4. В общем виде полигидроксиальдегиды и полигидроксикетоны можно представить следующим образом: Название «углеводы» эти соединения получили потому,
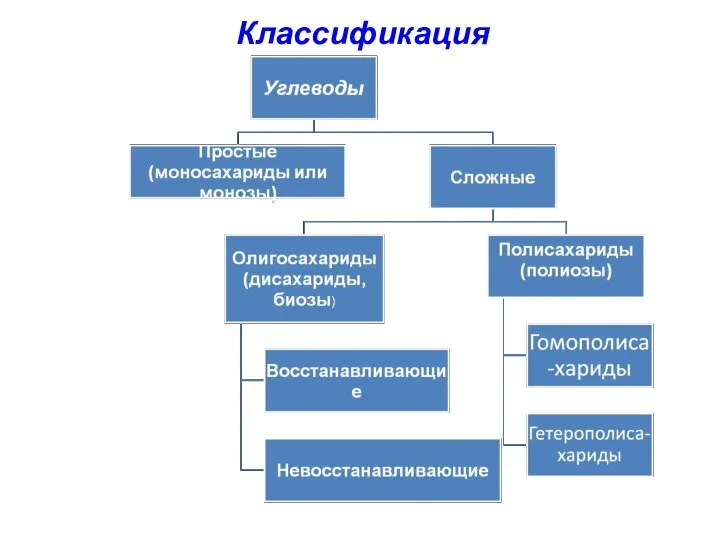
- 5. Классификация
- 6. Простые углеводы (моносахариды или монозы, гликозы) - - полигидроксиальдегиды или полигидроксикетоны, которые не гидролизуются до более
- 7. Моносахариды (монозы, гликозы или МС) В зависимости от количества атомов углерода в молекуле делят на триозы,
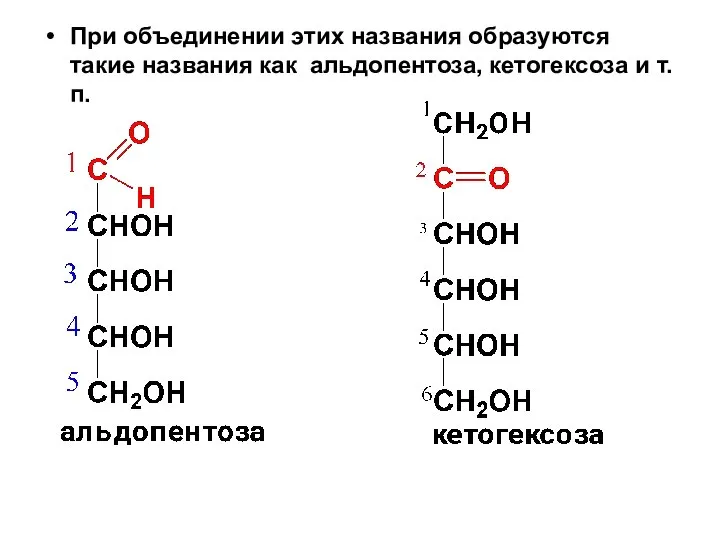
- 9. При объединении этих названия образуются такие названия как альдопентоза, кетогексоза и т.п.
- 10. По химической природе моносахариды делят на: А) Нейтральные сахара, содержащие только карбонильную (альдегидную или кетонную) группу
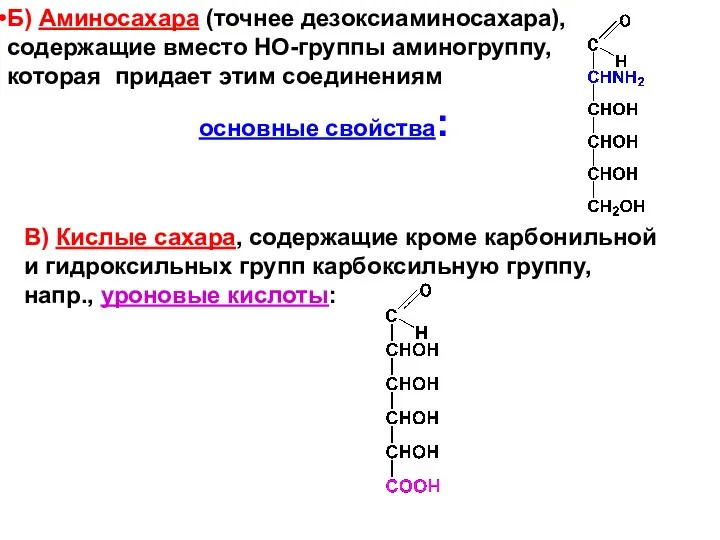
- 11. Б) Аминосахара (точнее дезоксиаминосахара), содержащие вместо НО-группы аминогруппу, которая придает этим соединениям основные свойства: В) Кислые
- 12. Наиболее распространены в природе нейтральные простые сахара – моносахариды. Моносахариды, которые содержат 7 и более С-атомов
- 13. Номенклатура Как следует из структурных формул моносахаридов, они содержат асимметрические атомы углерода и потому существуют в
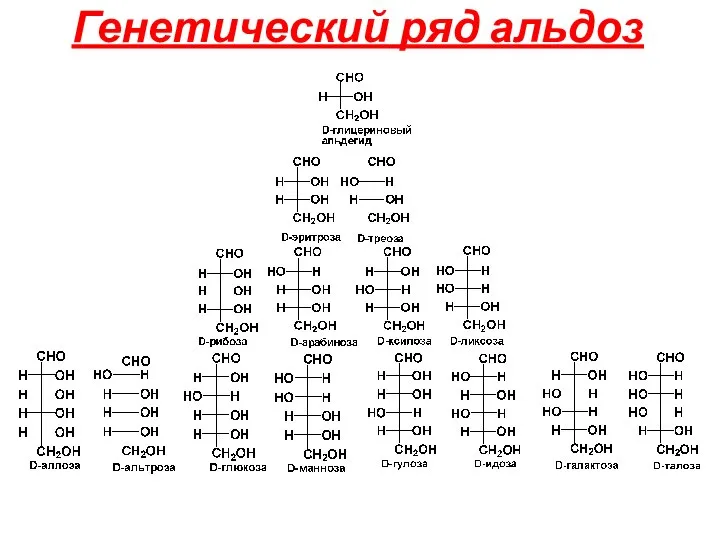
- 14. Генетический ряд альдоз
- 15. Названия кетоз образуют из названий соответствующих альдоз, заменяя суффикс «оза» на «улоза». Исключение составляет, например, название
- 16. От тривиальных названий альдоз образуют названия дезоксисахаров, аминосахаров, карбоксилсодержащих сахаров, некоторых многоатомных спиртов и других производных.
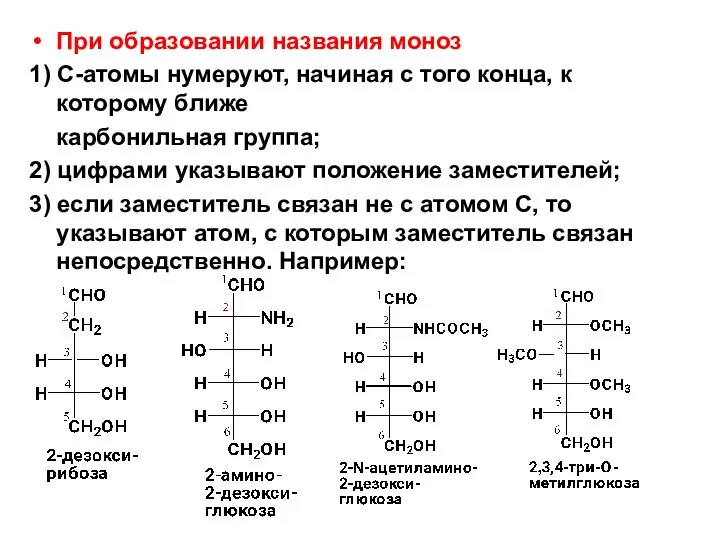
- 17. При образовании названия моноз 1) С-атомы нумеруют, начиная с того конца, к которому ближе карбонильная группа;
- 18. Названия кислых сахаров (группа В) образуют следующим образом: производные моносахаридов, содержащие СООН-группу в 1-ом положении называют
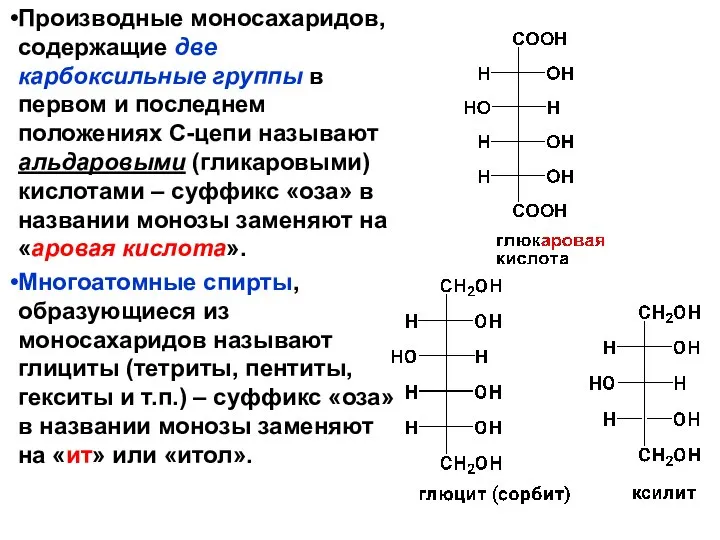
- 19. Производные моносахаридов, содержащие две карбоксильные группы в первом и последнем положениях С-цепи называют альдаровыми (гликаровыми) кислотами
- 20. Химическое строение Моносахариды по химической природе являются полигидроксиальдегидами, либо полигидроксикетонами.
- 21. Большинство моносахаридов имеют неразветвленную цепь С-атомов, Иногда пентозы и гексозы с разветвленным С-скелетом. Напр., апиоза –
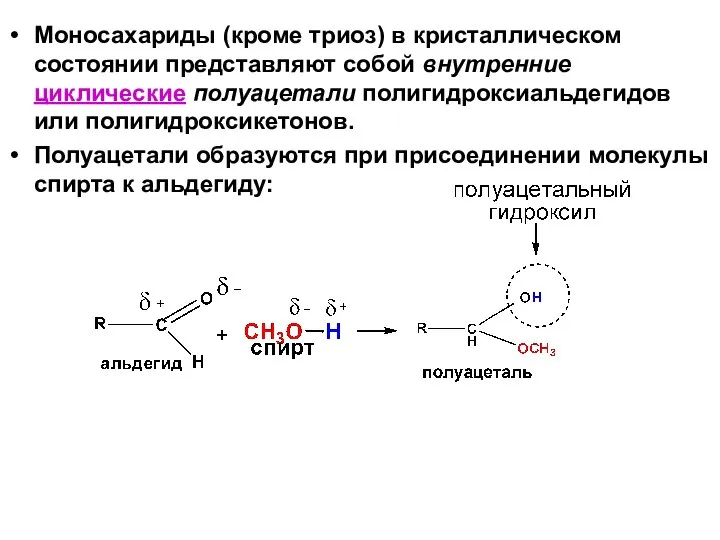
- 22. Моносахариды (кроме триоз) в кристаллическом состоянии представляют собой внутренние циклические полуацетали полигидроксиальдегидов или полигидроксикетонов. Полуацетали образуются
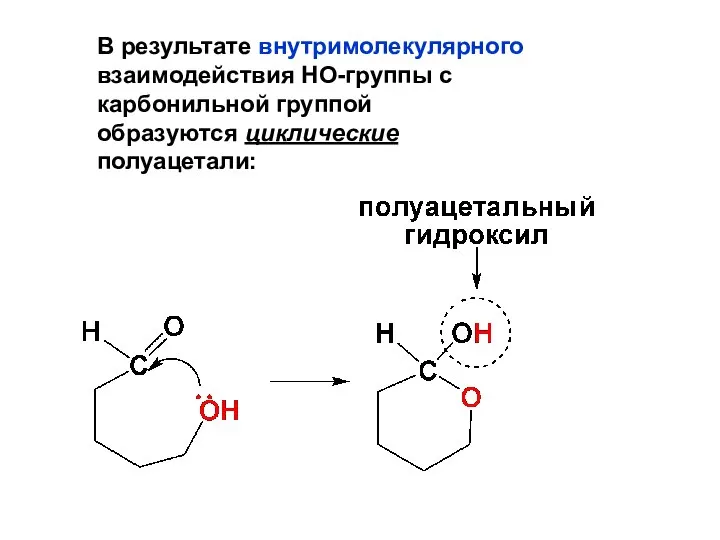
- 23. В результате внутримолекулярного взаимодействия НО-группы с карбонильной группой образуются циклические полуацетали:
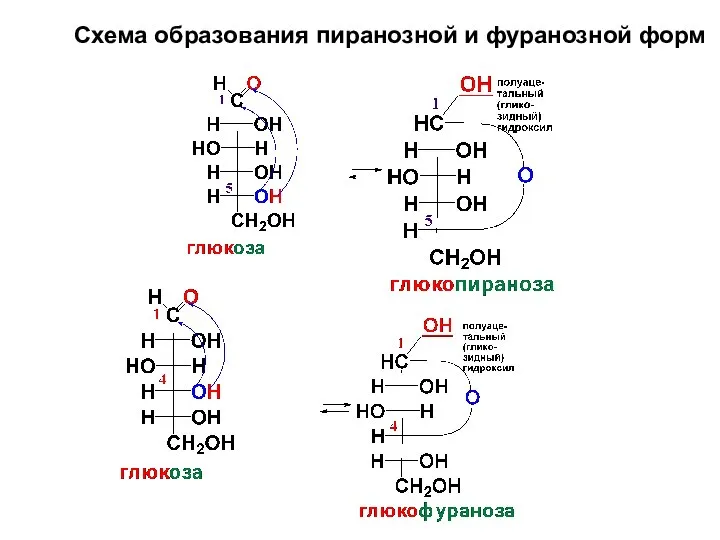
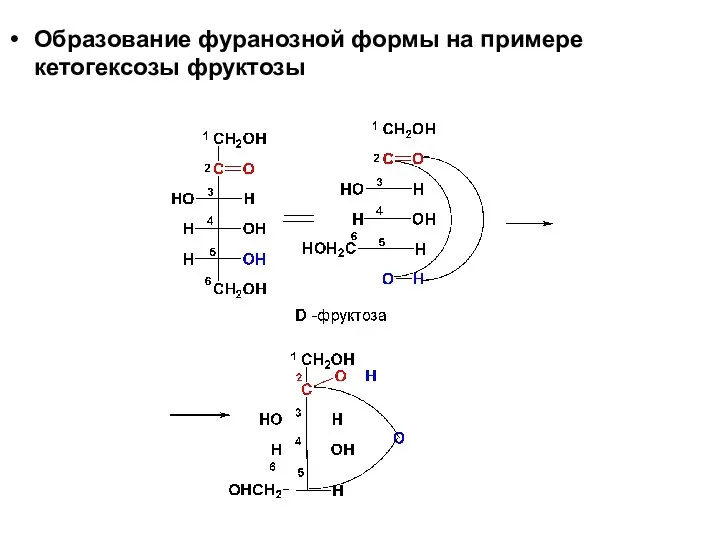
- 24. Циклические формы альдогексоз образуются в результате внутримолекулярного взаимодействия альдегидной группы с НО-группой у С5 или С4
- 25. Схема образования пиранозной и фуранозной форм
- 26. Образование фуранозной формы на примере кетогексозы фруктозы
- 27. Анализ строения циклических форм Образование циклической формы вызывает появление дополнительного асимметрического атома С и ещё одной
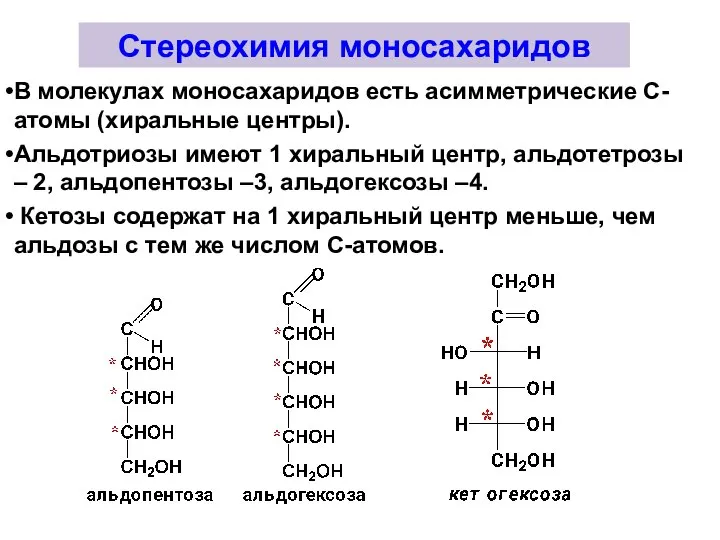
- 28. Стереохимия моносахаридов В молекулах моносахаридов есть асимметрические С-атомы (хиральные центры). Альдотриозы имеют 1 хиральный центр, альдотетрозы
- 29. Для изображения стереоизомеров пользуются формулами Фишера. С-цепь моносахарида изображают вертикальной линией с оксогруппой расположенной в верхней
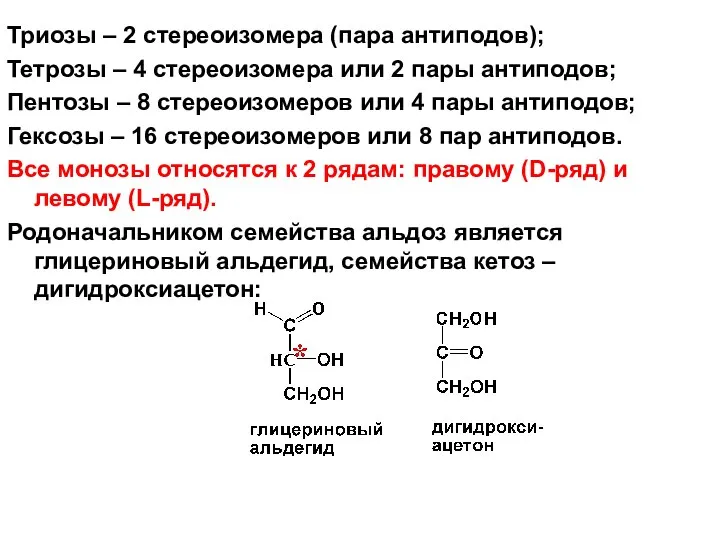
- 30. Триозы – 2 стереоизомера (пара антиподов); Тетрозы – 4 стереоизомера или 2 пары антиподов; Пентозы –
- 31. Для всех альдоз установлены относительные конфигурации, т.е. пространственное расположение заместителей у асимметрических атомов. Их конфигурации определены
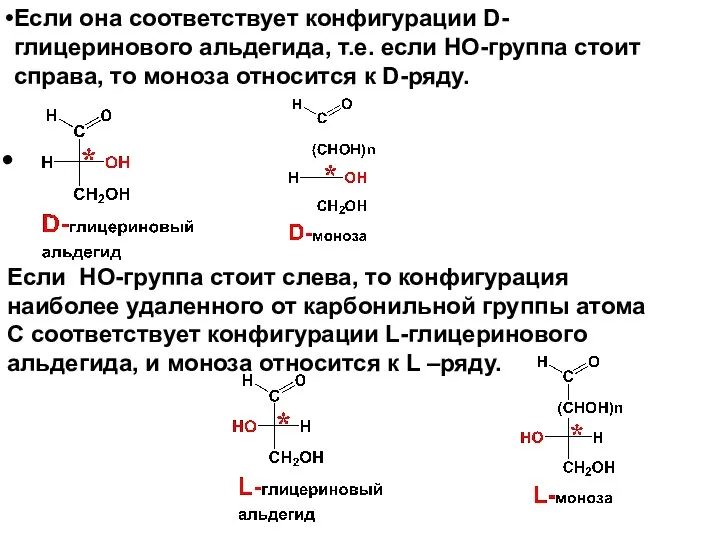
- 32. Если она соответствует конфигурации D-глицеринового альдегида, т.е. если НО-группа стоит справа, то моноза относится к D-ряду.
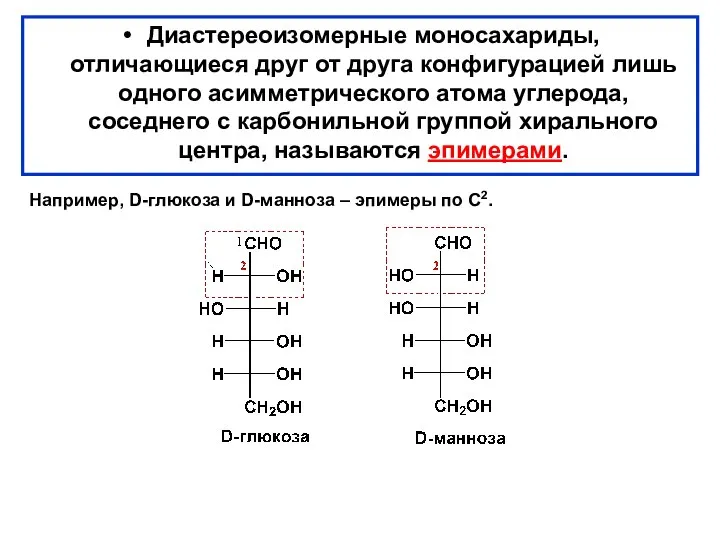
- 33. Диастереоизомерные моносахариды, отличающиеся друг от друга конфигурацией лишь одного асимметрического атома углерода, соседнего с карбонильной группой
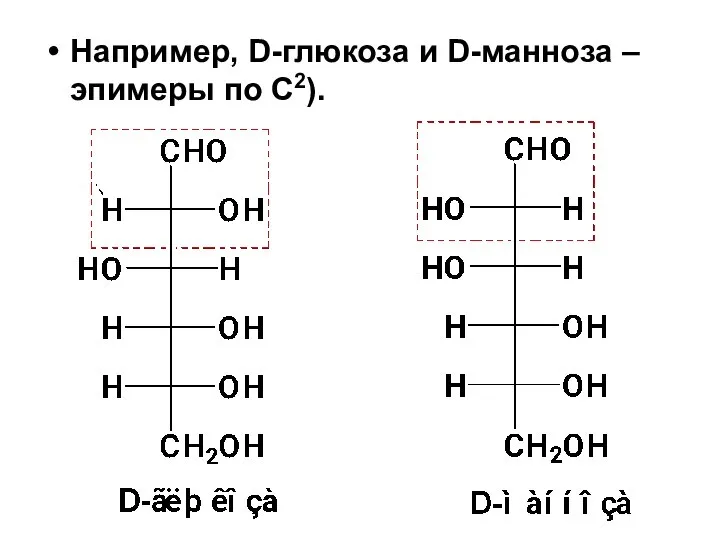
- 34. Например, D-глюкоза и D-манноза – эпимеры по С2).
- 35. Стереохимия цииклических форм В циклических формах моносахаридов независимо от размера кольца (фуранозное или пиранозное) С-атом карбонильной
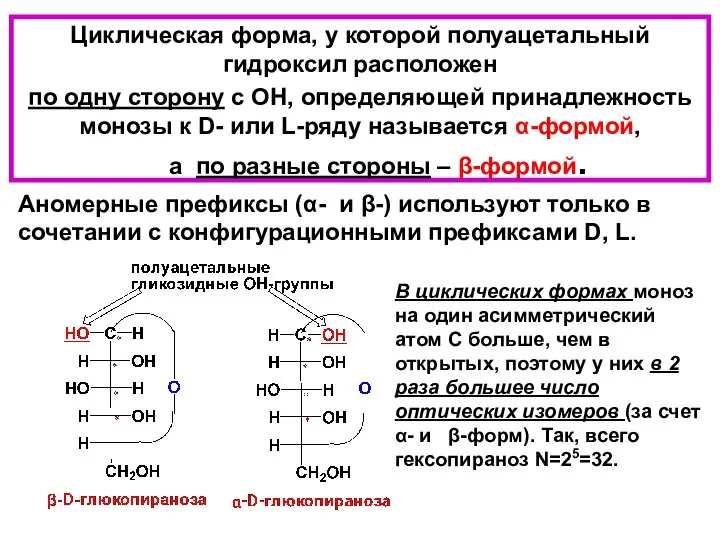
- 36. Циклическая форма, у которой полуацетальный гидроксил расположен по одну сторону с ОН, определяющей принадлежность монозы к
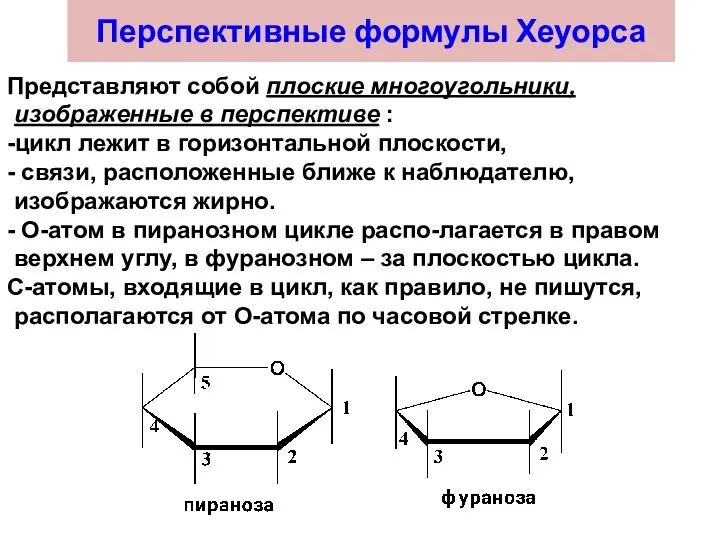
- 37. Перспективные формулы Хеуорса Представляют собой плоские многоугольники, изображенные в перспективе : -цикл лежит в горизонтальной плоскости,
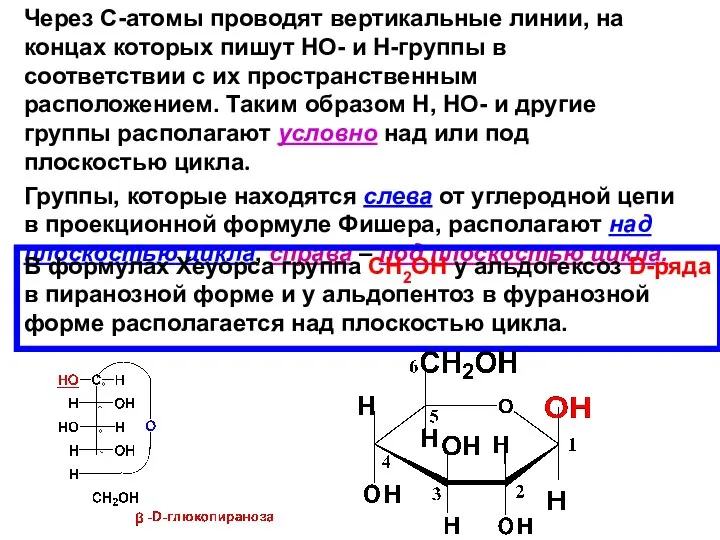
- 38. Через С-атомы проводят вертикальные линии, на концах которых пишут НО- и Н-группы в соответствии с их
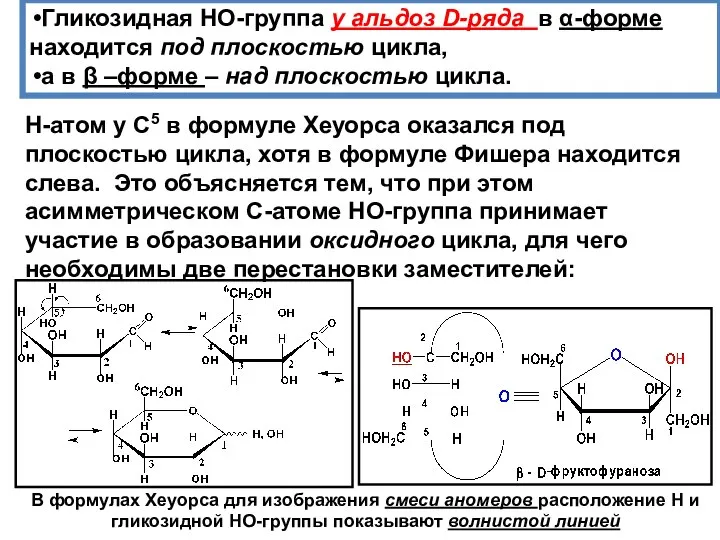
- 39. Гликозидная НО-группа у альдоз D-ряда в α-форме находится под плоскостью цикла, а в β –форме –
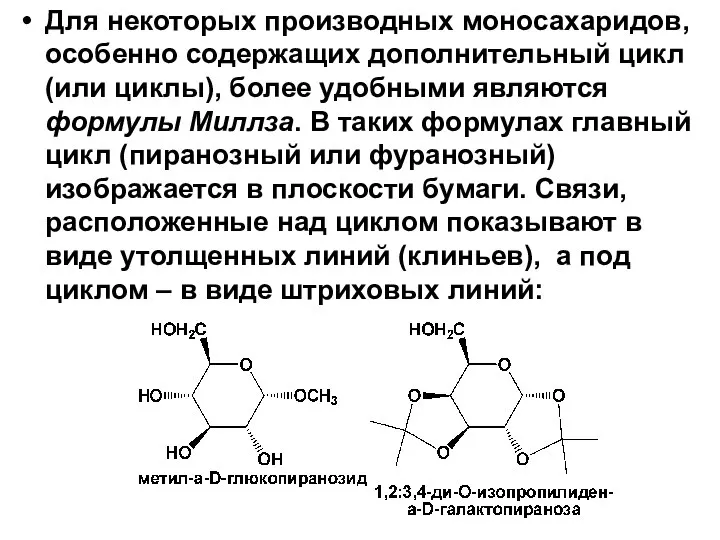
- 40. Для некоторых производных моносахаридов, особенно содержащих дополнительный цикл (или циклы), более удобными являются формулы Миллза. В
- 41. Конформационная изомерия Формулы Хеуорса и Миллза предполагают плоское строение кольца. На самом деле циклические пяти- и
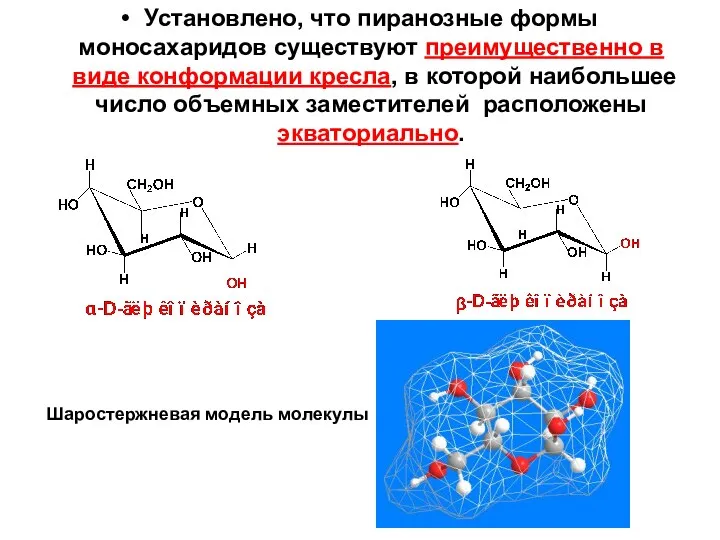
- 42. Установлено, что пиранозные формы моносахаридов существуют преимущественно в виде конформации кресла, в которой наибольшее число объемных
- 43. У α-аномеров полуацетальный ОН располагается в аксиальном положении, а у β-аномеров – в экваториальном. У β-аномера
- 44. Конформации фуранозных форм моносахаридов изучены в меньшей степени. Полагают, что возможны 2 типа конформаций – конверт
- 45. Физические свойства Моноcахариды (МС) представляют собой твердые кристаллические вещества, сладкие на вкус, гигроскопичны, хорошо растворимы в
- 46. Химические свойства Таутомерия. Мутаротация В кристаллическом состоянии МС находятся в циклической форме (α-или β) в зависимости
- 48. Как правило, циклические формы МС в растворах преобладают над открытой оксоформой, причем одна из циклических форм
- 49. Свежеприготовленный раствор α-аномера D-глюкозы имеет удельное вращение +112о. При стоянии раствора эта величина постепенно снижается и
- 50. МС в соответствии со строением могут проявлять как свойства карбонильных соединений, так и свойства спиртов и
- 51. I.Реакции по оксоформе 1.Восстановление НI. Эта реакция доказывает линейное строение глюкозы
- 52. II.Реакции по карбонильной группе Для МС характерны не все реакции по карбонильной группе, т.к. содержание открытой
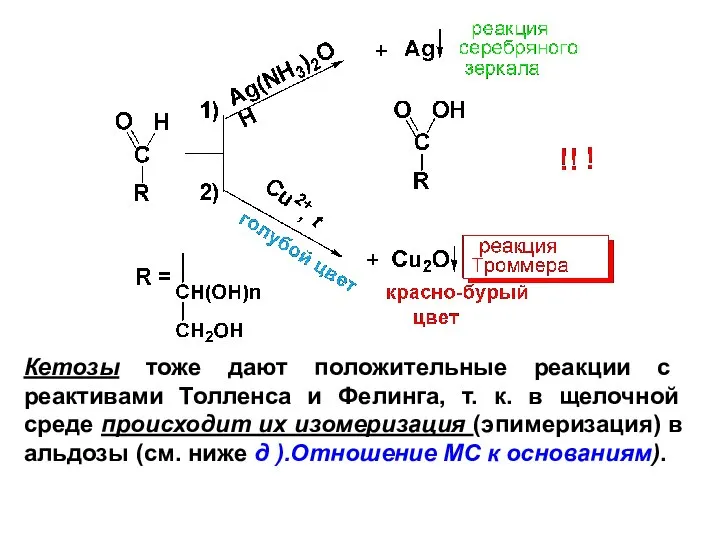
- 53. б). Окисление Мягкие окислители: 1) реактив Толленса – аммиачный раствор оксида серебра; 2) проба Троммера –
- 54. Кетозы тоже дают положительные реакции с реактивами Толленса и Фелинга, т. к. в щелочной среде происходит
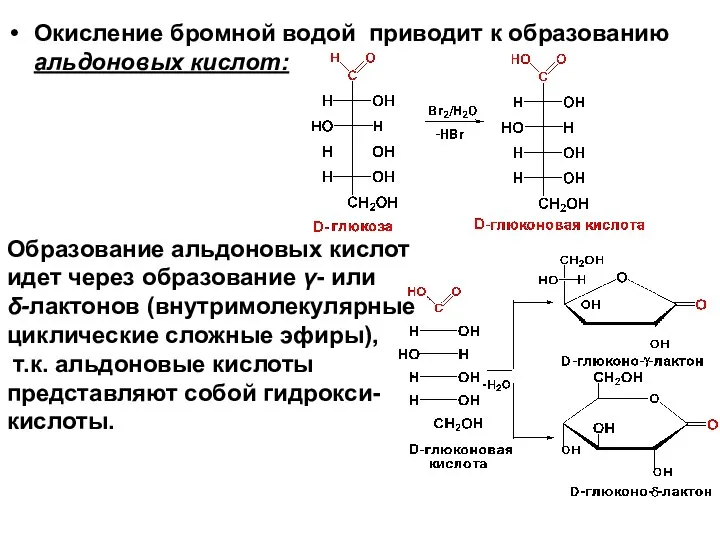
- 55. Окисление бромной водой приводит к образованию альдоновых кислот: Образование альдоновых кислот идет через образование γ- или
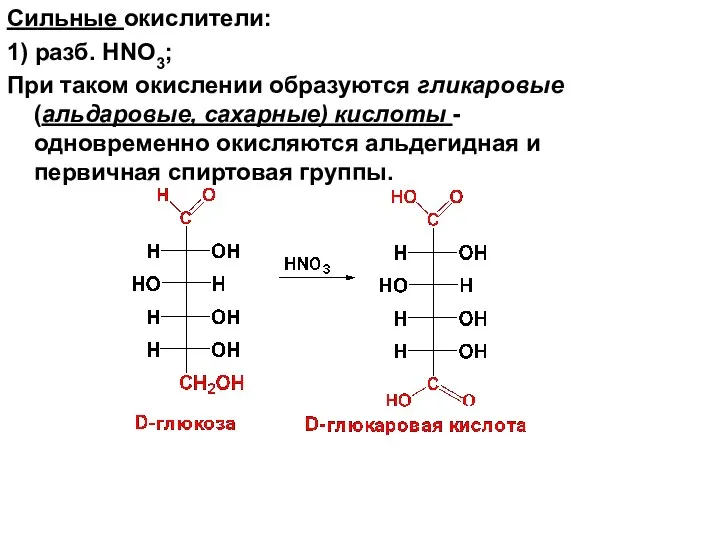
- 56. Сильные окислители: 1) разб. HNO3; При таком окислении образуются гликаровые (альдаровые, сахарные) кислоты - одновременно окисляются
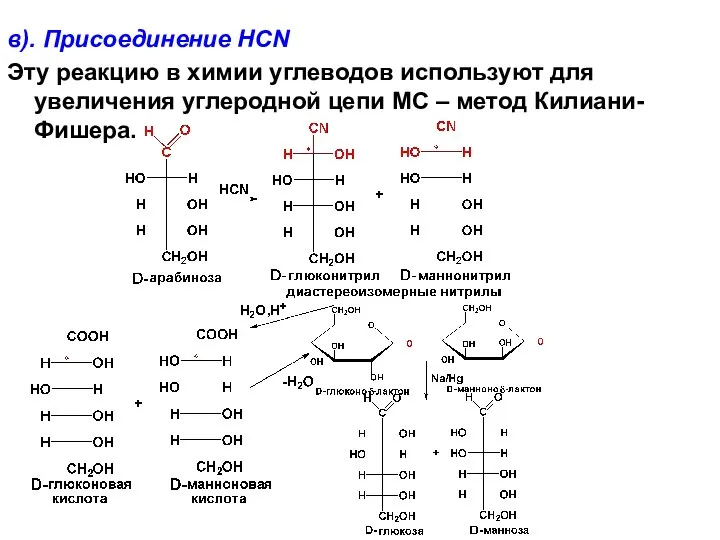
- 57. в). Присоединение HCN Эту реакцию в химии углеводов используют для увеличения углеродной цепи МС – метод
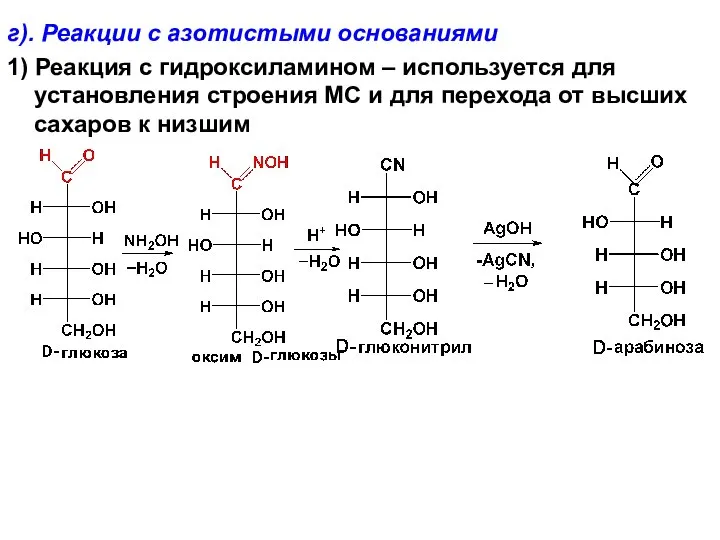
- 58. г). Реакции с азотистыми основаниями 1) Реакция с гидроксиламином – используется для установления строения МС и
- 59. 2) Реакция с фенилгидразином В мягких условиях МС образуют с фенилгидразином фенилгидразоны. При нагревании МС с
- 60. 3) Реакция с о-толуидиновым реагентом (ОТР) При взаимодействии МС с ОТР образуются окрашенные основания Шиффа (альдимины),
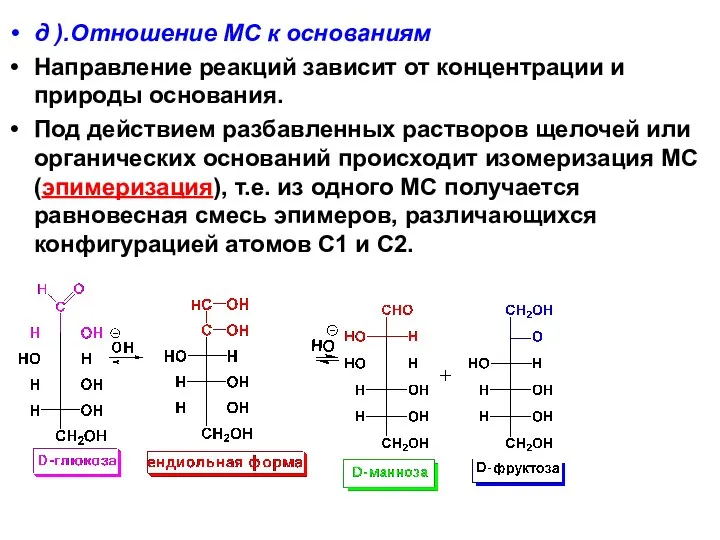
- 61. д ).Отношение МС к основаниям Направление реакций зависит от концентрации и природы основания. Под действием разбавленных
- 62. Действие концентрированных щелочей приводит к глубоким превращениям МС – происходит их разложение с образованием смеси продуктов
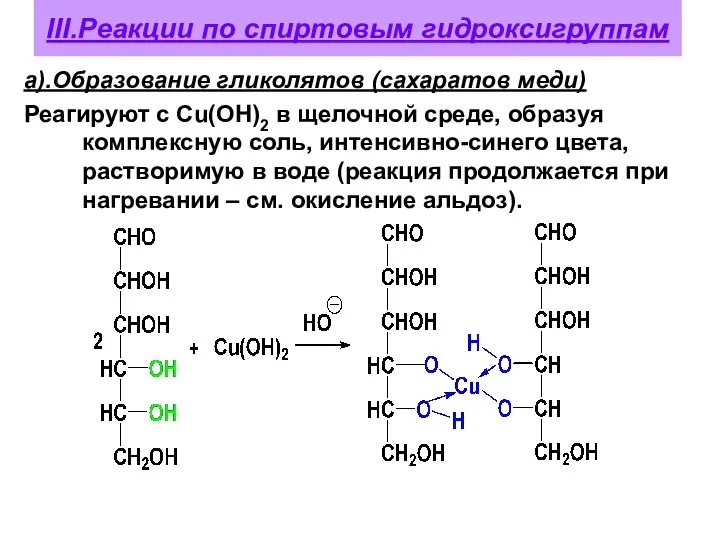
- 63. III.Реакции по спиртовым гидроксигруппам а).Образование гликолятов (сахаратов меди) Реагируют с Сu(OH)2 в щелочной среде, образуя комплексную
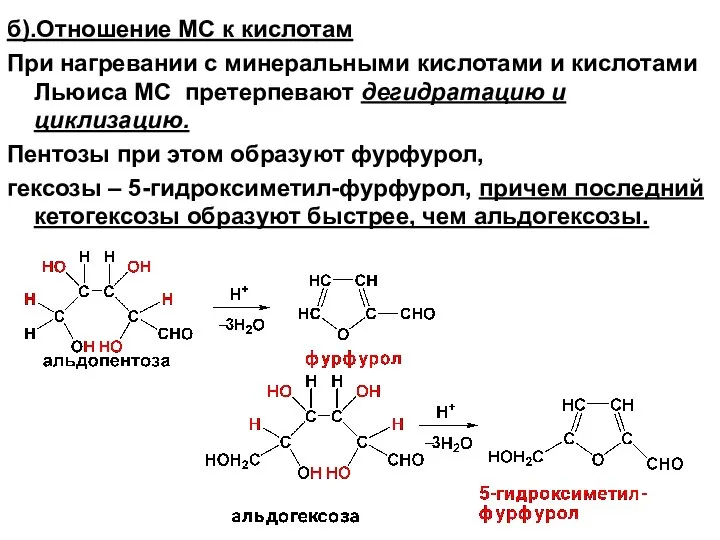
- 64. б).Отношение МС к кислотам При нагревании с минеральными кислотами и кислотами Льюиса МС претерпевают дегидратацию и
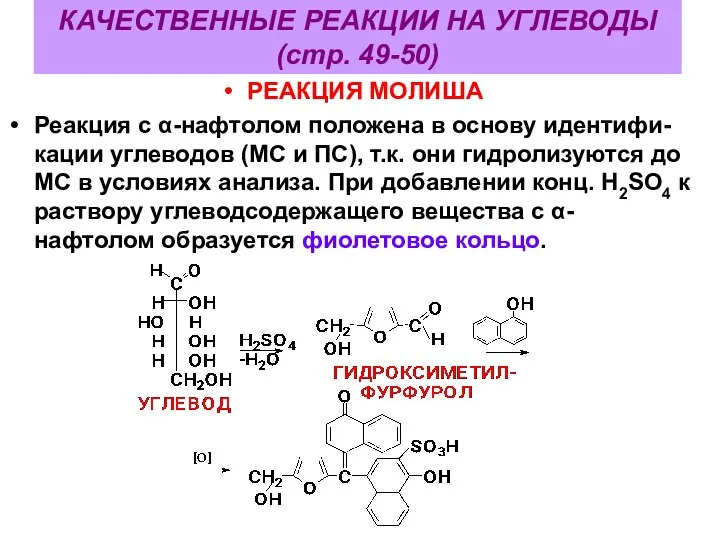
- 65. КАЧЕСТВЕННЫЕ РЕАКЦИИ НА УГЛЕВОДЫ (стр. 49-50) РЕАКЦИЯ МОЛИША Реакция с α-нафтолом положена в основу идентифи-кации углеводов
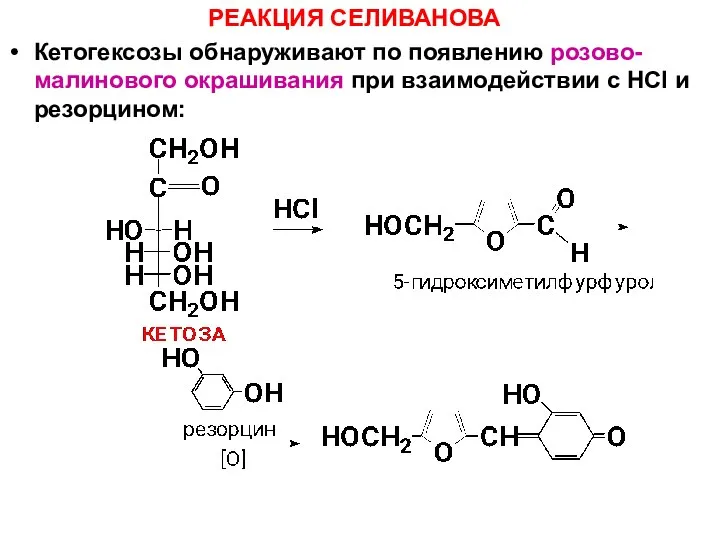
- 66. РЕАКЦИЯ СЕЛИВАНОВА Кетогексозы обнаруживают по появлению розово-малинового окрашивания при взаимодействии с HСl и резорцином:
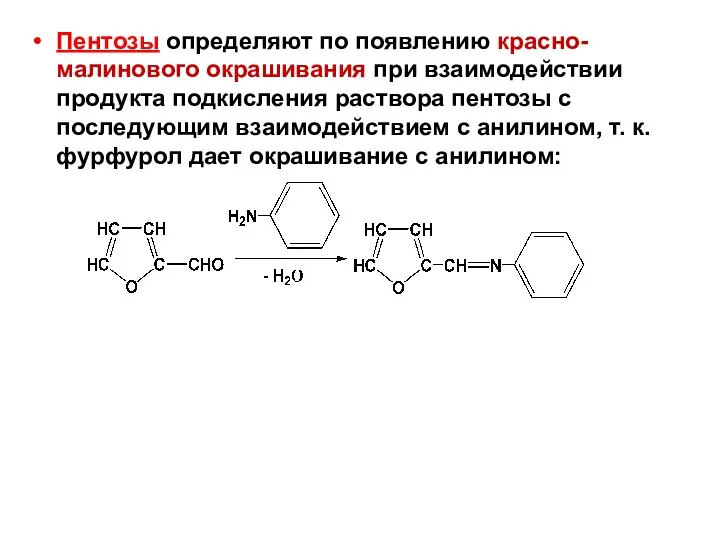
- 67. Пентозы определяют по появлению красно-малинового окрашивания при взаимодействии продукта подкисления раствора пентозы с последующим взаимодействием с
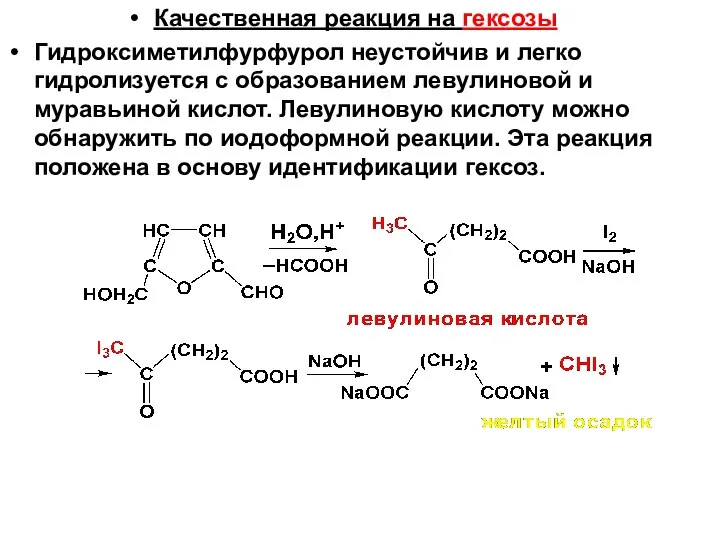
- 68. Качественная реакция на гексозы Гидроксиметилфурфурол неустойчив и легко гидролизуется с образованием левулиновой и муравьиной кислот. Левулиновую
- 69. IV. Брожение МС Брожение это сложный процесс расщепления МС под действием ферментов. Брожению подвергаются МС, у
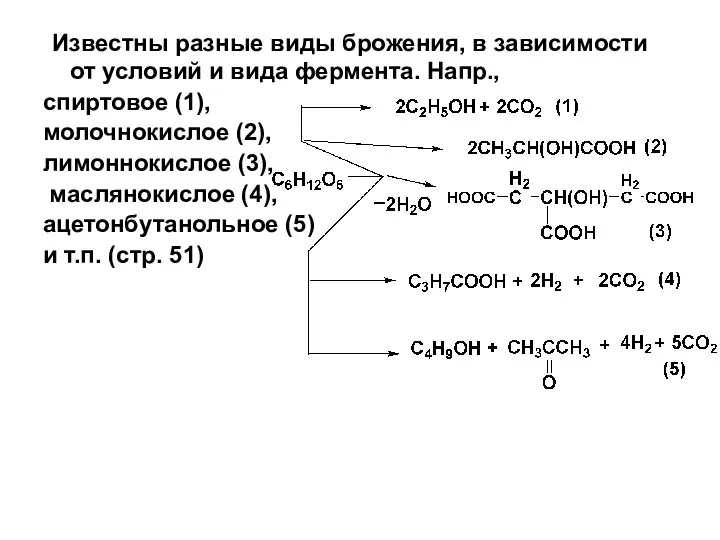
- 70. Известны разные виды брожения, в зависимости от условий и вида фермента. Напр., спиртовое (1), молочнокислое (2),
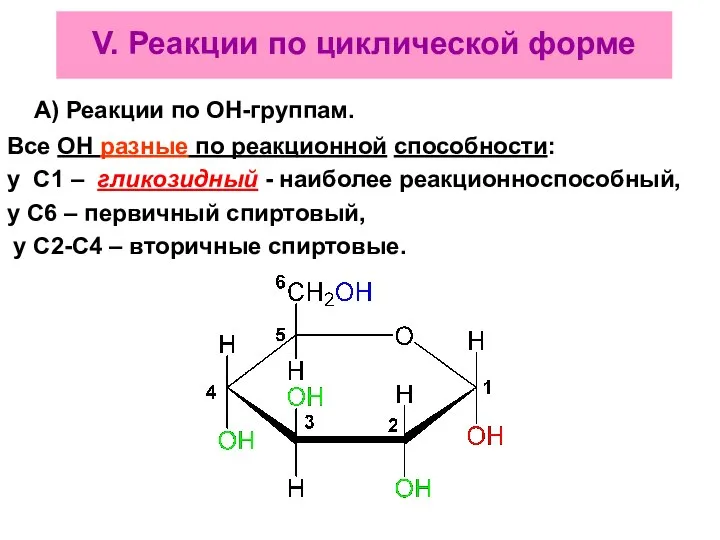
- 71. V. Реакции по циклической форме А) Реакции по ОН-группам. Все ОН разные по реакционной способности: у
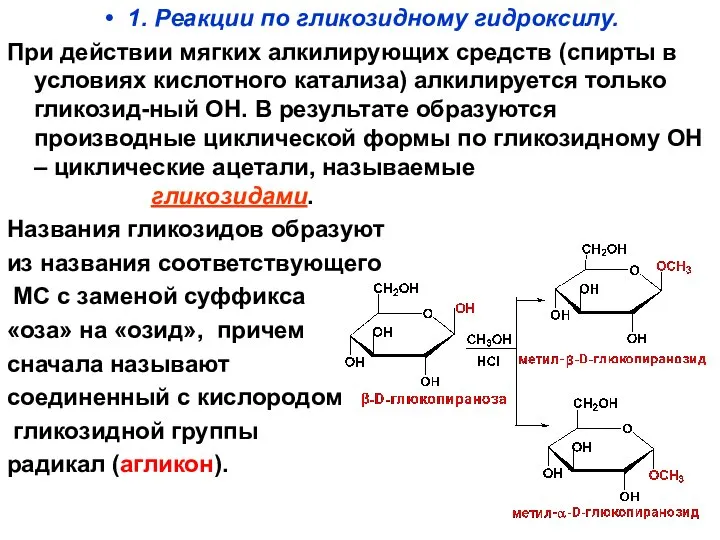
- 72. 1. Реакции по гликозидному гидроксилу. При действии мягких алкилирующих средств (спирты в условиях кислотного катализа) алкилируется
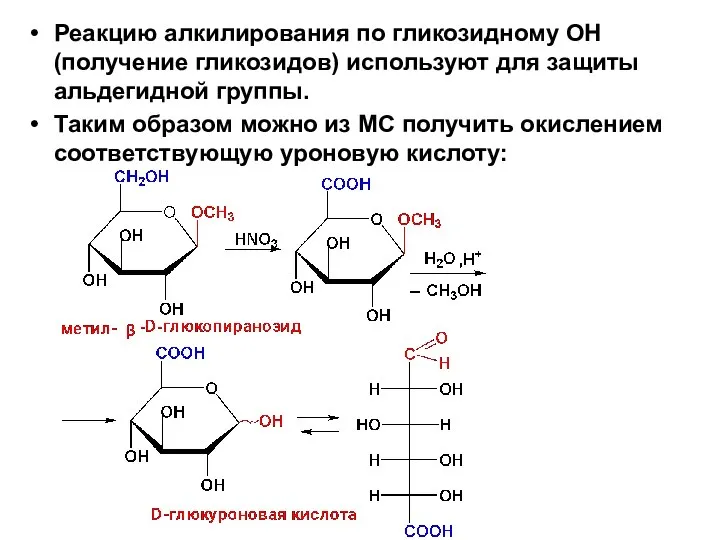
- 73. Реакцию алкилирования по гликозидному ОН (получение гликозидов) используют для защиты альдегидной группы. Таким образом можно из
- 74. Свойства гликозидов Поскольку в гликозидах отсутствует полуацетальный (гликозидный) ОН, то они существуют только в циклической форме.
- 75. Гидролиз гликозидов ( по механизму SN1) Гликозиды подвергаются также ферментативному гидролизу. Причем можно подобрать специфические ферменты,
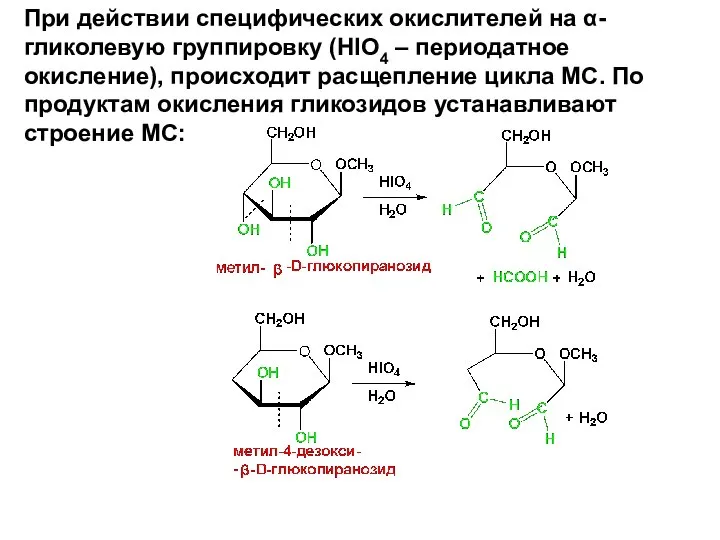
- 76. При действии специфических окислителей на α-гликолевую группировку (HIO4 – периодатное окисление), происходит расщепление цикла МС. По
- 77. 2. Реакции с участием всех гидроксильных групп 2.1.Образование солей При действии на моносахариды алкоголятов некоторых металлов
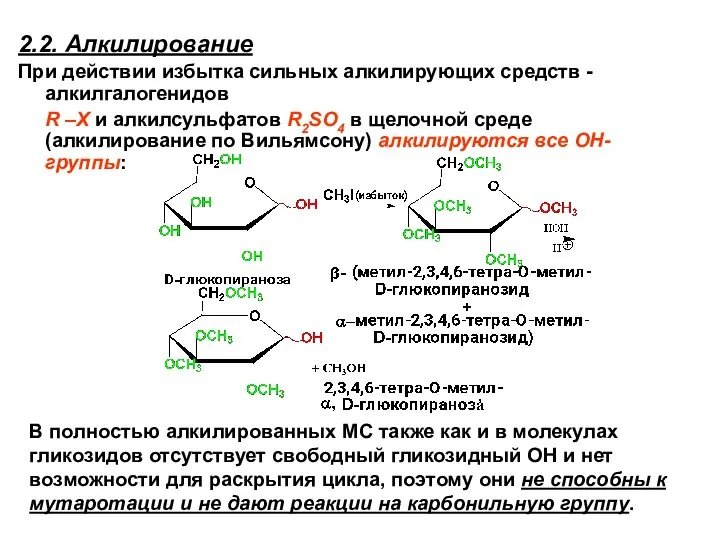
- 78. 2.2. Алкилирование При действии избытка сильных алкилирующих средств - алкилгалогенидов R –Х и алкилсульфатов R2SO4 в
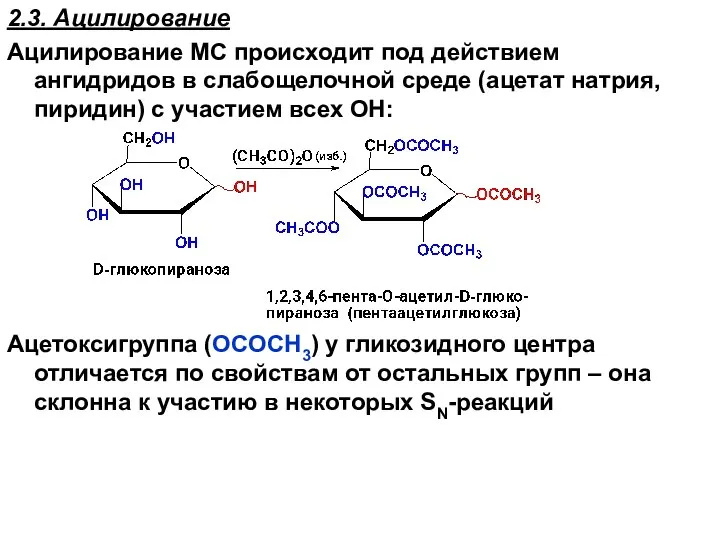
- 79. 2.3. Ацилирование Ацилирование МС происходит под действием ангидридов в слабощелочной среде (ацетат натрия, пиридин) с участием
- 80. Важнейшие представители Триозы D-,L-глицериновые альдегиды, и 1,3-дигидроксиацетон. Их эфиры с фосфорной кислотой играют важную роль в
- 81. D-Ryb играет значительную биологическую роль. Она встречается в природе как составная часть рибонуклеиновых кислот, некоторых витаминов,
- 82. Гексозы В природе распространены только 4 из 16 стереоизомерных альдогексоз: D-Glc, D-Man, D-Gal, D-Tal. D-Glc виноградный
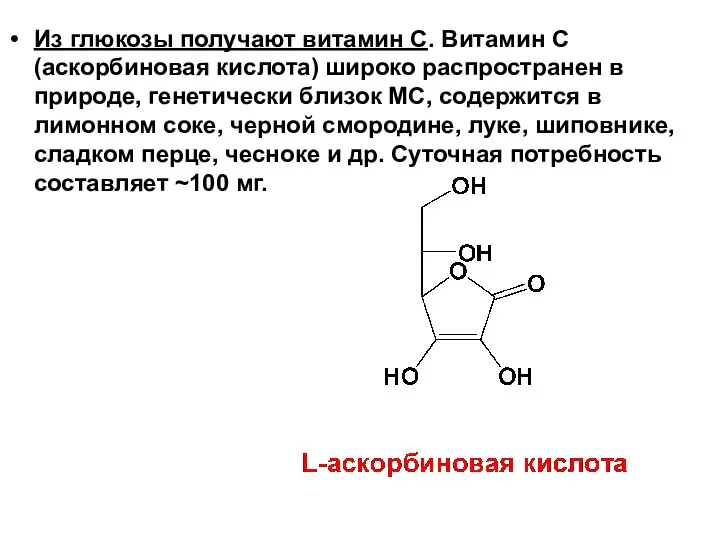
- 83. Из глюкозы получают витамин С. Витамин С (аскорбиновая кислота) широко распространен в природе, генетически близок МС,
- 84. D-Gal входит в состав некоторых ПС и гликозидов. Остатки галактозы входят в состав сложнейших биополимеров ганглиозидов.
- 85. Дезокси- аминосахара. 2-дезокси-D-Ryb входит в состав нуклеотидов. L-рамноза (6-дезокси-L-манноза) является структурным фрагментом природных гликозидов. L-фукоза (6-дезокси-L-галактоза)
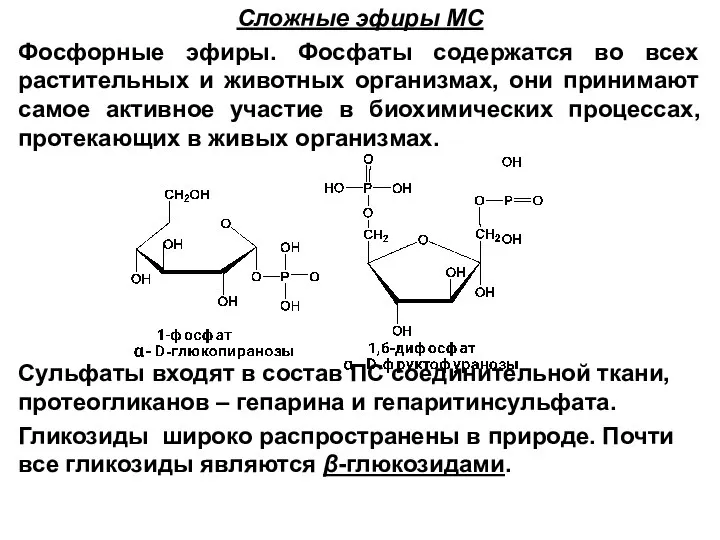
- 86. Сложные эфиры МС Фосфорные эфиры. Фосфаты содержатся во всех растительных и животных организмах, они принимают самое
- 87. В природных гликозидах в качестве агликона встречаются многие радикалы, часто весьма сложные. Причем многие гликозиды обладают
- 88. Гликозиды классифицируются по агликоновой компоненте. О-гликозиды – кониферин и сирингин являются предшественниками одного из полимерных компонентов
- 90. Скачать презентацию













































 Фенолы Простые эфиры
Фенолы Простые эфиры Лужні метали Властивості, будова, застосування.
Лужні метали Властивості, будова, застосування.  Любовь с точки зрения лаборантов
Любовь с точки зрения лаборантов Презентация по Химии "Озоновый слой - щит Земли" - скачать смотреть
Презентация по Химии "Озоновый слой - щит Земли" - скачать смотреть  Теория растворов (лекция 2)
Теория растворов (лекция 2) Минералогия. Оксиды
Минералогия. Оксиды Ароматты галогентуындылар. Айырылу-қосылу және қосылу айырылу реакциясының механизмі
Ароматты галогентуындылар. Айырылу-қосылу және қосылу айырылу реакциясының механизмі Титриметрический анализ. Сущность титриметрического анализа
Титриметрический анализ. Сущность титриметрического анализа Химия – это область чудес, в ней скрыто счастье человечества, величайшие завоевания разума будут сделаны именно в этой области. (М.
Химия – это область чудес, в ней скрыто счастье человечества, величайшие завоевания разума будут сделаны именно в этой области. (М. Кислоты
Кислоты Вещества преимущественно удушающего действия (пульмонотоксиканты)
Вещества преимущественно удушающего действия (пульмонотоксиканты) Презентация на тему "Кремний"
Презентация на тему "Кремний" Таяние льда
Таяние льда Буферные растворы. Буферная емкость
Буферные растворы. Буферная емкость Щелочноземельные металлы
Щелочноземельные металлы Химия в сельском хозяйстве
Химия в сельском хозяйстве Химические сдвиги ядер
Химические сдвиги ядер Древесина и её топливные свойства
Древесина и её топливные свойства Общая и неорганическая химия
Общая и неорганическая химия Қатты әсер ететін уландырғыш заттар
Қатты әсер ететін уландырғыш заттар Антисептические и дезинфицирующие средства
Антисептические и дезинфицирующие средства Минералы и Близнецы
Минералы и Близнецы Атомно – молекулярное учение
Атомно – молекулярное учение Кислоты, их классификация и свойства
Кислоты, их классификация и свойства IV,III группа периодической системы Д..И. Менделеева. Кислота борная, натрия гидрокарбонат
IV,III группа периодической системы Д..И. Менделеева. Кислота борная, натрия гидрокарбонат Нефть. Состав. Свойства. Переработка
Нефть. Состав. Свойства. Переработка «Химия в искусстве»
«Химия в искусстве»  Презентация Сплавы металлов.
Презентация Сплавы металлов.