Содержание
- 2. 2) LiCoO2 или Li[CoO6/3]2∞ – электродный материал литий-ионного аккумулятора. В этой структуре сочетается сразу несколько типов
- 3. В водном растворе каждый ион связан с молекулами воды. На рисунке показана только одна молекула воды,
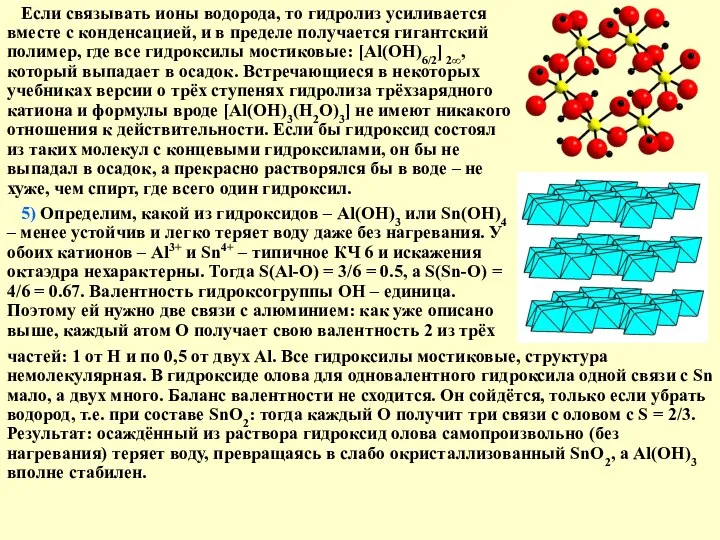
- 4. частей: 1 от Н и по 0,5 от двух Al. Все гидроксилы мостиковые, структура немолекулярная. В
- 5. Варианты расчёта валентности связи В общем случае связи у данного атома неравноценны по длинам, а часто
- 6. – вместо однозначной связи между L и S даётся закон распределения степени окисле-ния («валентности») катиона между
- 7. Показатели степени в формуле Пятенко для оксидов Если нужного элемента нет в таблице, поищите в ней
- 9. Скачать презентацию
2) LiCoO2 или Li[CoO6/3]2∞ – электродный материал литий-ионного аккумулятора.
В этой структуре
2) LiCoO2 или Li[CoO6/3]2∞ – электродный материал литий-ионного аккумулятора.
В этой структуре
3) Пример использования принципа ЛБВ при прогнозе новых соединений. Одно время вызывали большой интерес соединения структурного типа пирохлора с общей формулой A2M2X6Y, где A – более крупные катионы с КЧ 8 (6X+2Y), M – более мелкие катионы, окружённые шестью X, а окружение анионов определите самостоятельно. Однако соединения A2M2O7, где A – щелочноземельный или щелочной ион (например, Na2W2O7 или Ca2Nb2O7) не образуют такую структуру, а Sm2Ti2O7, NaCaNb2O6F и NaPbNb2O6,5 образуют, хотя Na+, Ca2+, Pb2+ и Sm3+, Ti4+, Nb5+ и W6+, O2- и F- сходны по размерам и координационным предпочтениям. Главная проблема здесь – в обеспечении ЛБВ на анионе Х. Вычислите сумму валентностей для седьмого аниона в каждом из перечисленных случаев и увидите различие.
В водном растворе каждый ион связан с молекулами воды.
На рисунке показана
В водном растворе каждый ион связан с молекулами воды.
На рисунке показана
4) Обсудим склонность гидратированного катиона алюминия к гидролизу – отрыву иона водорода от гидратной оболочки – и к конденсации гидролизованных ионов.
иметь максимальное КЧ 6. В ионном кристалле КЧ может быть меньше по условиям координационного баланса или совместимости координационных групп, но с нейтральными молекулами таких ограничений нет, поэтому неизбежно КЧ 6. Тогда S(Al-O)=3/6=0,5. Тогда у кислорода на связи с Н остаётся 1,5, и S(O-H)=0.75 – связь довольно прочна, но всё же слабее, чем в свободной молекуле воды. Поэтому отрыв протона маловероятен, но иногда возможен. При такой схеме у атома водорода до его валентности 1 не хватает 0,25 единиц валентности. Они восполняются водородной связью с молекулой воды из второй гидратной оболочки. Сравнение величин S(O-H) у разных гидратированных катионов позволяет сравнивать их по кислотности водных растворов их солей.
Но что происходит, когда протон оторвался? Атом кислорода сразу становится валентно ненасыщенным: даже если от оставшегося Н он получит не 0,75, а 1,00, всё равно в сумме со связью O-Al получается лишь 1,5. Чтобы восстановить ЛБВ, есть два варианта: а) резкое упрочнение данной связи
Al-O за счёт ослабления других, что нехарактерно
для Al3+ в отличие, например, от d0-ионов (Ti4+, V5+);
б) присоединение второго Al3+, который даст недо-
стающие 0,5 единиц валентности. Идёт конденсация,
два октаэдра соединяются общим ребром:
частей: 1 от Н и по 0,5 от двух Al. Все
частей: 1 от Н и по 0,5 от двух Al. Все
Если связывать ионы водорода, то гидролиз усиливается вместе с конденсацией, и в пределе получается гигантский полимер, где все гидроксилы мостиковые: [Al(OH)6/2] 2∞, который выпадает в осадок. Встречающиеся в некоторых учебниках версии о трёх ступенях гидролиза трёхзарядного катиона и формулы вроде [Al(OH)3(H2O)3] не имеют никакого отношения к действительности. Если бы гидроксид состоял из таких молекул с концевыми гидроксилами, он бы не выпадал в осадок, а прекрасно растворялся бы в воде – не хуже, чем спирт, где всего один гидроксил.
5) Определим, какой из гидроксидов – Al(OH)3 или Sn(OH)4 – менее устойчив и легко теряет воду даже без нагревания. У обоих катионов – Al3+ и Sn4+ – типичное КЧ 6 и искажения октаэдра нехарактерны. Тогда S(Al-O) = 3/6 = 0.5, а S(Sn-O) = 4/6 = 0.67. Валентность гидроксогруппы ОН – единица. Поэтому ей нужно две связи с алюминием: как уже описано выше, каждый атом О получает свою валентность 2 из трёх
Варианты расчёта валентности связи
В общем случае связи у данного атома неравноценны
Варианты расчёта валентности связи
В общем случае связи у данного атома неравноценны
1) Метод Полинга-Брауна – наиболее универсальный и общепринятый.
S=exp[(L0-L)/B], где
L – длина связи А-Х, L0 – константа, специфичная для данной пары элементов с учётом степеней окисления, а B – константа, обычно принимаемая за 0,37 Å. Из формулы следует, что при L= L0 валентность связи S=1, значит L0 имеет смысл длины ординарной связи. В ионно-ковалентных структурах обычно КЧ>валентности, L>L0, а S<1. Сокращённый список значений L0 есть в «Задачнике по структурной химии» (Приложение 3), а более полный можно найти в виде текстового файла bvparm2013.cif на сайте Межународного союза кристаллографов:
http://www.iucr.org/resources/data/datasets/bond-valence-parameters
Оборотная сторона универсальности этого метода – невысокая точность. В частности, одинаковая величина В для всех связей предполагает, что у них с ростом расстояния величины S убывают по одному и тому же закону. Между тем, достаточно очевидно, что ионная связь – более дальнодействующая, т.е. S должна убывать не так круто, как при ковалентной связи, которая резко ослабевает с уменьшением перекрывания АО.
2) Метод Пятенко – более узко применимый, но при этом более точный. Его особенности:
– применим только к соединениям с однотипными анионами (к оксидам);
– вместо однозначной связи между L и S даётся закон распределения
– вместо однозначной связи между L и S даётся закон распределения
– вместо экспоненциальной используется степенная зависимость, где показатель степени n зависит от разности электроотрицательностей: для наиболее ионных связей он равен 2 (закон Кулона!), а для ковалентных доходит до 7.
SAX = KA × LAX–n,
где SAX – валентность связи между атомами А и Х, LAX – её длина, n – показатель, зависящий от степени ионности связи (см. таблицу на следующем слайде), KA – нормирующий множитель для катиона А, определяемый из условия баланса валентности на катионе А:
KA = ZA/Σ(LAX(i) –n),
где ZA – степень окисления А, i – номер его соседа, и суммирование проводится по всем его соседям.
Разумеется, те же формулы можно применять не только к оксидам, но и к сульфидам, галогенидам и т.д., но тогда нужно будет подобрать иные значения n.
Задача 23. В той же структуре, которая предложена для реферата, найдите обоими методами валентности всех связей и проверьте выполнение локального баланса валентности на каждом атоме. Заметьте, что даже если структура ошибочная и ЛБВ в ней не сходится, глобальный баланс всегда сходится: сумма валентностей связей всех катионов должна равняться сумме валентностей связей всех анионов, ведь это одни и те же цифры. Это надо проверить с учётом кратностей позиций. Если совпадения нет – есть ошибка в расчёте (2 балла).
Задача 24. Вычислите валентность связи О-Н в данных аквакатионах и определите, какой из них более склонен к гидролизу, какой – к конденсации гидролизованных форм (1 балл).
Показатели степени в формуле Пятенко для оксидов
Если нужного элемента нет в
Показатели степени в формуле Пятенко для оксидов
Если нужного элемента нет в
![2) LiCoO2 или Li[CoO6/3]2∞ – электродный материал литий-ионного аккумулятора. В этой](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1397125/slide-1.jpg)




 Липиды. Классификация липидов
Липиды. Классификация липидов Серная кислота
Серная кислота Химиялық формула
Химиялық формула Реакции замещения
Реакции замещения Алканы
Алканы Органічні сполуки в побуті
Органічні сполуки в побуті  Оксид металлов
Оксид металлов Буровые промывочные жидкости. Лекция 1
Буровые промывочные жидкости. Лекция 1 Особенность, или Закономерность в строении атомов элементов. Периодическая система химических элементов Д.И. Менделеева
Особенность, или Закономерность в строении атомов элементов. Периодическая система химических элементов Д.И. Менделеева Презентация по Химии "Ферменты" - скачать смотреть
Презентация по Химии "Ферменты" - скачать смотреть  Аммиак. Соли аммония. Методы получения
Аммиак. Соли аммония. Методы получения Альдегиды
Альдегиды Химические структуры
Химические структуры Структурная химия и кристаллохимия. Введение
Структурная химия и кристаллохимия. Введение Электрохимическая система
Электрохимическая система Практическая работа №1 Признаки химических реакций
Практическая работа №1 Признаки химических реакций Химия - важный элемент жизни Работу выполнили: ученики 10 класса МКОУ Советской СОШ
Химия - важный элемент жизни Работу выполнили: ученики 10 класса МКОУ Советской СОШ Горные породы
Горные породы Композиты как материалы конструкционного назначения
Композиты как материалы конструкционного назначения Полиазометины (полишиффовы основания)
Полиазометины (полишиффовы основания) Алкены. Свойства. 10 класс
Алкены. Свойства. 10 класс Жиры в природе
Жиры в природе Презентация по Химии "Выращивание кристаллов в домашних условиях" - скачать смотреть
Презентация по Химии "Выращивание кристаллов в домашних условиях" - скачать смотреть  Масс-спектры спиртов и фенолов
Масс-спектры спиртов и фенолов Происхождение жизни на Земле. Процесс химической эволюции
Происхождение жизни на Земле. Процесс химической эволюции Свойства снега и льда (окружающий мир, 3 класс)
Свойства снега и льда (окружающий мир, 3 класс) Метаморфические горные породы
Метаморфические горные породы ПРИРОДНИЙ ГАЗ
ПРИРОДНИЙ ГАЗ