Содержание
- 2. Проверка домашнего задания 1. Дайте характеристику 1 варианта классификации химических элементов 2. Дайте характеристику 2 варианта
- 3. 1.Какой элемент относится к щелочным металлам: а) Na б) Аl в) Са г) Cs 2Какой элемет
- 4. Периодический закон Д. И. Менделеева «Периодическому закону будущее не грозит разрушением, а только надстройка и развитие
- 5. Предшественники Д.И.Менделеева И. В. Деберейнер Дж. А. Ньюлендс Л. Ю. Мейер
- 6. Дмитрий Иванович Менделеев (08.02.1834 – 02.02.1907)
- 7. 1 марта 1869 г. Формулировка периодического закона Д.И. Менделеева. Свойства простых веществ, а также формы и
- 8. 1870 г. Дмитрий Иванович предсказал существование трех элементов: эка-силиция, эка-алюминия и эка-бора. В 1879 г. В
- 9. Современная формулировка периодического закона: свойства химических элементов и их соединений находятся в периодической зависимости от величины
- 10. Изменения свойств в периодической системе с ростом величины атомных весов в периоде (слева направо): 1.Металлические свойства
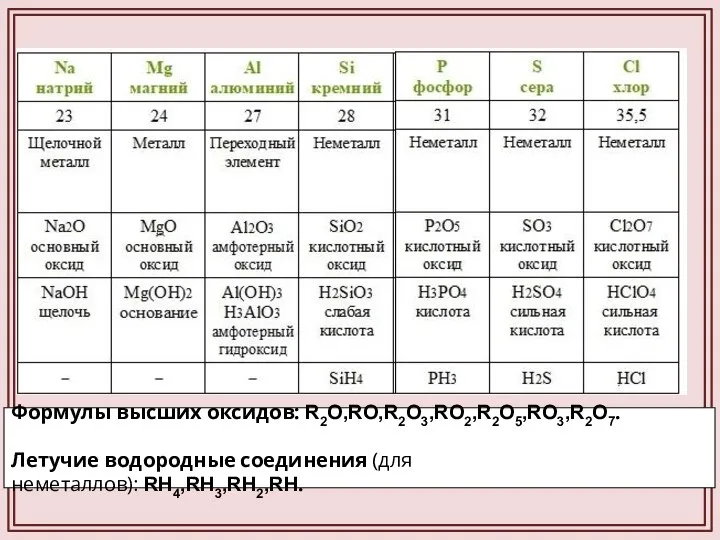
- 12. Формулы высших оксидов: R2O,RO,R2O3,RO2,R2O5,RO3,R2O7. Летучие водородные соединения (для неметаллов): RH4,RH3,RH2,RH.
- 13. 1. В ряду Si → P → S → Cl неметаллические свойства 1) усиливаются 3) не
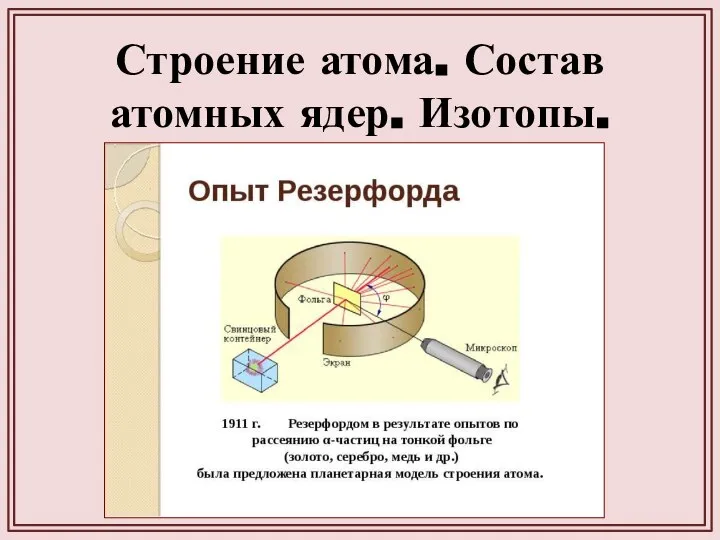
- 14. Строение атома. Состав атомных ядер. Изотопы.
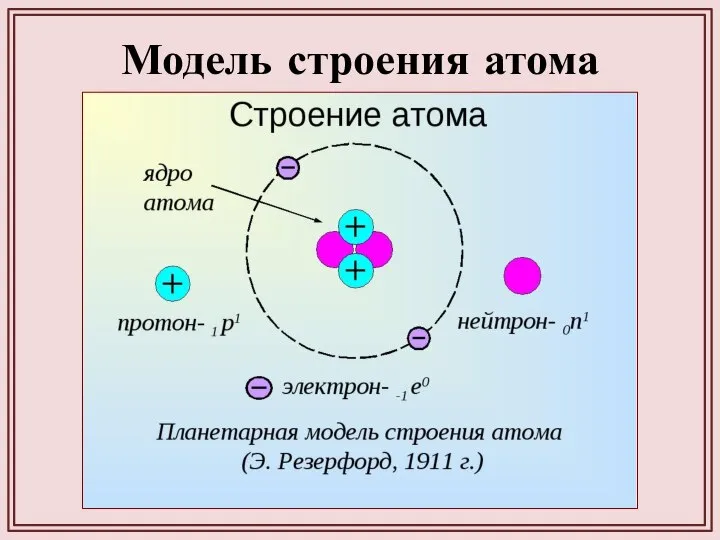
- 15. Модель строения атома
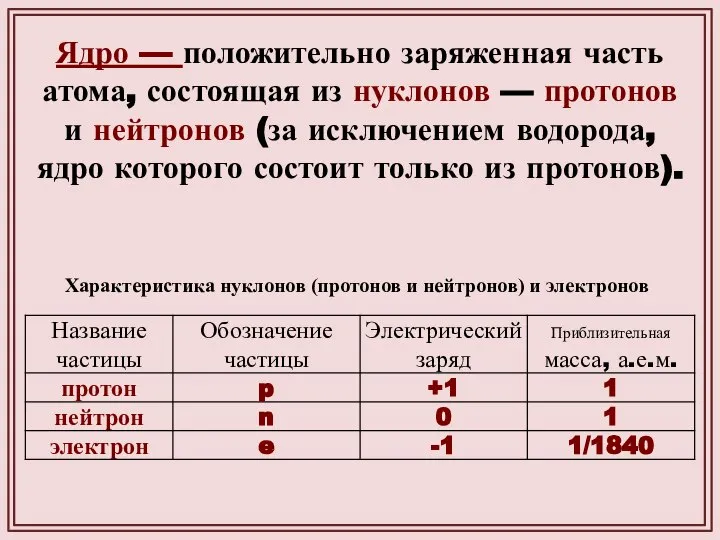
- 16. Ядро — положительно заряженная часть атома, состоящая из нуклонов — протонов и нейтронов (за исключением водорода,
- 17. Заряд ядра равен порядковому номеру химического элемента Заряд ядра атома = Порядковому номеру (N) = Числу
- 18. Задача №2. Определите состав атома хлора Почему в атоме хлора дробное число нейтронов? Изотопы одного и
- 19. Химический элемент – это вид атомов с одинаковым зарядом ядра В природе химические элементы существуют в
- 20. Почему в таблице Д. И. Менделеева для химических элементов относительные атомные массы представлены в виде дробных
- 22. Скачать презентацию















 Строение атома
Строение атома Кислород
Кислород "Металлы тоже воевали…" урок по химии в 8 классе Учитель Герасименко Е.В.
"Металлы тоже воевали…" урок по химии в 8 классе Учитель Герасименко Е.В.  Каталитический крекинг
Каталитический крекинг Электролиз. Постоянный ток
Электролиз. Постоянный ток Дикарбоновые кислоты
Дикарбоновые кислоты Расчеты равновесий в водных растворах рН, рОН
Расчеты равновесий в водных растворах рН, рОН Выполнил: А. М. Галенко, учитель химии МОУ СОШ № 67 г. Волгограда
Выполнил: А. М. Галенко, учитель химии МОУ СОШ № 67 г. Волгограда  Изменение в составе ядер атомов. Изотопы
Изменение в составе ядер атомов. Изотопы Алканы. Предельные углеводороды. Насыщенные углеводороды. Парафины
Алканы. Предельные углеводороды. Насыщенные углеводороды. Парафины Изучение растворимости веществ. Приготовление растворов и анализ состава растворов путем выпаривания
Изучение растворимости веществ. Приготовление растворов и анализ состава растворов путем выпаривания Аттестационная работа. Развитие творческих возможностей учащихся через организацию исследовательской работы по химии
Аттестационная работа. Развитие творческих возможностей учащихся через организацию исследовательской работы по химии Аттестационная работа. Использование цифровой лаборатории Архимед во внеурочной деятельности по химии
Аттестационная работа. Использование цифровой лаборатории Архимед во внеурочной деятельности по химии Конструкция ферментатора
Конструкция ферментатора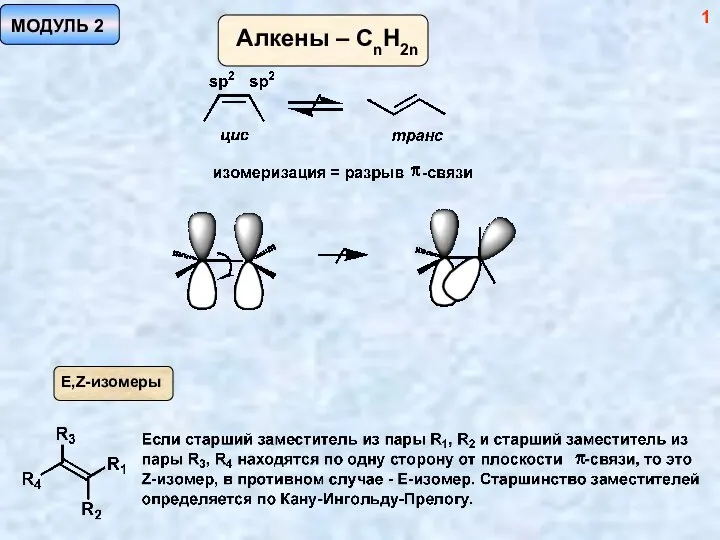 Методы синтеза алкенов. (Модуль 2)
Методы синтеза алкенов. (Модуль 2) Презентация по Химии "Мир металлов" - скачать смотреть
Презентация по Химии "Мир металлов" - скачать смотреть  Силікон Корєшкова А. В. 11-М
Силікон Корєшкова А. В. 11-М  Презентация Фосфор 9 класс
Презентация Фосфор 9 класс Щелочные металлы
Щелочные металлы Взаимное влияние атомов в молекулах
Взаимное влияние атомов в молекулах Химическая связь. Валентность элементов в ковалентных соединениях. Степень окисления элементов
Химическая связь. Валентность элементов в ковалентных соединениях. Степень окисления элементов Термохимия. Расчет тепловых эффектов химических реакций
Термохимия. Расчет тепловых эффектов химических реакций Амины, анилин: строение, свойства, получение, применение
Амины, анилин: строение, свойства, получение, применение Непредельные углеводороды АЛКЕНЫ Алферова Мария Владимировна учитель химии ГБОУ лицей №486 Выборгского района г. Санкт-Петербу
Непредельные углеводороды АЛКЕНЫ Алферова Мария Владимировна учитель химии ГБОУ лицей №486 Выборгского района г. Санкт-Петербу Минералы и горные породы
Минералы и горные породы Энергия топлива
Энергия топлива Литосфера. Почва. Элементный состав почв
Литосфера. Почва. Элементный состав почв Фосфор и его основные соединения
Фосфор и его основные соединения