Содержание
- 2. Взаимодействие в двухкомпонентных системах Примитивные виды взаимодействия: без промежуточных фаз Компоненты: A, B. Должны быть переменные:
- 3. А если смешение не является полным, то на фазовой диаграмме (и на P, T – фиксированном
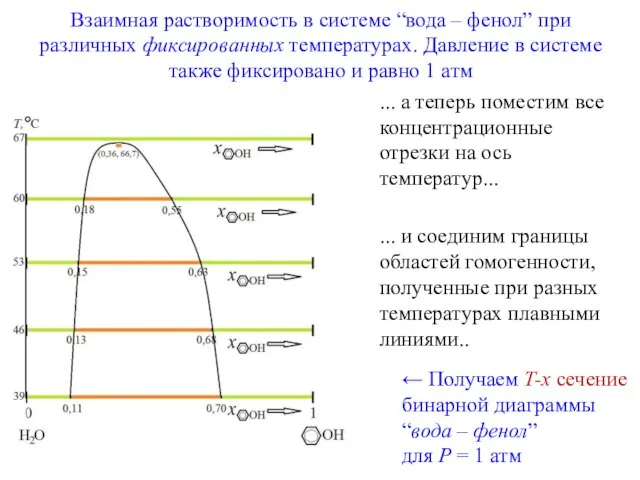
- 4. Взаимная растворимость в системе “вода – фенол” при различных фиксированных температурах. Давление в системе также фиксировано
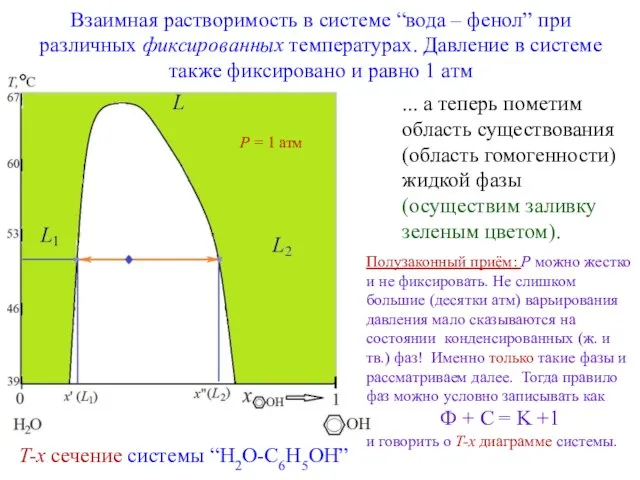
- 5. Взаимная растворимость в системе “вода – фенол” при различных фиксированных температурах. Давление в системе также фиксировано
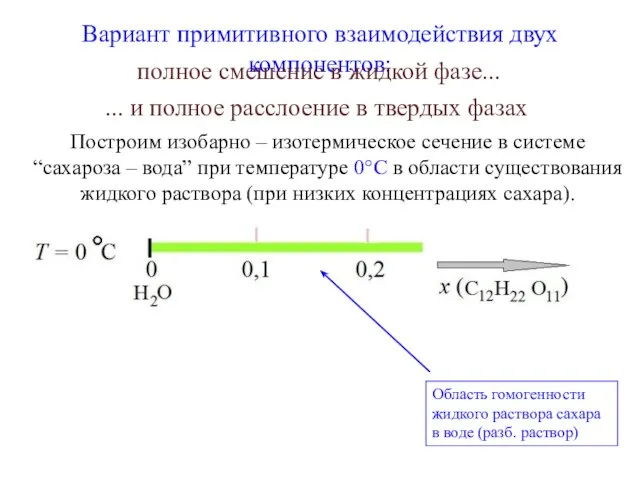
- 6. Вариант примитивного взаимодействия двух компонентов: Область гомогенности жидкого раствора сахара в воде (разб. раствор) Построим изобарно
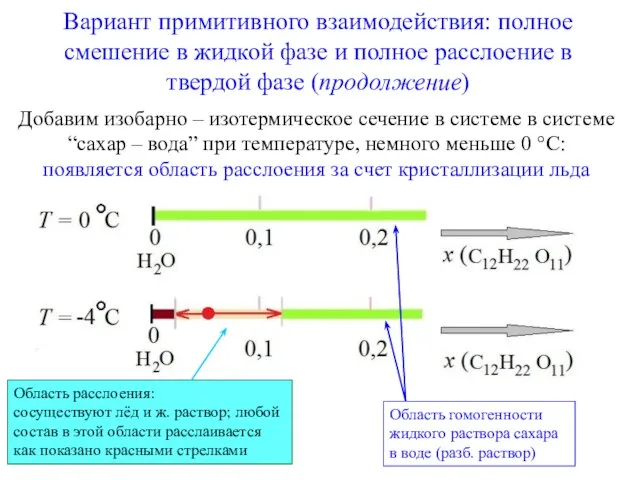
- 7. Вариант примитивного взаимодействия: полное смешение в жидкой фазе и полное расслоение в твердой фазе (продолжение) Область
- 8. … добавим и другие сечения при различных температурах, сосуществующий раствор становится всё более концентрированным
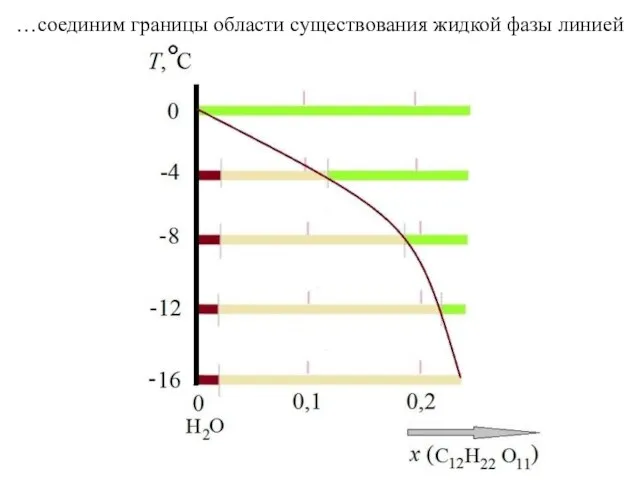
- 9. …соединим границы области существования жидкой фазы линией
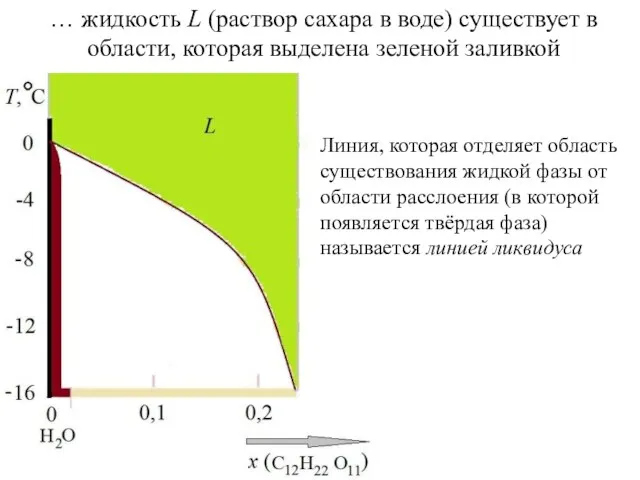
- 10. … жидкость L (раствор сахара в воде) существует в области, которая выделена зеленой заливкой Линия, которая
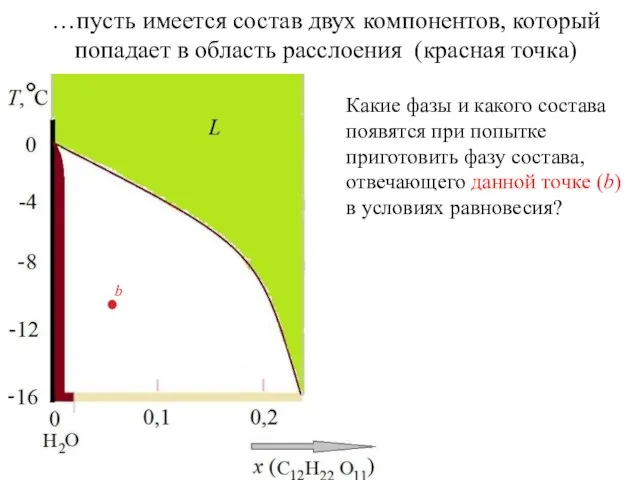
- 11. …пусть имеется состав двух компонентов, который попадает в область расслоения (красная точка) Какие фазы и какого
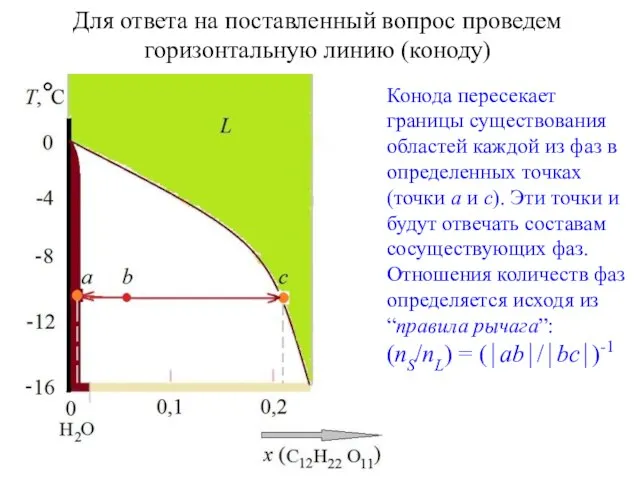
- 12. Для ответа на поставленный вопрос проведем горизонтальную линию (коноду) Конода пересекает границы существования областей каждой из
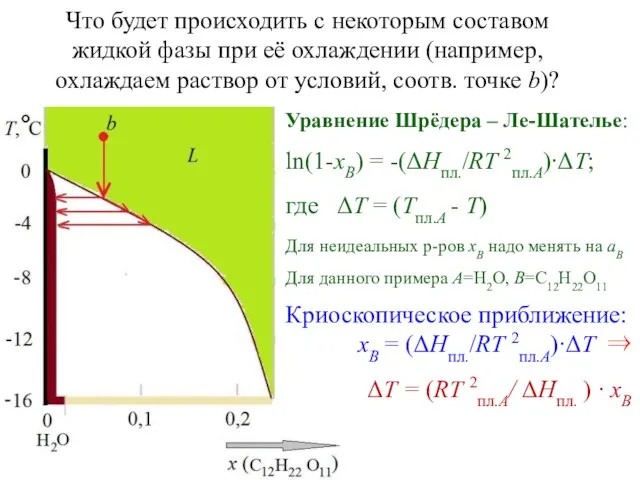
- 13. Что будет происходить с некоторым составом жидкой фазы при её охлаждении (например, охлаждаем раствор от условий,
- 14. Уравнение Шрёдера – Ле-Шателье описывает линию ликвидуса… или (что то же самое) отвечает на вопрос: “Какой
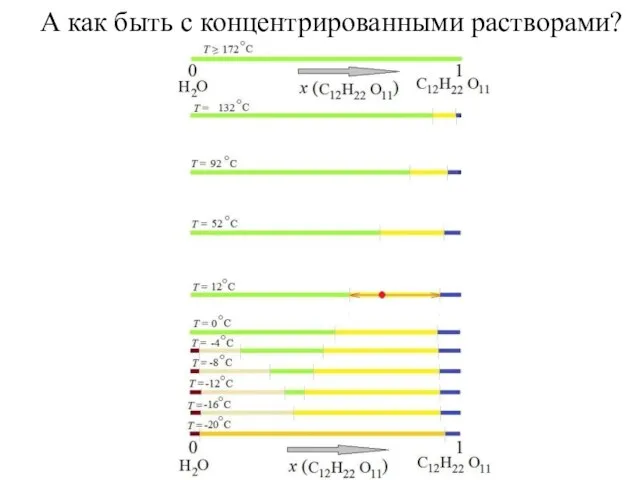
- 15. А как быть с концентрированными растворами?
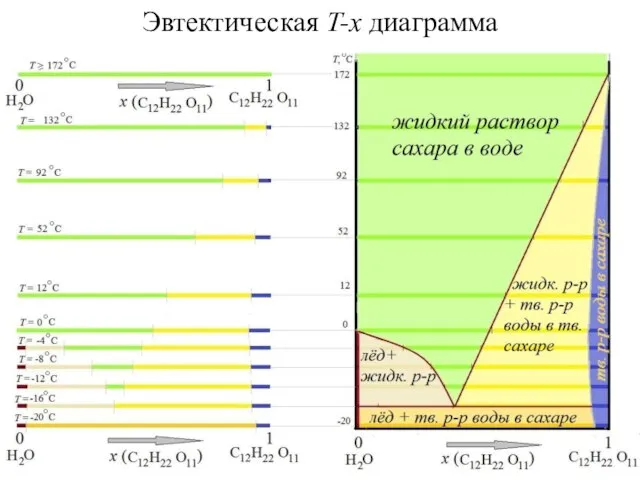
- 16. Эвтектическая T-x диаграмма
- 17. Как вычислить координаты эвтектической точки? Решаем совместно уравнение Шредера – Ле-Шателье для обеих ветвей ликвидуса ln(1-xB)
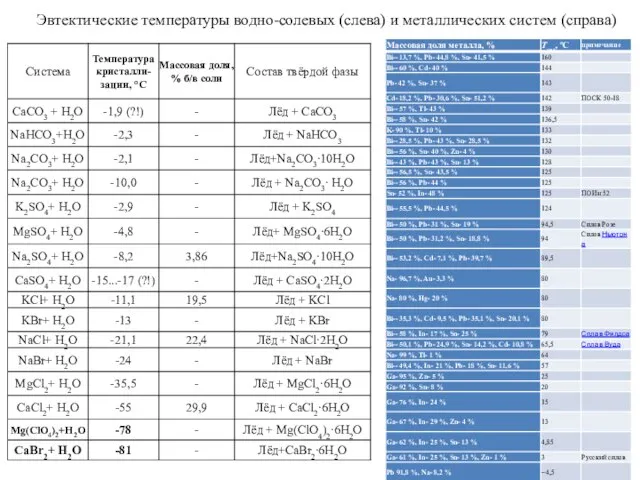
- 18. Эвтектические температуры водно-солевых (слева) и металлических систем (справа)
- 19. В пустыне есть свои удивительные объекты... В нашем случае (диаграммы эвтектического типа) такой объект – ФД
- 20. Пример эвтектической T-x диаграммы (Cd-Zn) с ретроградным солидусом (ограничивает область гомогенности тв. р-ра на основе Zn)
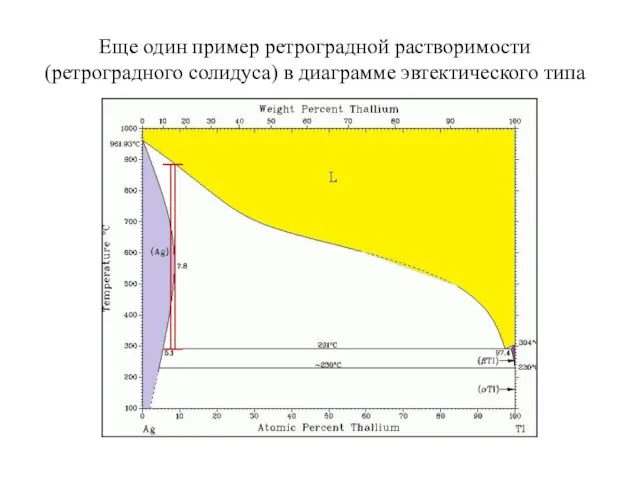
- 21. Еще один пример ретроградной растворимости (ретроградного солидуса) в диаграмме эвтектического типа
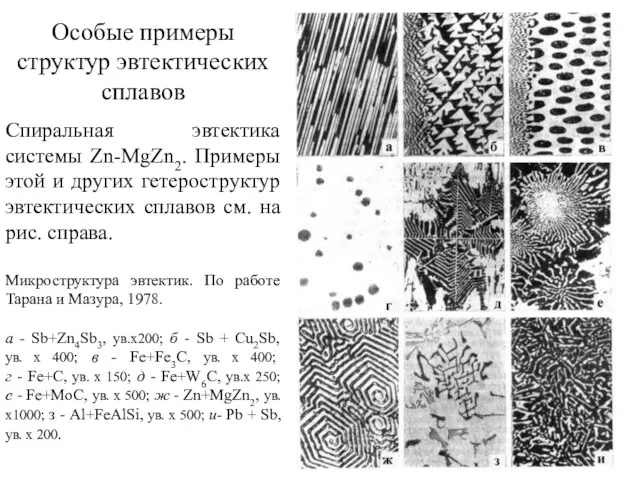
- 22. Особые примеры структур эвтектических сплавов Спиральная эвтектика системы Zn-MgZn2. Примеры этой и других гетероструктур эвтектических сплавов
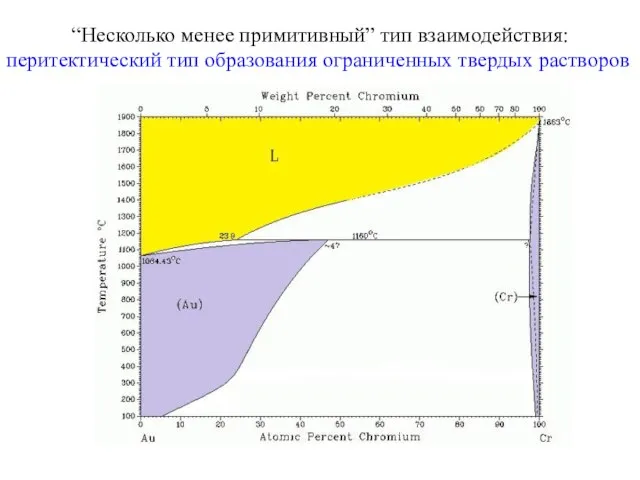
- 23. “Несколько менее примитивный” тип взаимодействия: перитектический тип образования ограниченных твердых растворов
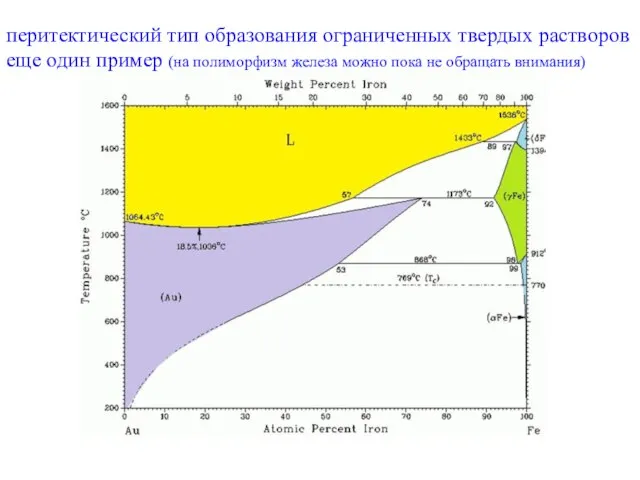
- 24. перитектический тип образования ограниченных твердых растворов еще один пример (на полиморфизм железа можно пока не обращать
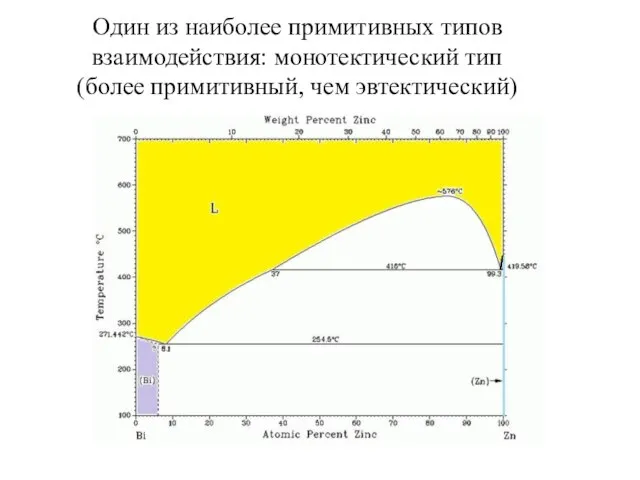
- 25. Один из наиболее примитивных типов взаимодействия: монотектический тип (более примитивный, чем эвтектический)
- 27. Скачать презентацию







 Энергетический обмен
Энергетический обмен Рецепторы анионов
Рецепторы анионов Группа щелочных габброидов
Группа щелочных габброидов Химия в быту
Химия в быту Строение и устойчивость дисперсий льда, стабилизированных гидрофобизированным нанокремнеземом
Строение и устойчивость дисперсий льда, стабилизированных гидрофобизированным нанокремнеземом Анализ стадии технологического процесса производства гранулотола
Анализ стадии технологического процесса производства гранулотола Энергия алмасудың бірінші сатысы: күрделі заттардың арнайы жолдармен ыдырап, универсалды аралық өнімдерге айналуы
Энергия алмасудың бірінші сатысы: күрделі заттардың арнайы жолдармен ыдырап, универсалды аралық өнімдерге айналуы Презентация по Химии "Природні І синтетичні Органічні речовини" - скачать смотреть бесплатно
Презентация по Химии "Природні І синтетичні Органічні речовини" - скачать смотреть бесплатно Выращивание кристалла медного купороса
Выращивание кристалла медного купороса Коллоидная химия
Коллоидная химия Имидазол. Получение, свойства, анализ, применение, условия хранения лекарственных препаратов производных имидазола
Имидазол. Получение, свойства, анализ, применение, условия хранения лекарственных препаратов производных имидазола Адиабатическое приближение
Адиабатическое приближение Презентация по Химии "ПОЖАРНАЯ БЕЗОПАСНОСТЬ" - скачать смотреть бесплатно
Презентация по Химии "ПОЖАРНАЯ БЕЗОПАСНОСТЬ" - скачать смотреть бесплатно Законы химической термодинамики. Часть 1. Физическая и коллоидная химия
Законы химической термодинамики. Часть 1. Физическая и коллоидная химия Химическая связь
Химическая связь Використання вуглеводнів
Використання вуглеводнів Закономерности протекания химических реакций. Основы химической термодинамики. Лекция 6
Закономерности протекания химических реакций. Основы химической термодинамики. Лекция 6 Катализ. Лекция 1
Катализ. Лекция 1 Галогены (солеобразующие)
Галогены (солеобразующие) Кислород. Электронное строение и свойства
Кислород. Электронное строение и свойства Правила техники безопасности при работе в химическом кабинете. Ознакомление с лабораторным оборудованием. Инструктаж по ТБ
Правила техники безопасности при работе в химическом кабинете. Ознакомление с лабораторным оборудованием. Инструктаж по ТБ «Разработка и реализация проекта по установлению фильтров для питьевых фонтанчиков в школе» Разработан: ОКУЛОВ АНДРЕЙ, ученик 10 к
«Разработка и реализация проекта по установлению фильтров для питьевых фонтанчиков в школе» Разработан: ОКУЛОВ АНДРЕЙ, ученик 10 к Химические реакции
Химические реакции Биосинтез холестерина, жирных кислот. Липопротеины. Регуляция и патология липидного обмена
Биосинтез холестерина, жирных кислот. Липопротеины. Регуляция и патология липидного обмена Кинетика ферментативного катализа. (Лекция 5)
Кинетика ферментативного катализа. (Лекция 5) Тема 6. Геология. Минералы
Тема 6. Геология. Минералы Химические свойства металлов. (9 класс)
Химические свойства металлов. (9 класс) Явище ізомерії. Структурна ізомерія Виконав Пивоварчук Вадим
Явище ізомерії. Структурна ізомерія Виконав Пивоварчук Вадим