Содержание
- 2. Строение катапинанда - 1,11-диазабицикло[9.9.9]нонакозана Отправной точкой в области нековалентной координационной химии анионов можно считать сообщение К.
- 3. Бициклические катапинанды могут быть классифицированы как хозяева анионов. Они связывают свои анионные гости с помощью двух
- 4. Хотя поведение анионных хозяев подчиняется тем же общим закономерностям, которые характерны для катионных хозяев (прежде всего,
- 5. ОСОБЕННОСТИ КОНСТРУИРОВАНИЯ РЕЦЕПТОРОВ АНИОНОВ 1. Требования к хозяину «Хозяина» можно рассматривать как соединение со сходящимися центрами
- 6. ОСОБЕННОСТИ КОНСТРУИРОВАНИЯ РЕЦЕПТОРОВ АНИОНОВ 2. Требования к аниону Вторая проблема касается определения центров связывания на самом
- 7. Основность по Льюису. Подавляющее большинство анионов является основаниями Льюиса, но есть и некоторые исключения: анионы, у
- 8. Сольватация. Анионы в основном имеют большие энергии сольватации, а поэтому влияние среды, в которой выполняют эксперименты
- 9. Таким образом, хозяин должен быть достаточно большим, чтобы иметь возможность включать в полость анион, а также
- 10. Природные рецепторы анионов Анионами являются 70 -75% ферментативных субстратов и кофакторов; очень часто это фосфатные остатки
- 11. В работе Ф. Куиоко (F. Quiocho) из Университета в Райсе (Техас, США) проведены кристаллографические исследования двух
- 12. Аргинин как центр связывания анионов. Аргининовый остаток, содержащий гуанидиновую группу, особенно важен среди белков и ферментов,
- 13. Примеры анионных рецепторов
- 14. Простые по структуре двумерные хозяева (циклические полиэтиленимины), содержат несколько протонируемых центров и способны образовывать комплексы («суперкомплексы»)
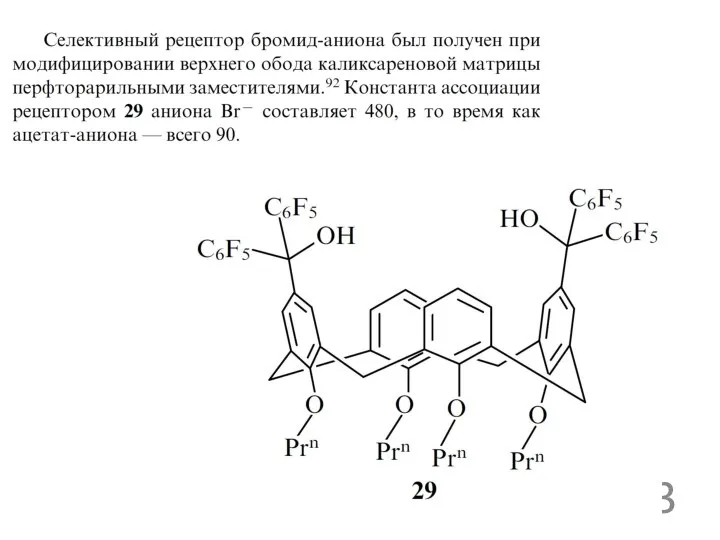
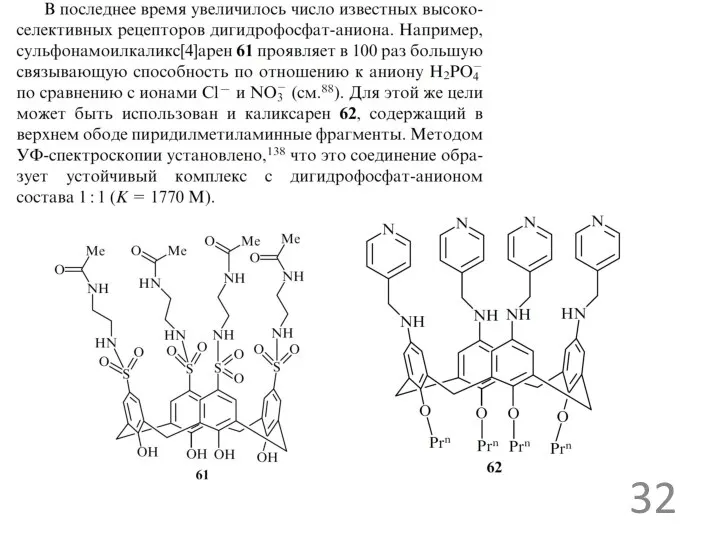
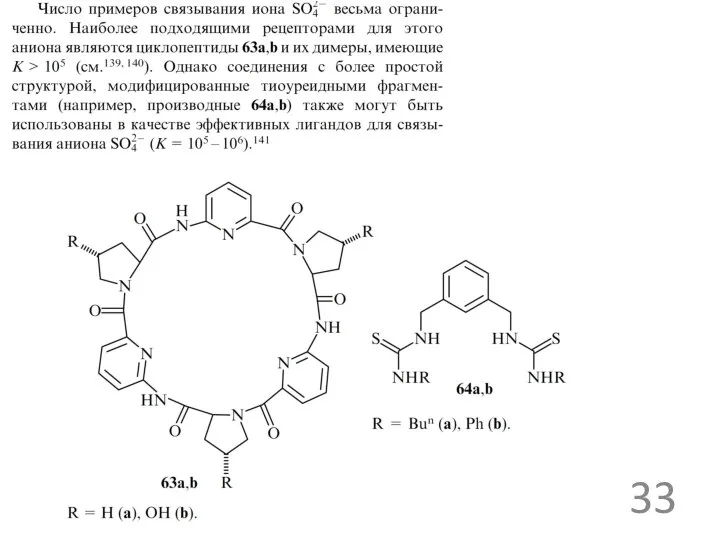
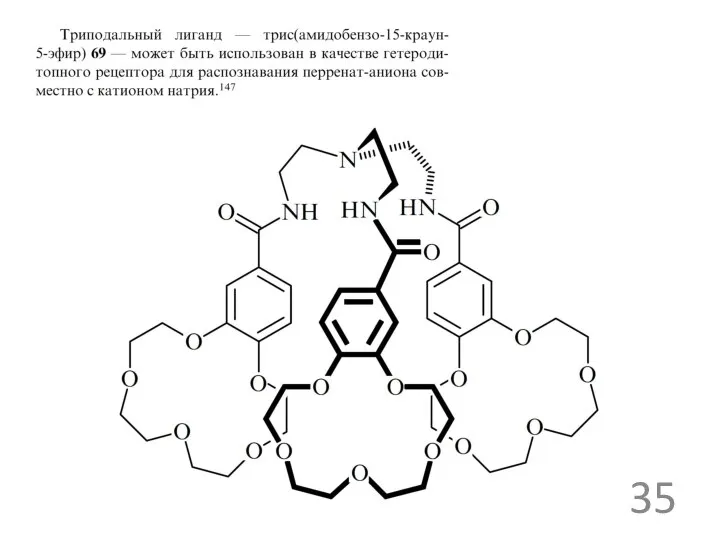
- 28. рецепторы для ацетат ионов
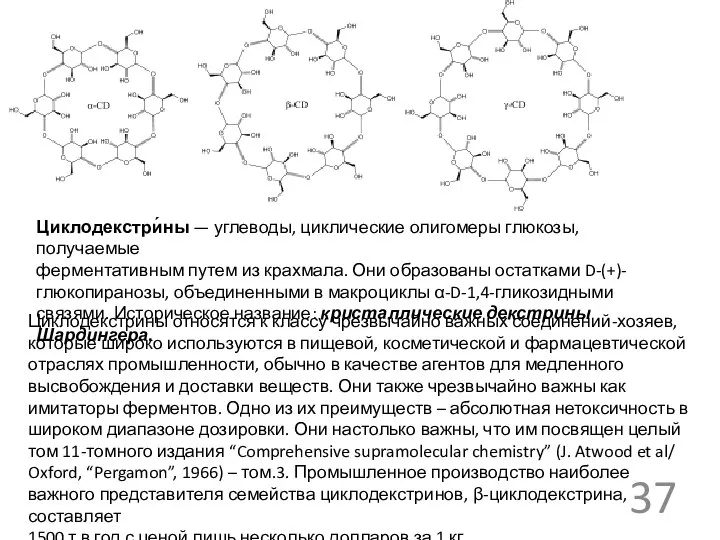
- 37. Циклодекстри́ны — углеводы, циклические олигомеры глюкозы, получаемые ферментативным путем из крахмала. Они образованы остатками D-(+)-глюкопиранозы, объединенными
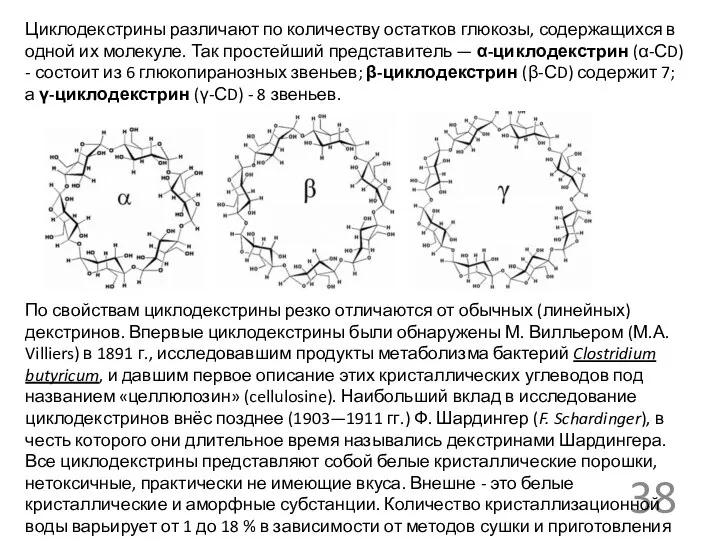
- 38. Циклодекстрины различают по количеству остатков глюкозы, содержащихся в одной их молекуле. Так простейший представитель — α-циклодекстрин
- 40. Циклодекстрин, молекулы которого состоят из 5 глюкопиранозных звеньев, ферментативными методами до сих пор не синтезирован. Более
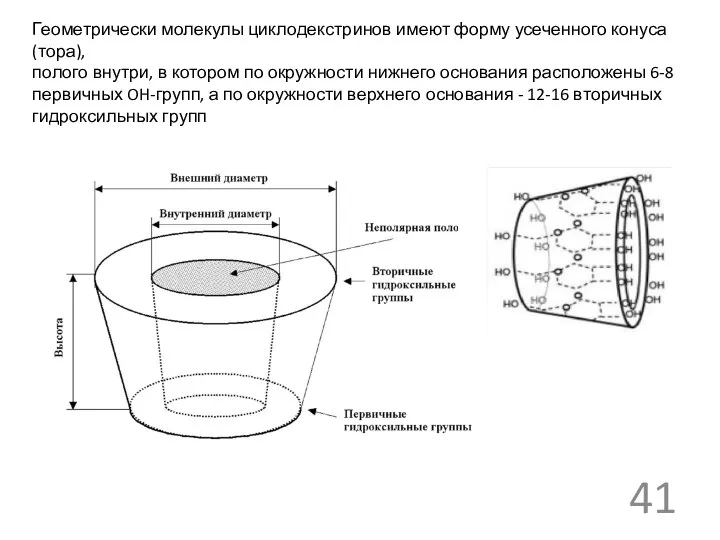
- 41. Геометрически молекулы циклодекстринов имеют форму усеченного конуса (тора), полого внутри, в котором по окружности нижнего основания
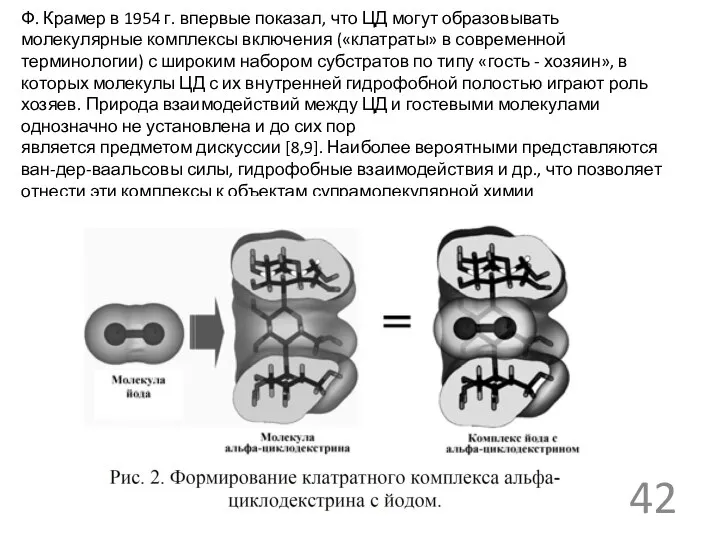
- 42. Ф. Крамер в 1954 г. впервые показал, что ЦД могут образовывать молекулярные комплексы включения («клатраты» в
- 43. Циклодекстрины химически устойчивы, относятся к невосстанавливаемым углеводам. Они могут быть модифицированы полностью или частично (региоселективно), приобретая
- 44. Комплексы включения в воде диссоциируют на циклодекстрин и исходное вещество, проявляя основные свойства последнего. При нагревании
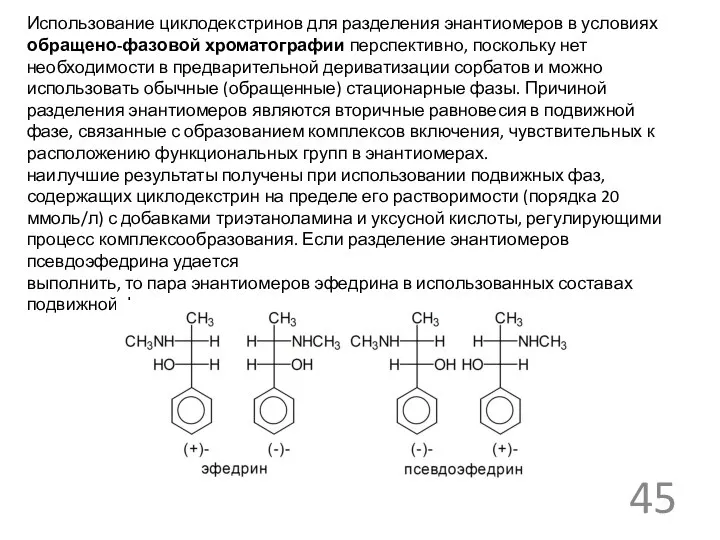
- 45. Использование циклодекстринов для разделения энантиомеров в условиях обращено-фазовой хроматографии перспективно, поскольку нет необходимости в предварительной дериватизации
- 46. Около 80 — 90% полученных в промышленности циклодекстринов (в основном бета-CD) расходуется в пищевой промышленности, где
- 47. циклодекстрины также применяют в фармацевтической промышленности в качестве систем доставки лекарств. циклодекстрины могут служить защитными агентами,
- 49. Скачать презентацию
Строение катапинанда - 1,11-диазабицикло[9.9.9]нонакозана
Отправной точкой в области нековалентной координационной химии анионов
Строение катапинанда - 1,11-диазабицикло[9.9.9]нонакозана
Отправной точкой в области нековалентной координационной химии анионов
«Du Pont de Nemours Company», 1968 г., посвященное комплексообразованию галогенидов с рядом макробициклических хозяев, называемых катапинандами.
Катапинанды (от греч. «katapino», означающего «заглатывать», или «поглощать») при протонировании атомов азота, находящихся в голове мостика, способны связывать галогенид-ионы внутри своей макробициклической полости
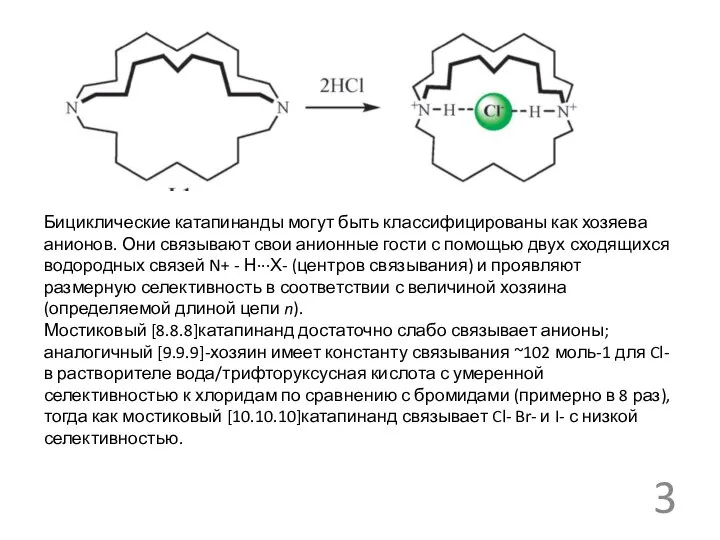
Бициклические катапинанды могут быть классифицированы как хозяева анионов. Они связывают свои
Бициклические катапинанды могут быть классифицированы как хозяева анионов. Они связывают свои
Мостиковый [8.8.8]катапинанд достаточно слабо связывает анионы; аналогичный [9.9.9]-хозяин имеет константу связывания ~102 моль-1 для Cl- в растворителе вода/трифторуксусная кислота с умеренной селективностью к хлоридам по сравнению с бромидами (примерно в 8 раз), тогда как мостиковый [10.10.10]катапинанд связывает Cl- Br- и I- с низкой селективностью.
Хотя поведение анионных хозяев подчиняется тем же общим закономерностям, которые характерны
Хотя поведение анионных хозяев подчиняется тем же общим закономерностям, которые характерны
1) анионы довольно велики, для них требуются рецепторы значительно большего размера, чем для катионов. Например, ионный радиус одного из самых маленьких анионов, F-, сравним с ионным радиусом К+ (1.33 и 1.38 А);
2) даже у простых неорганических анионов существует большое разнообразие формы и геометрии, например, сферическая (галогениды), линейная (SCN-, N3-), плоская (NO3-), тетраэдрическая (РО4, SO4) октаэдрическая (РF6 , Fe(CN)6), а в случае биологически важных олигофосфатных анионов формы еще более сложны;
3) у анионов свободные энергии сольватации больше, чем у катионов того же размера; значит, хозяева анионов должны более эффективно конкурировать с окружающей средой, например, ΔGгидр(F-) = -465 кДж/моль; ΔGгидр(К+) = -295 кДж/моль;
4) многие анионы существуют в узких пределах рН. Это может создавать трудности, особенно в случае рецепторов на основе полиаммониевых солей, где хозяин может быть не полностью протонирован как раз в той области рН, в которой анион присутствует в нужном виде;
5) обычно анионы координационно насыщены и поэтому связываются только посредством слабых взаимодействий, таких, как водородная связь, дисперсионные силы и ван-дер-ваальсовы взаимодействия.
ОСОБЕННОСТИ КОНСТРУИРОВАНИЯ РЕЦЕПТОРОВ АНИОНОВ
1. Требования к хозяину
«Хозяина» можно рассматривать как соединение
ОСОБЕННОСТИ КОНСТРУИРОВАНИЯ РЕЦЕПТОРОВ АНИОНОВ
1. Требования к хозяину
«Хозяина» можно рассматривать как соединение
ОСОБЕННОСТИ КОНСТРУИРОВАНИЯ РЕЦЕПТОРОВ АНИОНОВ
2. Требования к аниону
Вторая проблема касается определения центров
ОСОБЕННОСТИ КОНСТРУИРОВАНИЯ РЕЦЕПТОРОВ АНИОНОВ
2. Требования к аниону
Вторая проблема касается определения центров
Отрицательный заряд. Отрицательный заряд предполагает, что связывать анионы будут как нейтральные, так и, в особенности, положительно заряженные хозяева. К сожалению, электростатические взаимодействия не являются направленными, а поэтому все анионы будут электростатически притягиваться к хозяину, образуя в растворе сольватированную ионную пару. С ростом заряда анионов следует ожидать увеличения сродства. Для данного положительно заряженного хозяина следует учитывать конкуренцию со стороны противоанионов, т.е. на самом деле любая из наблюдаемых констант связывания будет представлять собой фактор относительной селективности связывания одного аниона по сравнению с другим.
Основность по Льюису. Подавляющее большинство анионов является основаниями Льюиса, но есть
Основность по Льюису. Подавляющее большинство анионов является основаниями Льюиса, но есть
подходящего хозяина за счет образования координационных связей. Это привело к появлению хозяев-антикраунов, напоминающих краун-эфиры, у которых кислород основания Льюиса заменен кислотными центрами связывания Льюиса. Хороший фундамент для конструирования селективных хозяев создает сильная направленность льюисовских координационных взаимодействий кислота — основание.
Высокая nоляризуемость. За счет высокой поляризуемости анионов возникают значительные ван-дер-ваальсовы взаимодействия. Будучи ненаправленными, они относятся ко всей площади поверхности контакта хозяина и аниона; таким образом, трехмерное капсулирование данного аниона должно усилить связывание всех анионов, соответствующих хозяину.
Сольватация. Анионы в основном имеют большие энергии сольватации, а поэтому влияние
Сольватация. Анионы в основном имеют большие энергии сольватации, а поэтому влияние
Координационное число и геометрия связанного аниона — также потенциально важные параметры. При поисках комплементарного хозяина для катионов металлов надо учитывать, что связывание металлов гораздо сильнее в тех случаях, когда координационное число и геометрия металла соответствуют этим же параметрам лиганда (октаэдрическая, тетраэдрическая, плоскоквадратная и т.д.). Эта важная особенность не так существенна в случае катионов щелочных металлов, которые не имеют четких координационных предпочтений. В кристаллическом NaC1 хлорид-анион находится в регулярном шестикоординационном октаэдрическом окружении. Напротив, хлорид- анион, капсулированный катапинандами, можно считать двухкоординационным,
поскольку он занят в образовании двух водородных связей N-Н···Cl-.
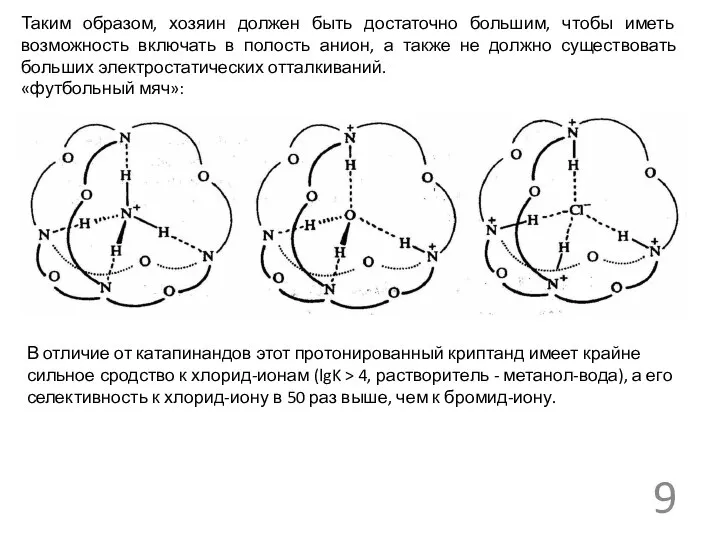
Таким образом, хозяин должен быть достаточно большим, чтобы иметь возможность включать
Таким образом, хозяин должен быть достаточно большим, чтобы иметь возможность включать
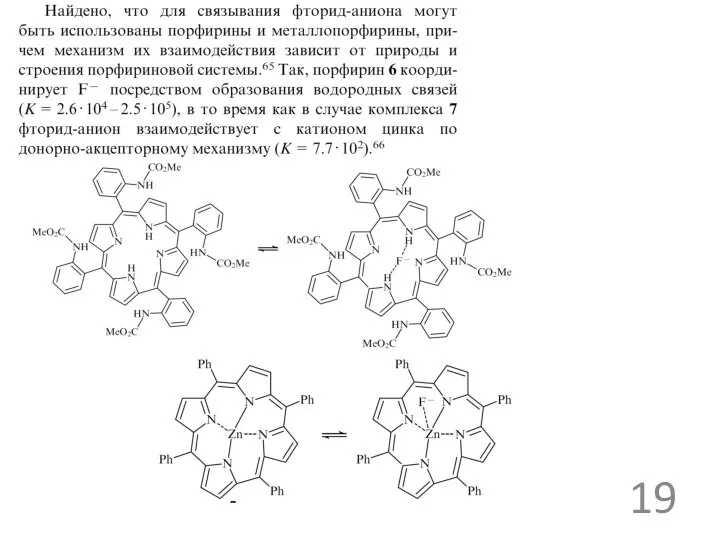
«футбольный мяч»:
В отличие от катапинандов этот протонированный криптанд имеет крайне сильное сродство к хлорид-ионам (lgK > 4, растворитель - метанол-вода), а его селективность к хлорид-иону в 50 раз выше, чем к бромид-иону.
Природные рецепторы анионов
Анионами являются 70 -75% ферментативных субстратов и кофакторов; очень
Природные рецепторы анионов
Анионами являются 70 -75% ферментативных субстратов и кофакторов; очень
В работе Ф. Куиоко (F. Quiocho) из Университета в Райсе (Техас,
В работе Ф. Куиоко (F. Quiocho) из Университета в Райсе (Техас,
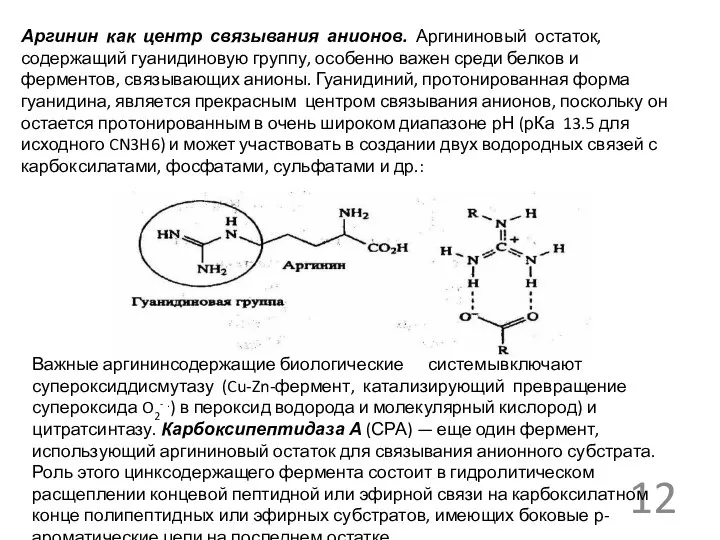
Аргинин как центр связывания анионов. Аргининовый остаток, содержащий гуанидиновую группу, особенно
Аргинин как центр связывания анионов. Аргининовый остаток, содержащий гуанидиновую группу, особенно
Важные аргининсодержащие биологические системы включают супероксиддисмутазу (Cu-Zn-фермент, катализирующий превращение супероксида O2- .) в пероксид водорода и молекулярный кислород) и цитратсинтазу. Карбоксипептидаза А (СРА) — еще один фермент, использующий аргининовый остаток для связывания анионного субстрата. Роль этого цинксодержащего фермента состоит в гидролитическом расщеплении концевой пептидной или эфирной связи на карбоксилатном конце полипептидных или эфирных субстратов, имеющих боковые р- ароматические цепи на последнем остатке.
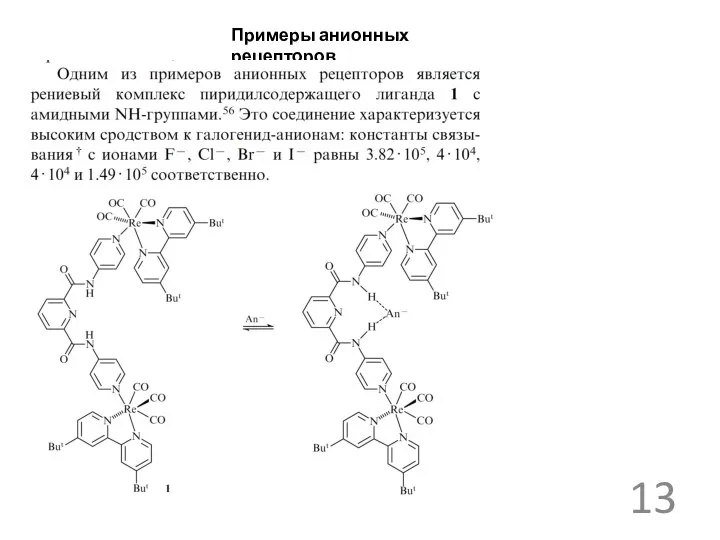
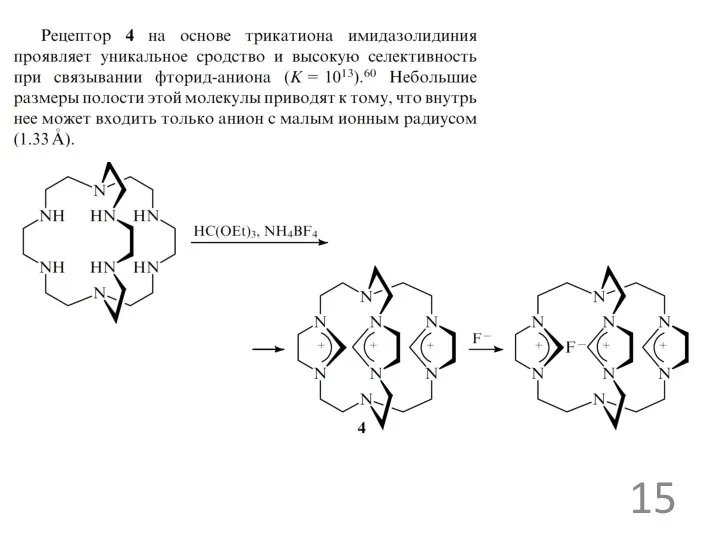
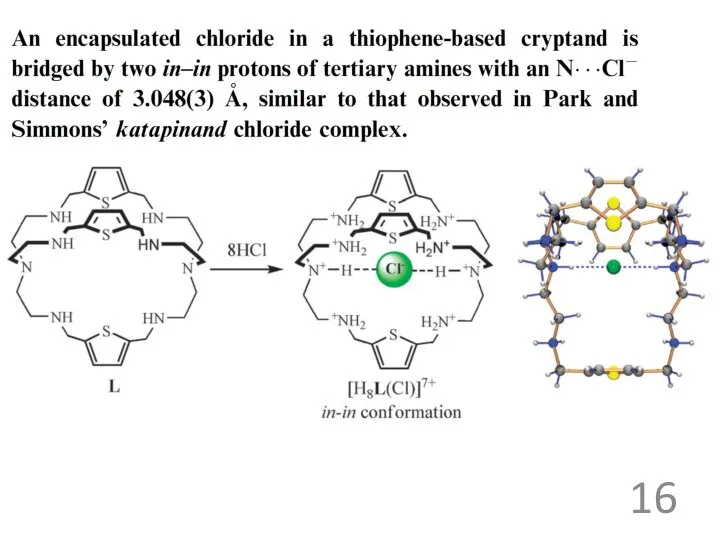
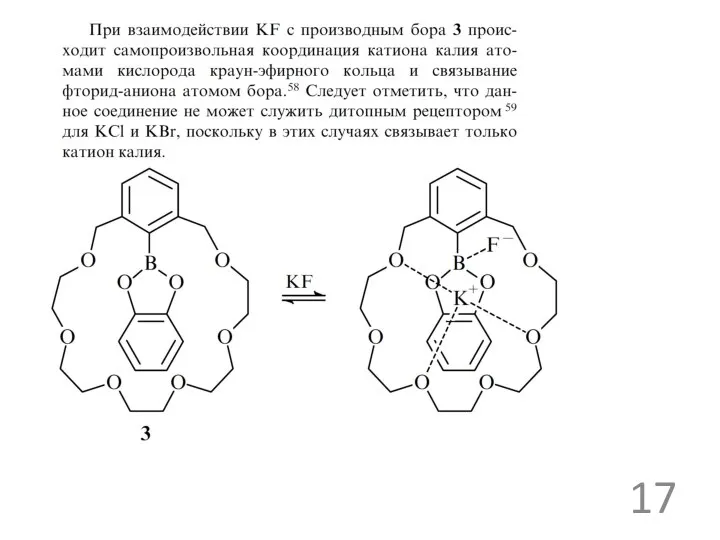
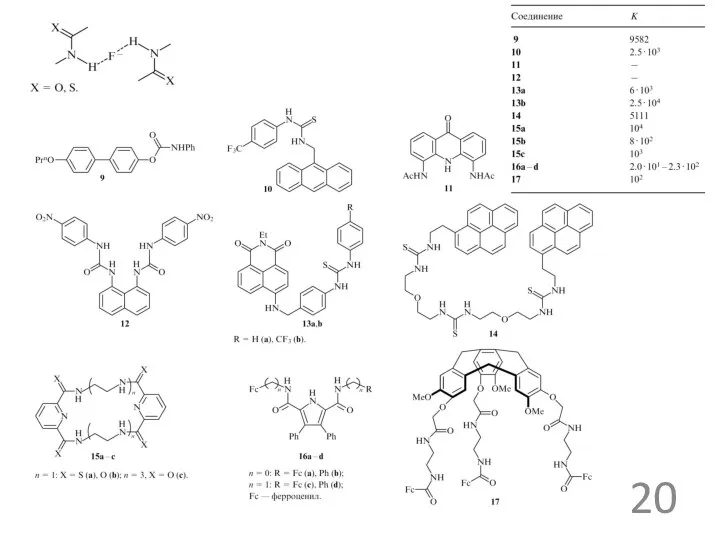
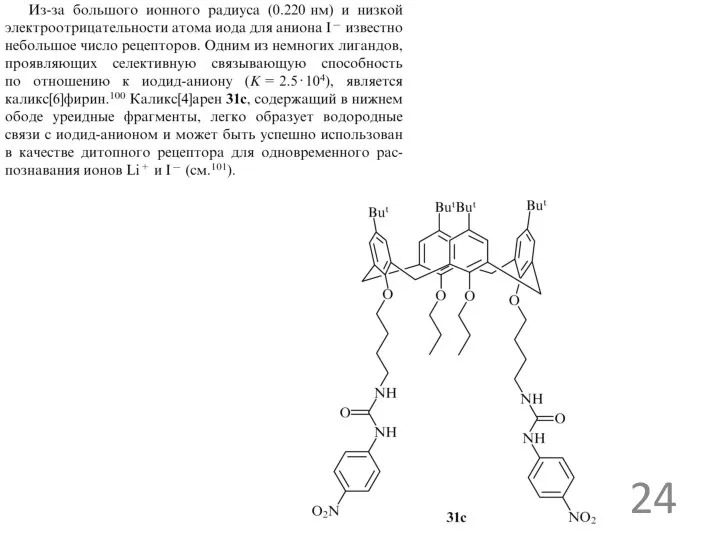
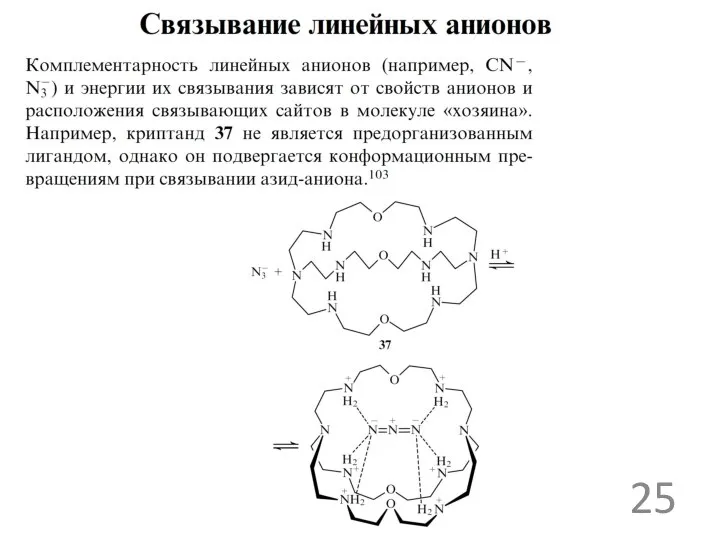
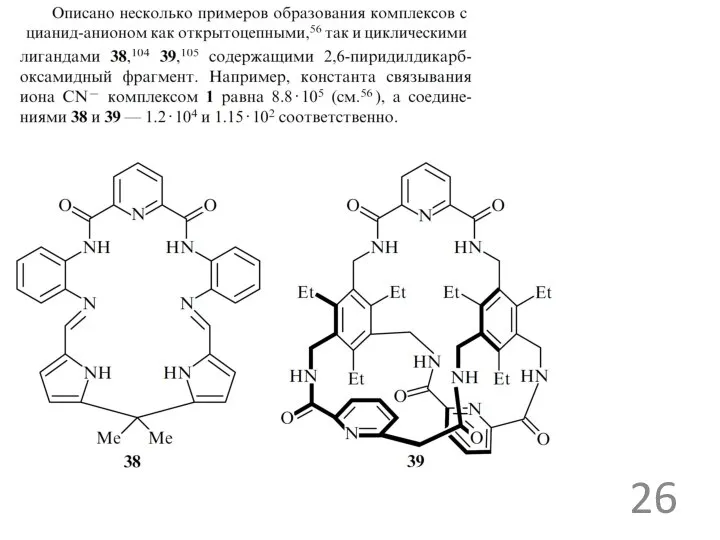
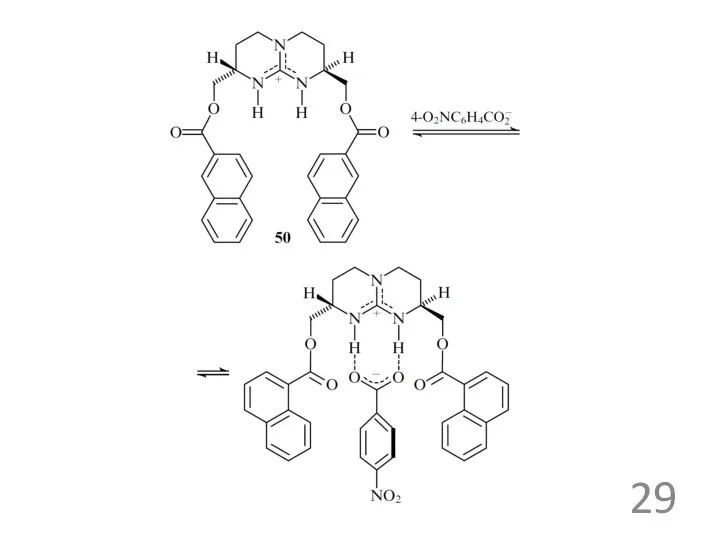
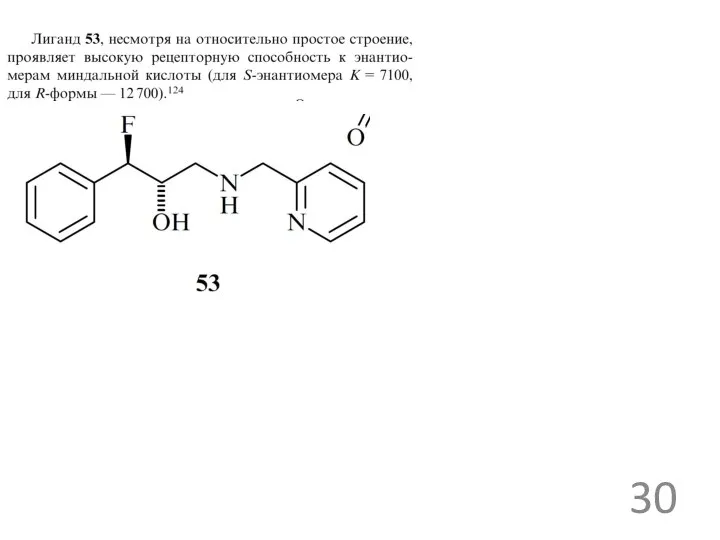
Примеры анионных рецепторов
Примеры анионных рецепторов
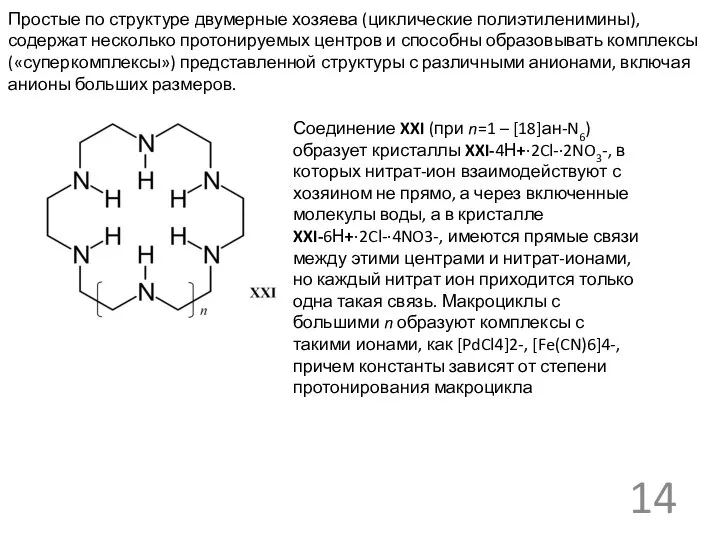
Простые по структуре двумерные хозяева (циклические полиэтиленимины), содержат несколько протонируемых центров
Простые по структуре двумерные хозяева (циклические полиэтиленимины), содержат несколько протонируемых центров
Соединение XXI (при n=1 – [18]ан-N6) образует кристаллы XXI-4Н+·2Cl-·2NO3-, в которых нитрат-ион взаимодействуют с хозяином не прямо, а через включенные молекулы воды, а в кристалле XXI-6Н+·2Cl-·4NO3-, имеются прямые связи между этими центрами и нитрат-ионами, но каждый нитрат ион приходится только одна такая связь. Макроциклы с большими n образуют комплексы с такими ионами, как [PdCl4]2-, [Fe(CN)6]4-, причем константы зависят от степени протонирования макроцикла
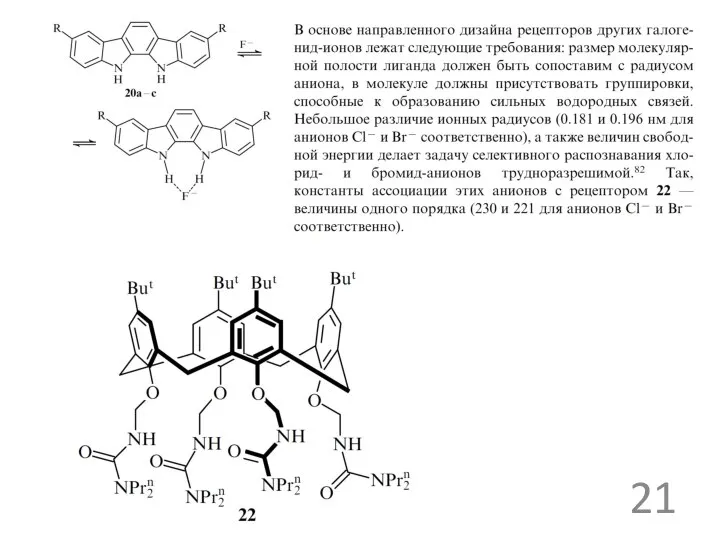
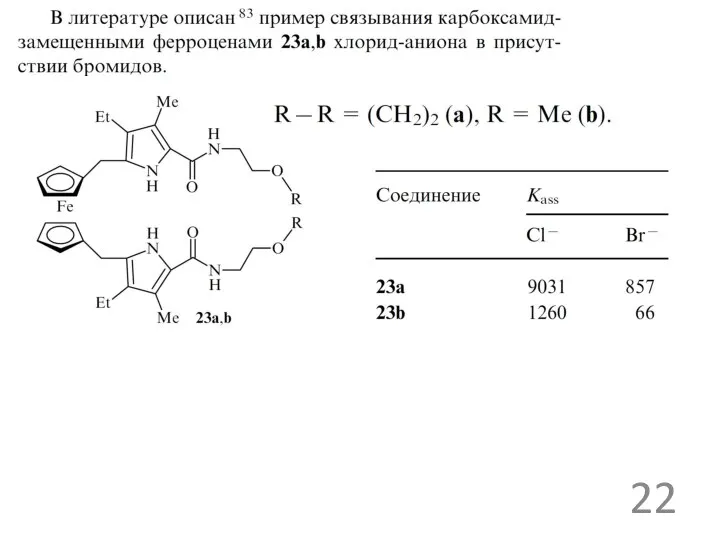
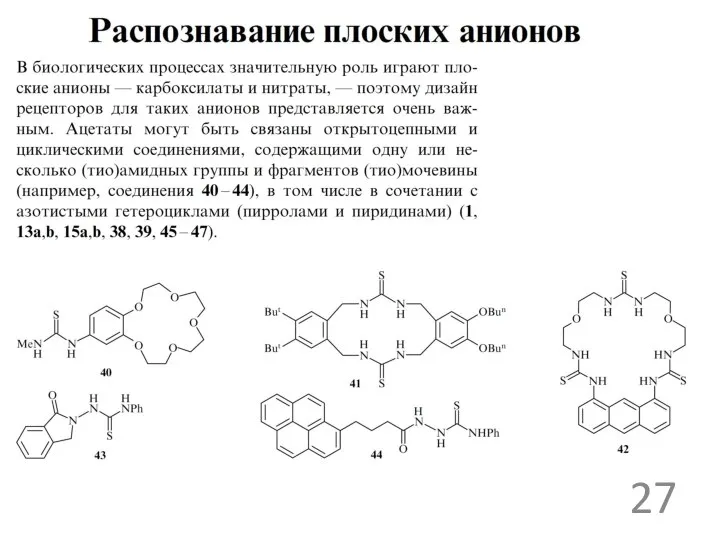
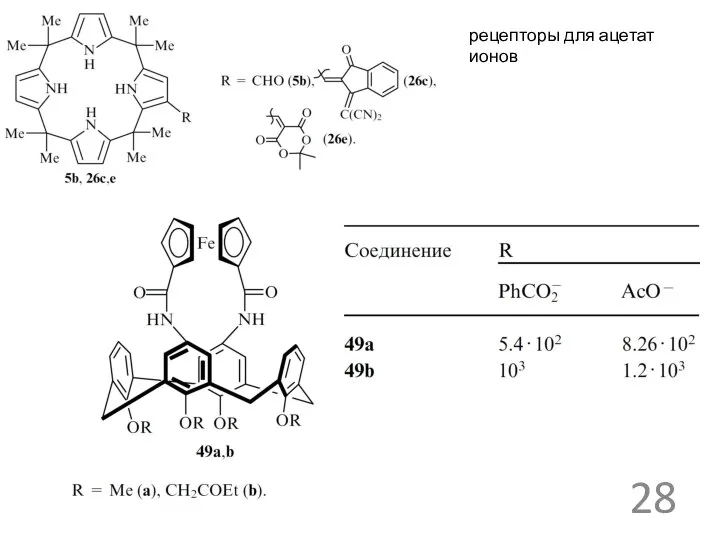
рецепторы для ацетат ионов
рецепторы для ацетат ионов
Циклодекстри́ны — углеводы, циклические олигомеры глюкозы, получаемые
ферментативным путем из крахмала. Они
Циклодекстри́ны — углеводы, циклические олигомеры глюкозы, получаемые
ферментативным путем из крахмала. Они
Циклодекстрины относятся к классу чрезвычайно важных соединений-хозяев, которые широко используются в пищевой, косметической и фармацевтической отраслях промышленности, обычно в качестве агентов для медленного высвобождения и доставки веществ. Они также чрезвычайно важны как имитаторы ферментов. Одно из их преимуществ – абсолютная нетоксичность в широком диапазоне дозировки. Они настолько важны, что им посвящен целый том 11-томного издания “Comprehensive supramolecular chemistry” (J. Atwood et al/ Oxford, “Pergamon”, 1966) – том.3. Промышленное производство наиболее важного представителя семейства циклодекстринов, β-циклодекстрина, составляет
1500 т в год с ценой лишь несколько долларов за 1 кг.
Циклодекстрины различают по количеству остатков глюкозы, содержащихся в одной их молекуле.
Циклодекстрины различают по количеству остатков глюкозы, содержащихся в одной их молекуле.
По свойствам циклодекстрины резко отличаются от обычных (линейных) декстринов. Впервые циклодекстрины были обнаружены М. Вилльером (М.А. Villiers) в 1891 г., исследовавшим продукты метаболизма бактерий Clostridium butyricum, и давшим первое описание этих кристаллических углеводов под названием «целлюлозин» (cellulosine). Наибольший вклад в исследование циклодекстринов внёс позднее (1903—1911 гг.) Ф. Шардингер (F. Schardinger), в честь которого они длительное время назывались декстринами Шардингера.
Все циклодекстрины представляют собой белые кристаллические порошки, нетоксичные, практически не имеющие вкуса. Внешне - это белые кристаллические и аморфные субстанции. Количество кристаллизационной воды варьирует от 1 до 18 % в зависимости от методов сушки и приготовления препарата.
Циклодекстрин, молекулы которого состоят из 5 глюкопиранозных звеньев, ферментативными методами до
Циклодекстрин, молекулы которого состоят из 5 глюкопиранозных звеньев, ферментативными методами до
5,10,15,20,25,30,35-гептакис(гидроксиметил)-2,4,7,9,12,14,17,19,22, 24,27,29,32,34-тетрадекаоксаоктацикло-[31.2.2.23,6.28,11.218,21.223,26.228,31]нонатртраконтан-36,37,38,39,40,41,42,43,44,45,46,47,48,49-тетрадекаол.
В литературе имеется сообщение о проведение синтеза α-циклодекстрина в 21 стадию с суммарным выходом 0.3 % и γ-циклодекстрина с выходом 0.02 %.
При трансформации крахмала в циклодекстрины с помощью микробного фермента циклодекстринглюканотрансферазы (ЦГТазы) также образуются циклические сахара, имеющие девять, десять, одиннадцать и более (до 30—60) остатков глюкозы в цикле и обозначаемые соответствующими буквами греческого алфавита σ, ε, ζ, η, θ и т. д. Это так называемые крупнокольцевые (large-ring) циклодекстрины
Геометрически молекулы циклодекстринов имеют форму усеченного конуса (тора),
полого внутри, в котором
Геометрически молекулы циклодекстринов имеют форму усеченного конуса (тора),
полого внутри, в котором
Ф. Крамер в 1954 г. впервые показал, что ЦД могут образовывать
Ф. Крамер в 1954 г. впервые показал, что ЦД могут образовывать
является предметом дискуссии [8,9]. Наиболее вероятными представляются ван-дер-ваальсовы силы, гидрофобные взаимодействия и др., что позволяет отнести эти комплексы к объектам супрамолекулярной химии
Циклодекстрины химически устойчивы, относятся к невосстанавливаемым углеводам. Они могут быть модифицированы
Циклодекстрины химически устойчивы, относятся к невосстанавливаемым углеводам. Они могут быть модифицированы
Перацетилированные циклодекстрины растворимы только в органических растворителях.
Эти свойства являются важными для использования при экстракции, в катализе и т.д. Например, гептакис-2,3,6-С-пентил циклодекстрин используется в качестве активной добавки в подвижную фазу в энантиоселективной хроматографии.
Внутренняя полость циклодекстринов является гидрофобной и способна образовывать в водных растворах комплексы включения с другими молекулами органической и неорганической природы. В комплексах включения кольцо циклодекстрина является «молекулой хозяином», включённое вещество называют «гостем».
Обычно взаимодействие циклодекстрина с неполярной молекулой-гостем приводит к образованию молекулярных соединений включения состава 1:1, в котором гость встроен в полость циклодекстрина.
Комплексы включения в воде диссоциируют на циклодекстрин и исходное вещество, проявляя
Комплексы включения в воде диссоциируют на циклодекстрин и исходное вещество, проявляя
В процессе образования комплексов меняются многие исходные свойства включаемых соединений. Нерастворимые в воде вещества, приобретают большую растворимость, становятся стабильными в процессах окисления и гидролиза, меняют вкус, цвет и запах. Из жидкостей и даже некоторых благородных газов могут быть получены порошкообразные соединения, из маслообразных веществ - полностью растворимые в воде препараты (например, жирорастворимые витамины). Известнен случай включения катиона Na+ в две молекулы краун-эфиров, которые, в свою очередь, включены в пару γ-циклодекстриновых полостей («русская кукла» или «матрешка»)
Канальная структура комплекса γ-СD c [Na(12-краун-4)2]
Использование циклодекстринов для разделения энантиомеров в условиях обращено-фазовой хроматографии перспективно, поскольку
Использование циклодекстринов для разделения энантиомеров в условиях обращено-фазовой хроматографии перспективно, поскольку
наилучшие результаты получены при использовании подвижных фаз, содержащих циклодекстрин на пределе его растворимости (порядка 20 ммоль/л) с добавками триэтаноламина и уксусной кислоты, регулирующими процесс комплексообразования. Если разделение энантиомеров псевдоэфедрина удается
выполнить, то пара энантиомеров эфедрина в использованных составах подвижной фазы почти не разделялась
Около 80 — 90% полученных в промышленности циклодекстринов (в основном бета-CD)
Около 80 — 90% полученных в промышленности циклодекстринов (в основном бета-CD)
пример. Количество луковой приправы для пикантного овечьего сыра можно снизить от 550 г (на 100 порций) до 10 г, если эта специя связана в виде комплекса с β-циклодекстрином. Подобная стабилизация достигается в случае пищевых красителей и пигментов, которые могут разлагаться фотолитически или при изменении рН. Привлекательность циклодекстринов для производителей пищевых продуктов возрастает еще более, если учесть преимущества переработки и взвешивания (сухой порошок в противоположность летучему маслу), которые снижают цены при упаковке и хранении, а также вероятность микробного загрязнения.
циклодекстрины также применяют в фармацевтической промышленности в качестве систем доставки лекарств.
циклодекстрины также применяют в фармацевтической промышленности в качестве систем доставки лекарств.
ЦД играют роль своеобразных нанокапсул, служащих не только для хранения и транспорта молекул фармакологически активных веществ, но и позволяющих менять в желательную сторону агрегатное состояние инкапсулируемых соединений, получая из жидкостей и газов кристаллические вещества, снижать или полностью устранять их гидрофобность, на порядки повышать раствори-
мость в воде . Известные лекарственные препараты в комплексах включения с молекулами ЦД или их химическими производными приобретают новые полезные свойства, не свойственные исходным, что усиливает их лечебный эффект. Изменения могут быть настолько выраженными, что новые препаративные формы даже не могут быть отнесены к дженерикам
![Строение катапинанда - 1,11-диазабицикло[9.9.9]нонакозана Отправной точкой в области нековалентной координационной химии](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1392639/slide-1.jpg)

















 Теория нитрования
Теория нитрования Биохимия и молекулярная биология. Биосинтез липидов. Лекция 8
Биохимия и молекулярная биология. Биосинтез липидов. Лекция 8 Мұнай
Мұнай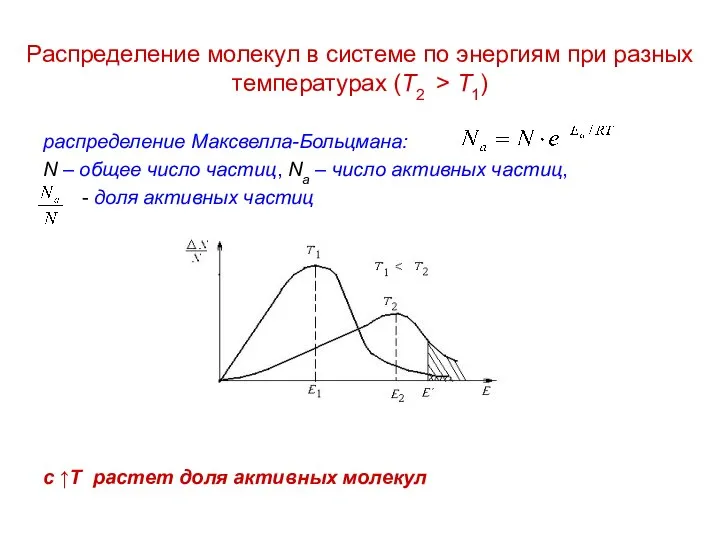 Распределение молекул в системе по энергиям при разных температурах
Распределение молекул в системе по энергиям при разных температурах Флокуляційне очищення питної води за допомогою катіонних та аніонних флокулянтів
Флокуляційне очищення питної води за допомогою катіонних та аніонних флокулянтів Определение активной реакции воды (рН)
Определение активной реакции воды (рН) Introduction in bioorganic chemistry. Isomerism and structure of organic compounds
Introduction in bioorganic chemistry. Isomerism and structure of organic compounds Смесители. Пропеллерная мешалка
Смесители. Пропеллерная мешалка Образовательная программа дополнительного образования Химия в центре наук
Образовательная программа дополнительного образования Химия в центре наук Химические свойства полимеров
Химические свойства полимеров Ионообменная хроматография
Ионообменная хроматография Аминокислоты. История их открытия
Аминокислоты. История их открытия Жиры и мыло
Жиры и мыло Оксиды азота (II и IV). Азотная кислота. Строение молекулы
Оксиды азота (II и IV). Азотная кислота. Строение молекулы Презентация по Химии "Презентация Дисперсия света" - скачать смотреть
Презентация по Химии "Презентация Дисперсия света" - скачать смотреть  Характерные свойства простых веществ-неметаллов
Характерные свойства простых веществ-неметаллов Углероды: их роль и значение в жизни человека
Углероды: их роль и значение в жизни человека Комплексные соединения
Комплексные соединения Углеводы. Общие представления об углеводах
Углеводы. Общие представления об углеводах Мұнай эмульсиясының құрамы және фаза аралық беттерінің құрылымы. Эмульсия инверсиясы
Мұнай эмульсиясының құрамы және фаза аралық беттерінің құрылымы. Эмульсия инверсиясы Решение задач. Алкины
Решение задач. Алкины Растворы. Общая характеристика растворов
Растворы. Общая характеристика растворов Важнейшие классы неорганических соединений
Важнейшие классы неорганических соединений Ацетилен
Ацетилен Ферментативные методы анализа
Ферментативные методы анализа Сульфаты. Лекция 13
Сульфаты. Лекция 13 Поверхностная модификация дисперсных систем
Поверхностная модификация дисперсных систем Кам'яне вугі́лля
Кам'яне вугі́лля