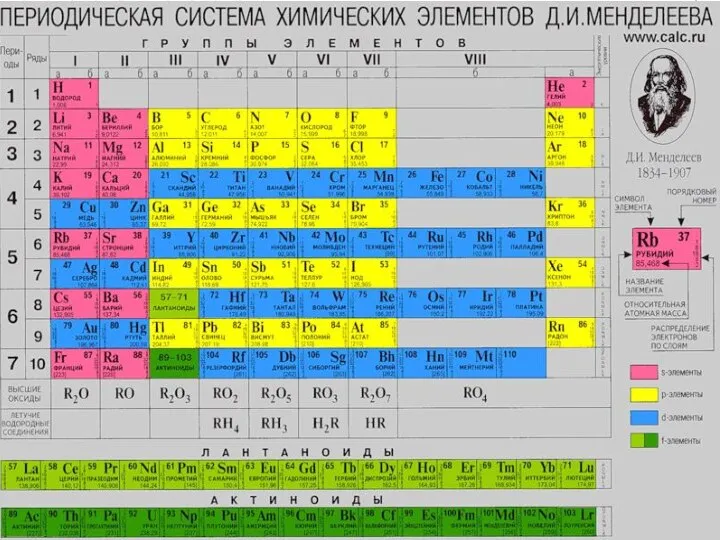
Содержание
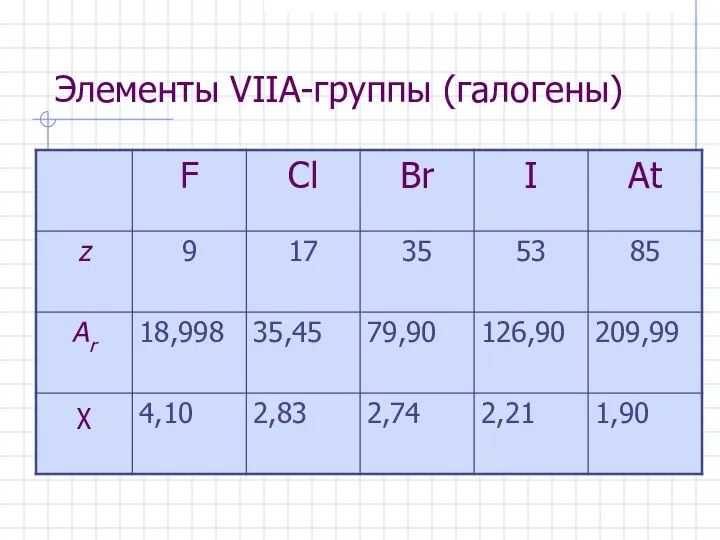
- 3. Элементы VIIА-группы (галогены) Общая электронная формула: […] ns 2 (n–1)d 10np 5 Ei ≈ 1700 кДж/моль
- 4. Элементы VIIА-группы (галогены)
- 5. Простые вещества: F2, Cl2, Br2, I2, At2 Иод Бром Фтор Хлор
- 6. Фтор: распространение в природе Кларк 0,03% Флюорит (плавиковый шпат) CaF2 Криолит Na3[AlF6] Фторапатит 3Ca3(PO4)2 · CaF2
- 7. Кристаллы флюорита
- 8. Фтор F2 т.пл. –220 °С, т.кип. –183 °С Э + F2 → Э+νFν–I (ν - высшая
- 9. Соединения фтора. Фтороводород Фтороводород HF : (HF)n т.кип. +19,5 °С, неограниченно растворим в воде Автопротолиз: H2F2
- 10. Фтороводород SiO2 + 4HF(г) = SiF4↑ + 2H2O (травление стекла) SiO2 + 6HF (изб.) = =H2[SiF6]
- 11. Открытие фтора Фтор впервые получен в 1886 г. (А. Муассан, электролиз смеси HF и KF)
- 12. Получение фтора и фтороводорода В промышленности: электролиз расплава KHF2 (т. пл. 239 °C) или KH2F3 (т.
- 13. Применение Водоподготовка (обеззараживание воды фторированием) Фторуглеродные соединения (фреоны, фторкаучуки, фторопласты (тефлоны) и т.п. HF: получение синтетического
- 14. Галогены в природе 11. Хлор (0,19%) 43. Бром 70. Иод 94. Астат Редкие рассеянные элементы Галит
- 15. Редкие минералы Бромаргирит AgBr Иодаргирит AgI Лаутарит Ca(IO3)2 Диэтзеит 7Ca(IO3)2·8CaCrO4
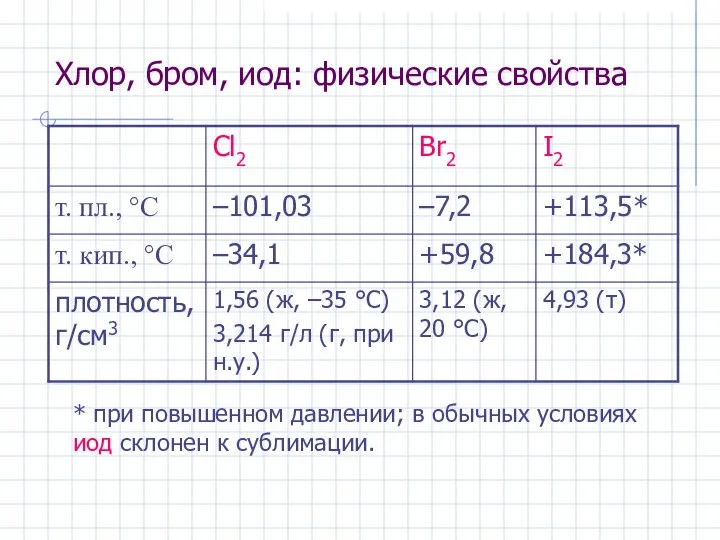
- 16. Хлор, бром, иод: физические свойства * при повышенном давлении; в обычных условиях иод склонен к сублимации.
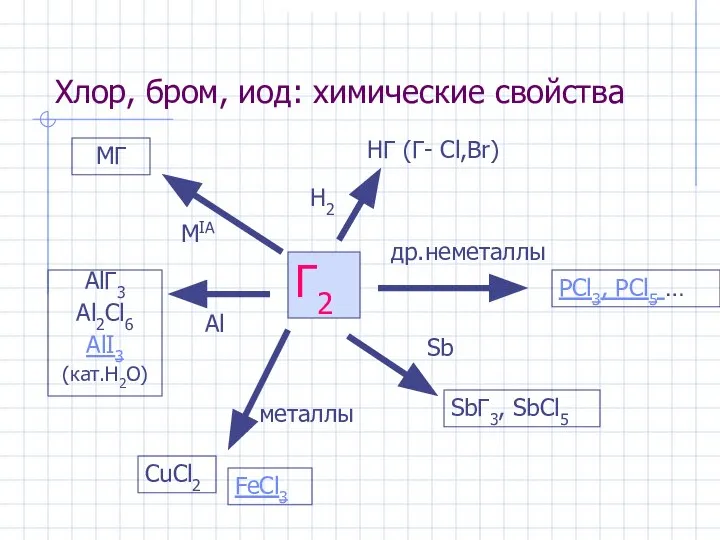
- 17. Хлор, бром, иод: химические свойства Г2 MIA MГ Al AlГ3 Al2Cl6 AlI3 (кат.H2O) H2 HГ (Г-
- 18. Г2: Cl Br I (At) Примеры: I2 + конц.к-та → I+IClO4 I+INO3 I+IHSO4 Cl2 (Br2) +
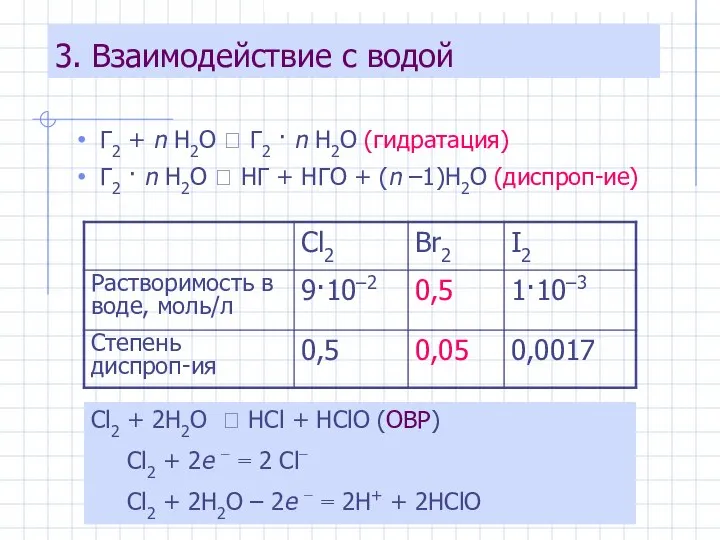
- 19. 3. Взаимодействие с водой Г2 + n H2O ⮀ Г2 · n H2O (гидратация) Г2 ·
- 20. В р-ре KI: KI + I2 (т) = K[I(I)2] I– + I2 (т) = [I(I)2]– дииодоиодат(I)-ион
- 21. В растворах щелочей Br2 + 2KOH = KBr + KBrO + H2O (на холоду) Br2 +
- 22. В органических растворителях Органические растворители, не смешивающиеся с водой, используют для извлечения (экстракции) брома и иода.
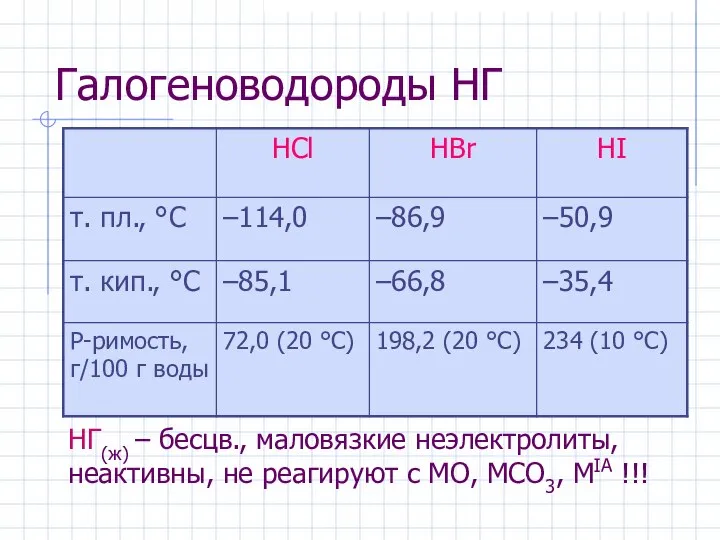
- 23. Галогеноводороды НГ НГ(ж) – бесцв., маловязкие неэлектролиты, неактивны, не реагируют c МО, МCO3, МIA !!!
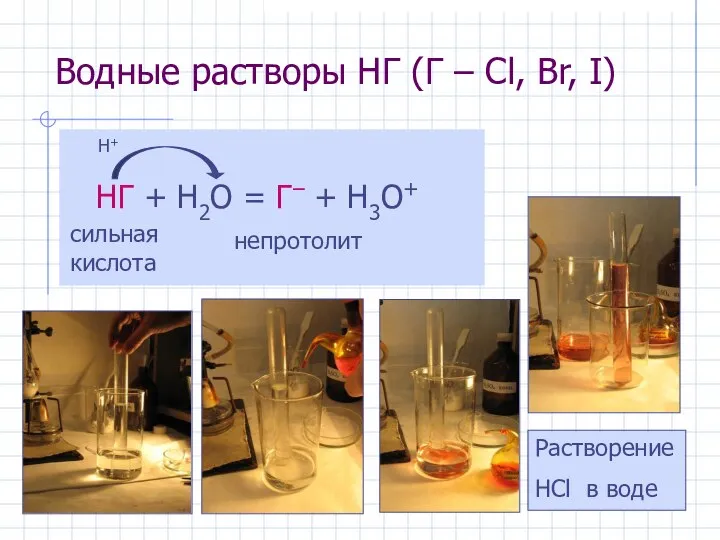
- 24. Водные растворы HГ (Г – Cl, Br, I) НГ + H2O = Г– + H3O+ сильная
- 25. HCl HBr HI HCl + H2SO4(к) ≠ 2HBr + H2SO4(к) = Br2 + SO2↑ + 2H2O
- 26. Получение НCl В промышл. – прямым синтезом: H2 + Cl2 = 2HCl В лаборатории: NaCl +
- 27. Получение НBr и HI В лаборатории и в промышл. усл. – синтез галогенидов фосфора с последующим
- 28. Оксиды галогенов
- 29. Кислородные кислоты
- 30. Взаимодействие с водой В водном растворе HClO, HClO2, HBrO и H5IO6 – слабые кислоты: HClO +
- 31. В щелочной среде – диспропорцио-нируют (дисмутация): 3Г2 + 6NaOH = 5NaГ + NaГO3 + 3H2O Г2
- 33. Скачать презентацию
![Элементы VIIА-группы (галогены) Общая электронная формула: […] ns 2 (n–1)d 10np](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1397689/slide-2.jpg)

![Фтор: распространение в природе Кларк 0,03% Флюорит (плавиковый шпат) CaF2 Криолит Na3[AlF6] Фторапатит 3Ca3(PO4)2 · CaF2](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1397689/slide-5.jpg)










![В р-ре KI: KI + I2 (т) = K[I(I)2] I– +](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1397689/slide-19.jpg)









 Новые наноматериалы. Получение, свойства и применение
Новые наноматериалы. Получение, свойства и применение Дмитрий Иванович Менделеев
Дмитрий Иванович Менделеев Металдардың физикалық қасиеттерін ажырата білу
Металдардың физикалық қасиеттерін ажырата білу Химическое загрязнение акваторий. Основные термины и определения
Химическое загрязнение акваторий. Основные термины и определения Сера. Историческая справка
Сера. Историческая справка Поверхностные явления. Адсорбция
Поверхностные явления. Адсорбция Высокоэффективная жидкостная препаративная хроиматография
Высокоэффективная жидкостная препаративная хроиматография G11. Химический состав
G11. Химический состав Презентация к уроку окружающего мира по теме: ,,Про воздух и про воду” Цель урока: знакомство учеников с богатствами природы - воздухом и водой, их свойствами. Задачи: Продолжить расширение и углубление представлений
Презентация к уроку окружающего мира по теме: ,,Про воздух и про воду” Цель урока: знакомство учеников с богатствами природы - воздухом и водой, их свойствами. Задачи: Продолжить расширение и углубление представлений  Исследовательская работа по теме: « Волшебные жидкости – вещества определители или как определить вкус веществ не пробуя их»
Исследовательская работа по теме: « Волшебные жидкости – вещества определители или как определить вкус веществ не пробуя их»  Гетероциклді қосылыстар. Алкалоидтар
Гетероциклді қосылыстар. Алкалоидтар Электрохимиялық және химиялық коррозия
Электрохимиялық және химиялық коррозия Производные пиримидина
Производные пиримидина Плазменное состояние вещества
Плазменное состояние вещества Переработка нефти. (10 класс)
Переработка нефти. (10 класс) Получение дезинфицирующих средств
Получение дезинфицирующих средств Аттестационная работа. Методическая разработка спецкурса по химии для 8 класса Мир открытий. Вещества, окружающие нас в быту
Аттестационная работа. Методическая разработка спецкурса по химии для 8 класса Мир открытий. Вещества, окружающие нас в быту Галогены - друзья или враги?
Галогены - друзья или враги? Презентация по Химии "Вода в організмах" - скачать смотреть бесплатно
Презентация по Химии "Вода в організмах" - скачать смотреть бесплатно Składniki odżywcze
Składniki odżywcze Алмазы, искусственный и естественный рост
Алмазы, искусственный и естественный рост Презентация по Химии "Химические антонимы" - скачать смотреть
Презентация по Химии "Химические антонимы" - скачать смотреть  Общая характеристика неметаллов
Общая характеристика неметаллов Адсорбционные равновесия и процессы на подвижных и неподвижных границах раздела фаз
Адсорбционные равновесия и процессы на подвижных и неподвижных границах раздела фаз Электролиты и неэлектролиты
Электролиты и неэлектролиты Химия вопросы и ответы
Химия вопросы и ответы Биосинтез заменимых аминокислот. Деградация нуклеиновых кислот. (Лекция 4)
Биосинтез заменимых аминокислот. Деградация нуклеиновых кислот. (Лекция 4) Сера и ее соединения
Сера и ее соединения