Содержание
- 2. Из общего числа известных в настоящее время элементов в периодической таблице Менделеева 32 являются d-элементами. d-элементы
- 3. Все d-элементы являются металлами, степени окисления которых в соединениях различны. Их наибольшая степень окисления отвечает номеру
- 4. Высшие оксиды d-элементов с V по VIII группы обладают кислотными свойствами, низшие – основными, промежуточные -
- 5. Способность к кислотообразованию и степень диссоциации кислородных кислот у d-элементов увеличивается также как у s- и
- 6. Для большинства d-элементов характерной особенностью является то, что их соединения окрашены. Эта особенность связана с тем,
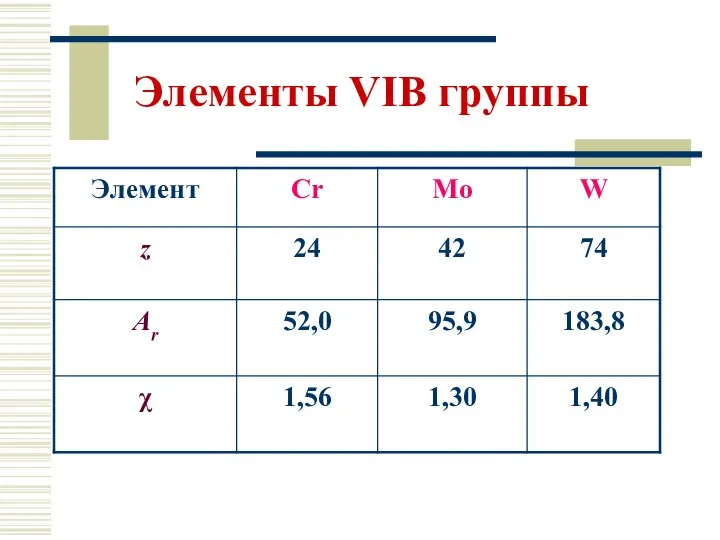
- 7. Элементы VIВ группы
- 9. Надо отметить, что энергия ионизации увеличивается сверху вниз. Вольфрам вследствие лантаноидного сжатия имеет атомный и ионный
- 10. Электронное строение Cr: […] 4s1 3d 5 4p0 Mo: […] 5s1 4d 55p0 W: […] 6s
- 11. Сr, Mo, W – белые блестящие металлы. Они очень тверды и тугоплавки.
- 12. Металлы
- 13. Химически при комнатной температуре эти элементы мало реакционноспособны. В реакцию с O2, галогенами, S, N, P,
- 14. Надо отметить, что Сr растворяется в разбавленных растворах HCl, H2SO4, а Mo и W – в
- 15. Простые вещества Cr + 2H3O+ + 4H2O → [Cr(H2O)6]2+ + H2↑ Mo(W) + H3O+ ≠
- 16. Простые вещества Кислоты-окислители (пассивация на холоду): ЭVIВ + HNO3(конц), H2SO4(конц) ≠ Э (Mo,W) + 2HNO3 +
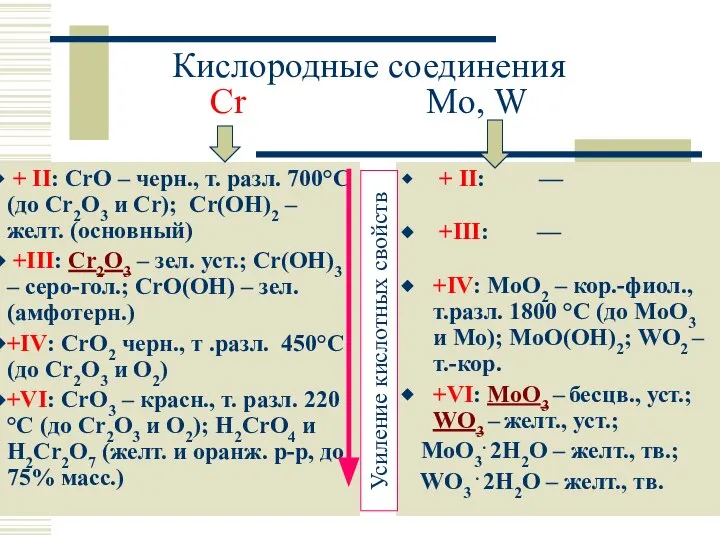
- 17. Кислородные соединения Cr Mo, W + II: CrO – черн., т. разл. 700°C (до Cr2O3 и
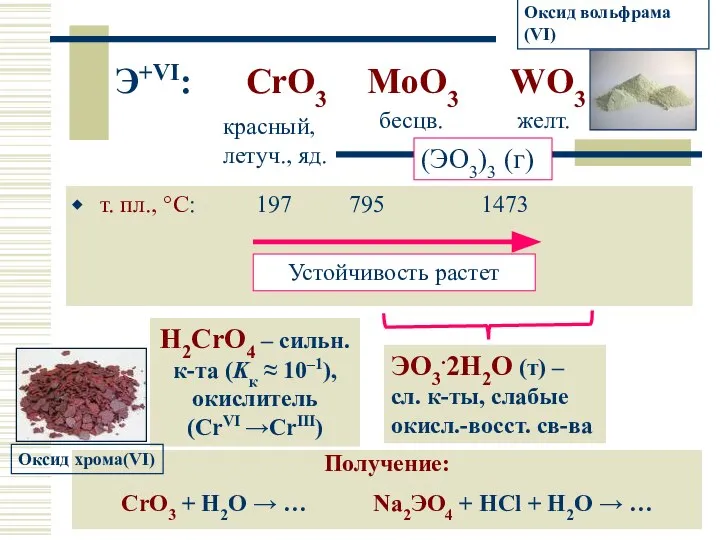
- 18. Э+VI: CrO3 MoO3 WO3 т. пл., °С: 197 795 1473 красный, летуч., яд. бесцв. желт. (ЭO3)3
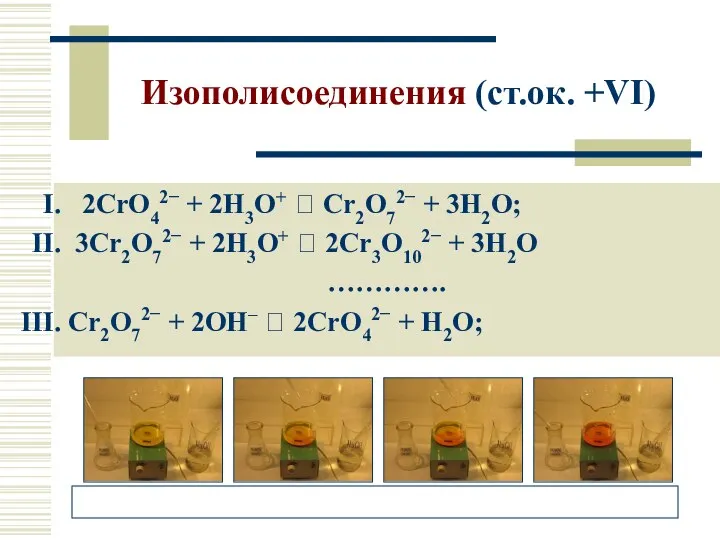
- 19. Изополисоединения (ст.ок. +VI) 2CrO42− + 2H3O+ ⮀ Cr2O72− + 3H2O; 3Cr2O72− + 2H3O+ ⮀ 2Cr3O102− +
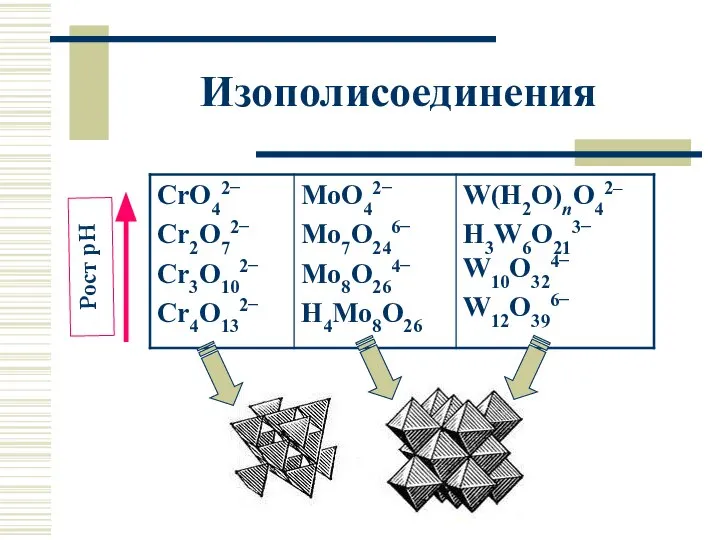
- 20. Изополисоединения
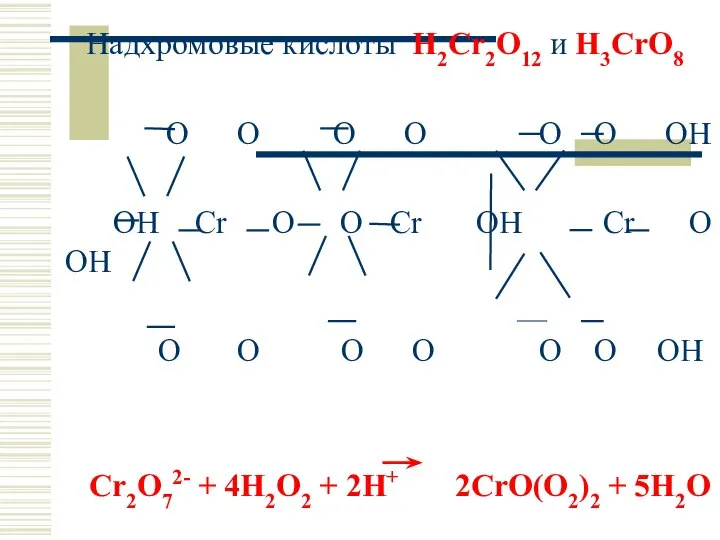
- 21. Пероксокомплексы Cr2O72− + 4H2O2 + 2H3O+ + L → → 2[CrVI(L)O(O22−)2] + 7H2O голубого цвета (экстракция
- 22. Распространение в природе и важнейшие минералы 21. Cr 0,019% масс. 39. Mo 1·10–3% 27. W 7·10–3%
- 23. Минералы гюбнерит MnWO4 повеллит CaMoO4 молибдошеелит Ca(W,Mo)O4 ферберит FeWO4 Хром входит в состав минералов: александрит, рубин,
- 24. Получение Cr2O3 + 2Al = 2Cr + Al2O3 (t°) Fe(CrO2)2 + 4C = Fe + 2Cr
- 25. Для получения чистого хрома сначала получают Cr2O3 (III), а затем восстанавливают его алюмотермическим способом: Cr2O3 +
- 26. Химия хрома. Cr(II) Соединения Cr(II) можно получить: Cr + 2HCl → CrCl2 + H2 Cr+2 неустойчивые
- 27. Для Cr (II) характерен Cr(OH)2, который образуется: CrCl2 + 2NaOH → Cr(OH)2 + 2NaCl желт. цв.
- 28. Cr 2+ образует аквакомплексные соединения [Cr(H2O)6]2+, в состав которых входит ион гексааквахрома (II), придающий раствору синюю
- 29. Соединения Cr (III). Одним из соединений хрома (III) является Cr2O3 – оксид хрома (III) - тугоплавкое
- 30. Следующее соединение, характерное для Cr(III) это Cr(OH)3 Получают: CrCl3 + 3NaOH Cr(OH)3 + 3NaCl Cr(OH)3 –
- 31. Cr(OH)3 растворяется в кислотах с образованием аквакатионных комплексов [Cr(H2O)6]3+ фиолетового цвета: Cr(OH)3 + 3HCl + 3H2O
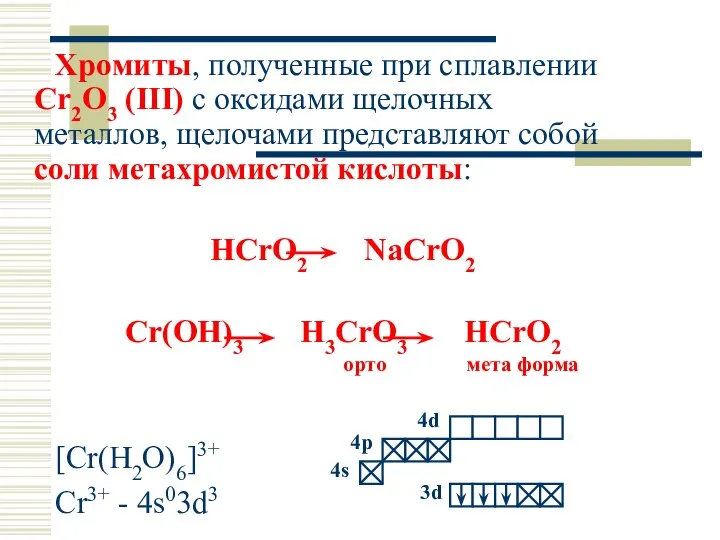
- 32. Хромиты, полученные при сплавлении Cr2O3 (III) с оксидами щелочных металлов, щелочами представляют собой соли метахромистой кислоты:
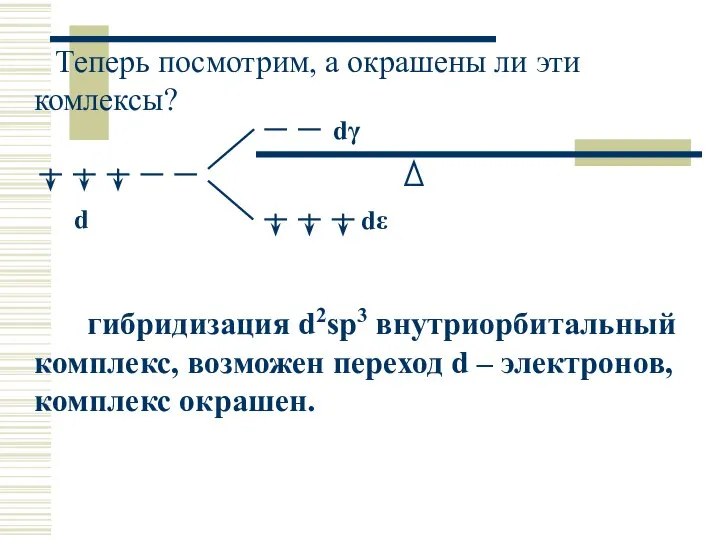
- 33. Теперь посмотрим, а окрашены ли эти комлексы? гибридизация d2sp3 внутриорбитальный комплекс, возможен переход d – электронов,
- 34. Окраска комплексов связана с изомерией – гидратная изомерия хрома: [Cr(H2O)6]Cl3 – сине-фиолетовая [Cr(H2O)5Cl]H2OCl2 – светло-зеленая [Cr(H2O)4Cl2]Cl(H2O)2
- 35. Для Cr(III) характерно образование солей с сильными кислотами CrCl3; Cr2(SO4)3. Из солей Cr(III) самой распространенной солью
- 36. Со слабыми кислотами Cr(III) солей не образует. При попытке получить в водном растворе обменной реакцией Cr2(CO3)3
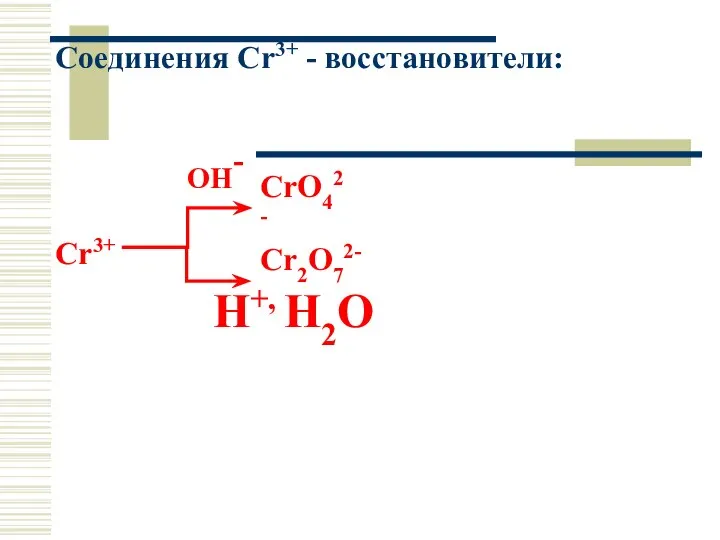
- 37. Соединения Cr3+ - восстановители: OH- Cr3+ H+, Н2О Cr2O72- CrO42-
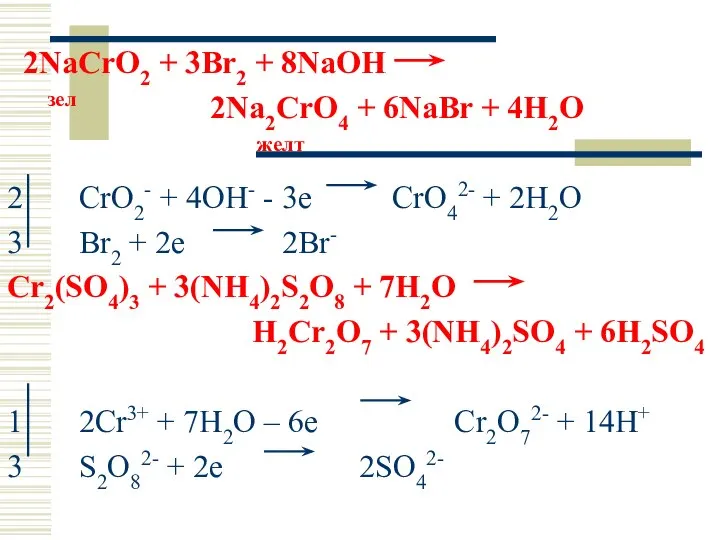
- 38. 2NaCrO2 + 3Br2 + 8NaOH зел 2Na2CrO4 + 6NaBr + 4H2O желт 2 CrO2- + 4OH-
- 39. Соединения Cr (VI) Важнейшими соединениями Cr(VI) являются CrO3 – оксид хрома (VI) – хромовый ангидрид –
- 40. Соли хромовой кислоты – хроматы, двухромовой – дихроматы. Хроматы – желтого цвета, дихроматы – оранжевого. При
- 41. Переход выражается уравнением: 2CrO42- + 2H+ Cr2O72- + H2O Реакция обратима. Это значит, что при растворении
- 42. Если к раствору дихромата прибавить гидроксид, то OH- - ионы будут связывать находящиеся в растворе H+,
- 43. Хроматы щелочных металлов получаются путем окисления соединений Cr(III) в присутствии щелочи. Например, при действии брома на
- 44. Хроматы щелочных металлов хорошо растворимые в воде соединения. Растворимость хроматов щелочно-земельных металлов уменьшается. Хроматы и дихроматы
- 45. Разложение дихромата аммония (NH4)2Cr2O7 = Cr2O3 + N2 + 4H2O «Дихроматный вулкан» (видеофрагмент)
- 46. В кислых и щелочных растворах соединения хрома (III) и Cr(VI) существуют в разных формах: кислая среда
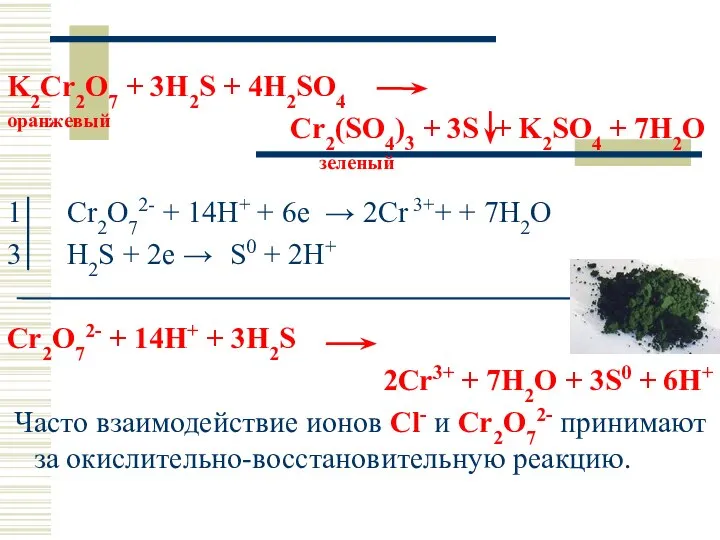
- 47. K2Cr2O7 + 3H2S + 4H2SO4 оранжевый Cr2(SO4)3 + 3S + K2SO4 + 7H2O зеленый 1 Cr2O72-
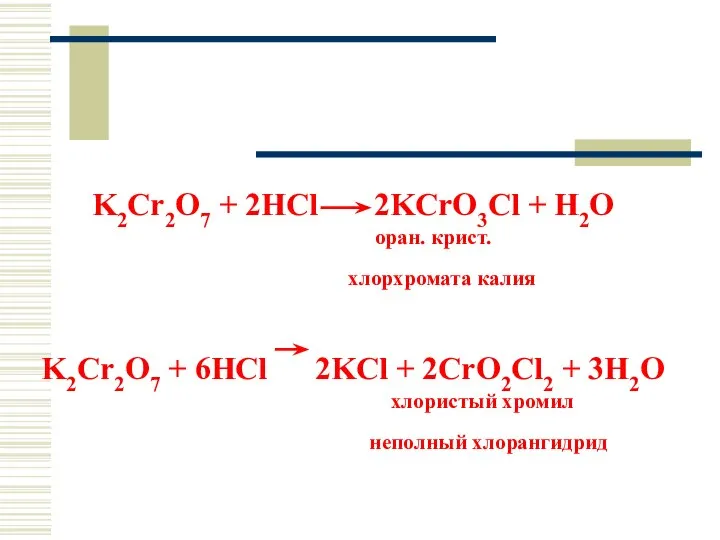
- 48. K2Cr2O7 + 2HCl 2KCrO3Cl + H2O оран. крист. хлорхромата калия K2Cr2O7 + 6HCl 2KCl + 2CrO2Cl2
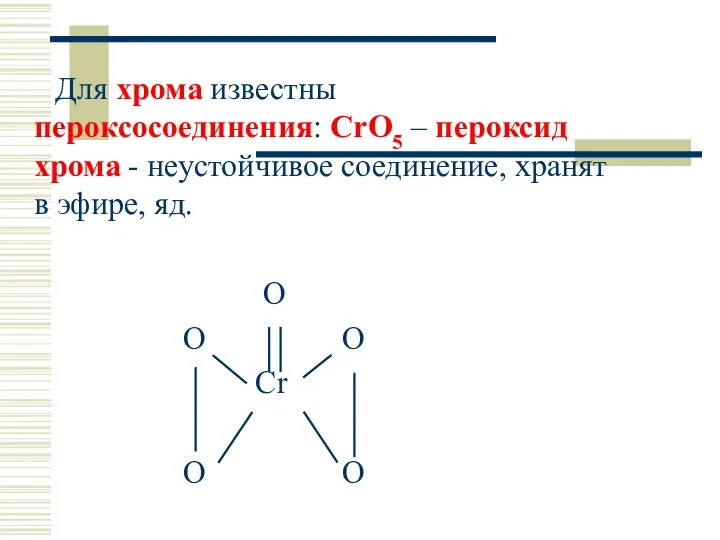
- 49. Для хрома известны пероксосоединения: CrO5 – пероксид хрома - неустойчивое соединение, хранят в эфире, яд. O
- 50. Надхромовые кислоты H2Cr2O12 и H3CrO8 O O O O O O OH OH Cr O O
- 51. CrO5 – неустойчивое соединение в воде, поэтому в реакционную смесь добавляют диэтиловый эфир или амиловый спирт.
- 52. БИОЛОГИЧЕСКАЯ РОЛЬ ХРОМА И МОЛИБДЕНА.
- 53. Хром входит в состав крови, головного мозга, молока, фермента пепсина. При его недостатке замедляется рост животных,
- 54. При недостаточном поступлении его с пищей, уменьшается чувствительность тканей к действию гормона поджелудочной железы-инсулину, ухудшаеся усвоение
- 55. Хром применяется в сплавах для изготовления медицинских инструментов – хирургических ножей, скальпелей, для изготовления зубных коронок,
- 56. Фототурбидиметрия (использование реакции взаимодействия фосфорно-вольфрамовой кислоты с аминосоединениями с образованием дисперсной системы).
- 57. Молибден жизненно необходимый элемент, входит в состав 7 ферментов (ксантиндегидрогеназа, ксантиноксидаза, альдогидроксидаза и др.) При дефиците
- 59. Скачать презентацию






![Электронное строение Cr: […] 4s1 3d 5 4p0 Mo: […] 5s1](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1397697/slide-9.jpg)




![Простые вещества Cr + 2H3O+ + 4H2O → [Cr(H2O)6]2+ + H2↑ Mo(W) + H3O+ ≠](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1397697/slide-14.jpg)

![Пероксокомплексы Cr2O72− + 4H2O2 + 2H3O+ + L → → 2[CrVI(L)O(O22−)2]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1397697/slide-20.jpg)






![Cr 2+ образует аквакомплексные соединения [Cr(H2O)6]2+, в состав которых входит ион](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1397697/slide-27.jpg)


![Cr(OH)3 растворяется в кислотах с образованием аквакатионных комплексов [Cr(H2O)6]3+ фиолетового цвета:](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1397697/slide-30.jpg)
![Окраска комплексов связана с изомерией – гидратная изомерия хрома: [Cr(H2O)6]Cl3 –](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1397697/slide-33.jpg)

















 Составление уравнений ОВР
Составление уравнений ОВР Полиимиды: синтез, свойства и применение. Полиимидоамиды, полиимидоэфиры
Полиимиды: синтез, свойства и применение. Полиимидоамиды, полиимидоэфиры Органічні речовини в живій природі
Органічні речовини в живій природі  Обмен нуклеотидов
Обмен нуклеотидов Кварц, опал, халцедоны, кварцсодержащие горные породы кремни, яшма, кварциты, окаменелое дерево, глаза
Кварц, опал, халцедоны, кварцсодержащие горные породы кремни, яшма, кварциты, окаменелое дерево, глаза Слайд-шоу. Коррозия металлов и сплавов
Слайд-шоу. Коррозия металлов и сплавов Гибридизация электронных орбиталей и геометрия молекул
Гибридизация электронных орбиталей и геометрия молекул Презентацию по химии суворовца ФГКОУ 4 взвода 2 роты Мильчакова А.Ю. Презентацию по химии суворовца ФГКОУ 4 взвода 2 роты
Презентацию по химии суворовца ФГКОУ 4 взвода 2 роты Мильчакова А.Ю. Презентацию по химии суворовца ФГКОУ 4 взвода 2 роты  Бензол и его свойства
Бензол и его свойства Периодический закон и периодическая система Д.И. Менделеева. Самостоятельное занятие № 2
Периодический закон и периодическая система Д.И. Менделеева. Самостоятельное занятие № 2 Занимательные задачи по химии
Занимательные задачи по химии Вода - растворитель
Вода - растворитель Гетерофункциональные органические соединения и их производные – метаболиты и биорегуляторы
Гетерофункциональные органические соединения и их производные – метаболиты и биорегуляторы Фосфаттар - минералдар класы - ортофосфорлы қышқыл (Н3РO4) тұздары
Фосфаттар - минералдар класы - ортофосфорлы қышқыл (Н3РO4) тұздары Аминокислоты алифатического ряда и их производные
Аминокислоты алифатического ряда и их производные Типы химических реакций (11 класс)
Типы химических реакций (11 класс) Полипропилен. Молекулалық құрылымы
Полипропилен. Молекулалық құрылымы Хроматография. Классификации хроматографических методов
Хроматография. Классификации хроматографических методов «terra» бағдарламасын пайдаланып төмен көміртекті феррохромды балқыту кезінде фазалық жағдайлардың
«terra» бағдарламасын пайдаланып төмен көміртекті феррохромды балқыту кезінде фазалық жағдайлардың углерод и его свойства
углерод и его свойства Олигонуклеотидный синтез
Олигонуклеотидный синтез Поверхностно-активные вещества (ПАВ). Классификация, свойства и условия применения
Поверхностно-активные вещества (ПАВ). Классификация, свойства и условия применения Любопытная органическая химия
Любопытная органическая химия Роль органической химии в жизни человека
Роль органической химии в жизни человека Промахи, q-критерий. Сравнение воспроизводимости двух серий данных. Сравнение двух средних
Промахи, q-критерий. Сравнение воспроизводимости двух серий данных. Сравнение двух средних Высокомолекулярные соединения полимеры
Высокомолекулярные соединения полимеры Соединения галогенов.
Соединения галогенов. Решение задач. Способы выражения состава раствора
Решение задач. Способы выражения состава раствора