Содержание
- 2. План лекции Общие понятия Классификация термодинамических систем Первый закон термодинамики Энтальпия Тепловой эффект химической реакции Закон
- 3. Виды энергетических эффектов Практически любая реакция сопровождается энергетическим эффектом: Выделением или поглощением тепла Света Электричества Совершением
- 4. Предмет химической термодинамики Изучает законы, которые управляют энергетическими эффектами химических и биохимических реакций Переход энергии из
- 5. Особенности химической термодинамики Имеет дело только с макроскопическими объектами Не использует в своих законах понятие времени
- 6. Термодинамическая система Произвольно выбранная часть пространства, заполненная одним или совокупностью нескольких веществ и отделенная от окружающей
- 7. Термодинамические параметры системы Объем системы Масса системы Масса или концентрация компонентов Температура Давление
- 8. Функции состояния системы Энергетические характеристики, которые зависят от термодинамических параметров, характеризующих состояние, и не зависят от
- 9. Классификация систем Изолированная – система не обменивается с внешней средой ни энергией, ни веществом Закрытая –
- 10. Гомогенная – система, которая включает в себя один или несколько компонентов в одном агрегатном состоянии, не
- 11. Первый закон термодинамики Это частное выражение более общего закона природы о сохранении материи и ее движения
- 12. Математическое выражение Для изолированной системы общий запас внутренней энергии остается постоянным ΔЕ = 0 Для закрытой
- 13. Полная энергия системы Кинетическая – энергия движения системы как целого Потенциальная – энергия, обусловленная положением системы
- 14. Внутренняя энергия (Е) Кинетическая энергия поступательного, вращательного и колебательного движения частиц в системе Потенциальная энергия взаимодействия
- 15. Формы обмена энергией Работа – упорядоченная форма передачи энергии, сопровождающаяся переносом частиц вещества в определенном направлении
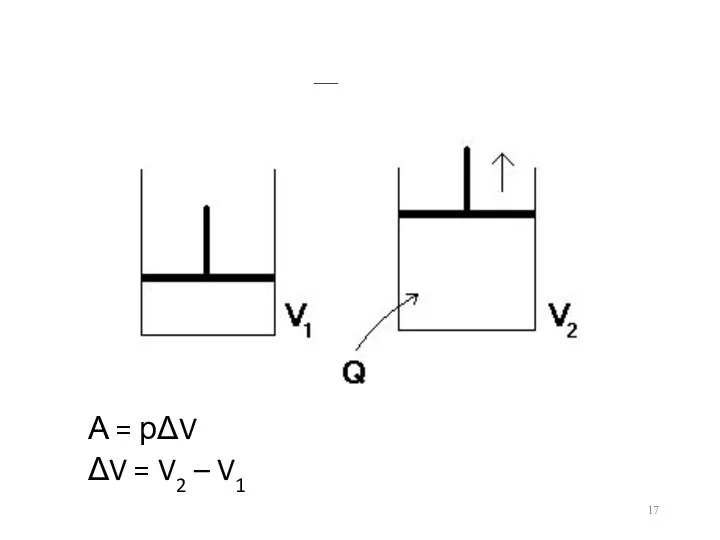
- 16. Работа В химических процессах наиболее часто встречается механическая работа, связанная с преодолением внешнего давления, действующего на
- 17. Пример А = рΔV ΔV = V2 – V1
- 18. Тепловой эффект химической реакции Относят к 1 молю вещества и к определенному агрегатному состоянию Реакция эндотермическая:
- 19. Примеры тепловых эффектов Значение тепловых эффектов химических реакций колеблется от 4 до 4000 кДж/моль
- 20. Энтальпия (теплосодержание) Н Химические реакции могут протекать: При постоянном давлении – изобарные процессы При постоянном объеме
- 21. Большинство реакций – изобарные. Для них: Q = ΔE + A; A = pΔV Q =
- 22. Определение Энтальпия – функция состояния, приращение которой равно теплоте, полученной системой в изобарном процессе Для термохимических
- 23. Стандартная энтальпия образования вещества (ΔН°298) Для сложного вещества: изменение энтальпии системы ΔН, сопровождающееся образованием 1 моля
- 24. Стандартные теплоты образования некоторых соединений
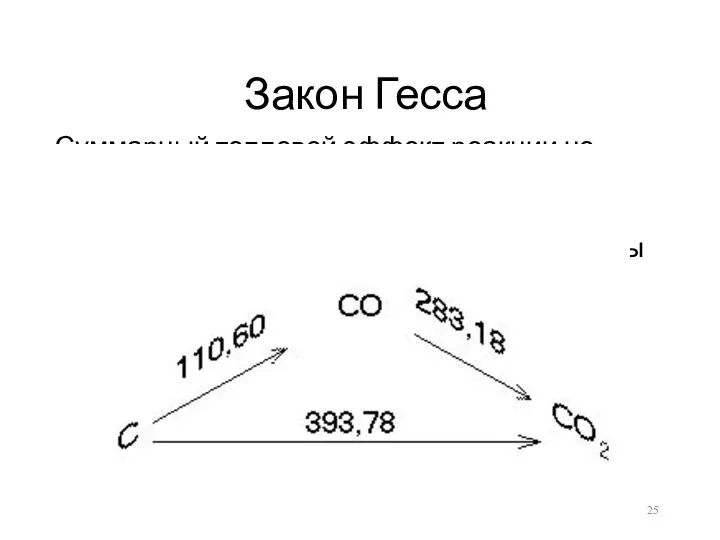
- 25. Закон Гесса Суммарный тепловой эффект реакции не зависит от промежуточных состояний и путей перехода, а зависит
- 26. Следствия из закона Гесса №1. Тепловой эффект реакции равен разности сумм теплот образования продуктов реакции и
- 27. №3. Тепловой эффект образования вещества равен тепловому эффекту разложения с обратным знаком (частный закон Лавуазье-Лапласа) ΔН°298
- 28. №5. Если протекают 2 реакции, из разных начальных состояний приводящие к одинаковым конечным, то разница тепловых
- 29. Применение I закона термодинамики к живым организмам Живой организм – открытая система Энергия не продуцируется организмом,
- 30. Виды работ в организме Сокращение мышечных волокон Активный перенос веществ через клеточные мембраны Химическая работа по
- 31. Теплота сгорания 1г пищевых веществ (в кДж) В организме белки сгорают до продуктов неполного окисления, а
- 32. Изучение энергетического баланса организма Калориметрия: Прямая – человека помещают в изолированную камеру, определяют количество теплоты, излучаемой
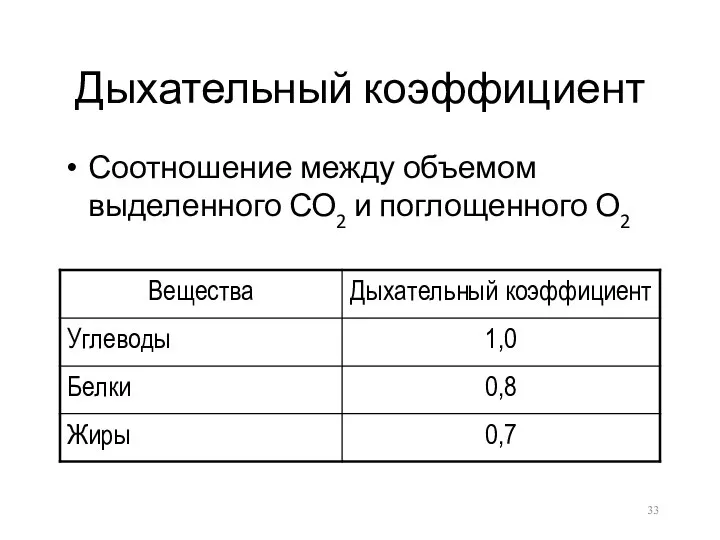
- 33. Дыхательный коэффициент Соотношение между объемом выделенного СО2 и поглощенного О2
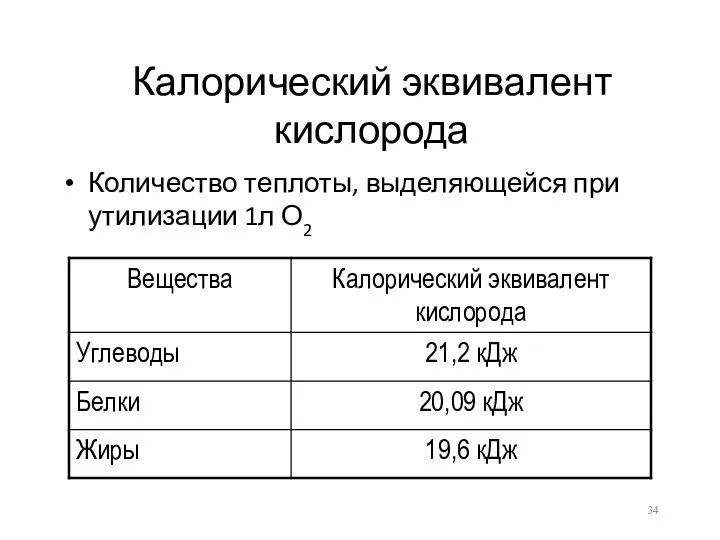
- 34. Калорический эквивалент кислорода Количество теплоты, выделяющейся при утилизации 1л О2
- 36. Скачать презентацию





























 Области применения серной, соляной, азотной, и уксусной кислот
Области применения серной, соляной, азотной, и уксусной кислот Углерод. Металлы. 9 класс
Углерод. Металлы. 9 класс Алюминий и его соединения
Алюминий и его соединения Біогеохімічні цикли та їх еволюція
Біогеохімічні цикли та їх еволюція Презентация Витамин Е
Презентация Витамин Е  Фазовые диаграммы бинарных систем с полиморфными превращениями на примере фазовой диаграммы системы железо-цементит Fe Fe3C
Фазовые диаграммы бинарных систем с полиморфными превращениями на примере фазовой диаграммы системы железо-цементит Fe Fe3C Естествознание. Раздел II. Химия с элементами экологии Урок по теме:
Естествознание. Раздел II. Химия с элементами экологии Урок по теме: Презентация по Химии "Презентация Войди в природу другом" - скачать смотреть
Презентация по Химии "Презентация Войди в природу другом" - скачать смотреть  Презентация по Химии "Пластмаса" - скачать смотреть бесплатно
Презентация по Химии "Пластмаса" - скачать смотреть бесплатно Кислотно-основное титрование. 4 лекция. Часть 2
Кислотно-основное титрование. 4 лекция. Часть 2 Реакции координированных лигандов
Реакции координированных лигандов Экспертные системы распознавания химических веществ
Экспертные системы распознавания химических веществ Презентация по Химии "Глюкоза" - скачать смотреть
Презентация по Химии "Глюкоза" - скачать смотреть  Общие представления об электрохимических технологиях
Общие представления об электрохимических технологиях Основные классы неорганических соединений
Основные классы неорганических соединений Электролиз
Электролиз ГОД ЭКОЛОГИИ-2013
ГОД ЭКОЛОГИИ-2013  Растворы
Растворы Что объединяет вещества. Классификация твёрдых веществ
Что объединяет вещества. Классификация твёрдых веществ Химия и здоровье
Химия и здоровье  Элементный, фракционный и химический состав нефти. Классификация нефтей
Элементный, фракционный и химический состав нефти. Классификация нефтей В чём вкус хлеба?
В чём вкус хлеба? Катализ.Лекция
Катализ.Лекция Антибиотики как ЛС
Антибиотики как ЛС Электропроводность сильно легированных полимеров заметная проводимость в полимерах появляется при достаточно высоком уров
Электропроводность сильно легированных полимеров заметная проводимость в полимерах появляется при достаточно высоком уров КВН В МИРЕ ВЕЩЕСТВ
КВН В МИРЕ ВЕЩЕСТВ Полимерные реагенты в бурении
Полимерные реагенты в бурении Хімічний лабіринт
Хімічний лабіринт