Содержание
- 2. Термодинамика - это отрасль науки, изучающая взаимные превращения различных видов энергии, связанные с переходом энергии в
- 3. Объектом термодинамического исследования есть термодинамическая система. Система - совокупность объектов отделенных из окружающего мира реально существующими
- 4. По взаимодействию с окружающей средой термодинамические системы делят на: открытые – обмениваются с окружающей средой веществом
- 5. Система называется гетерогенной, если в системе есть реальные поверхности раздела , отделяющие друг от друга части
- 6. Первое начало термодинамики
- 7. Состояние системы – совокупность свойств системы, позволяющих определить систему с точки зрения термодинамики. Свойства и состояние
- 8. Внутренняя энергия Каждая термодинамическая система обладает определенным запасом энергии, которая называется внутренней энергией. Внутренняя энергия системы
- 9. Величина внутренней энергии зависит от природы тела, его массы, химического состава и параметров, которые обусловливают состояние
- 10. Первый закон термодинамики 1. Энергия не исчезает без следа и не возникает ни из чего, а
- 11. Первый закон термодинамики при различных термодинамических процессах: Изохорный - происходит при постоянном объеме (V=const) А=р*(V2-V1); ∆V=0;
- 12. Изобарный процесс (р=const) Q=∆U+p∆V Q=(U2-U1)+p(V2-V1) = U2-U1+pV2-pV1= (U2+pV2)-(U1+pV1) H ≡ U+pV – энтальпия – запас энергии
- 13. Термохимические уравнения: Термохимическими называют уравнения в которых кроме формул исходных веществ и продуктов реакции со стехиометрическими
- 14. Тепловым эффектом химической реакции называют максимальное количество теплоты, которая выделяется или поглощается при постоянном объеме или
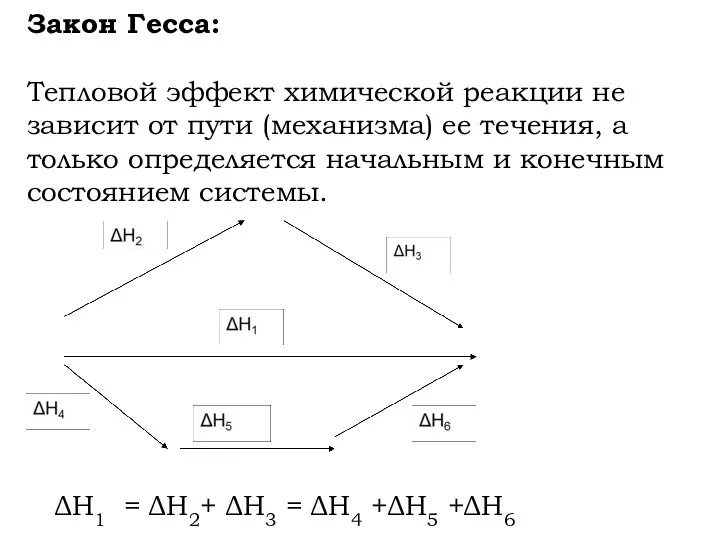
- 15. Закон Гесса: Тепловой эффект химической реакции не зависит от пути (механизма) ее течения, а только определяется
- 16. Самостоятельно повторить пять следствий закона Гесса
- 17. Второе начало термодинамики
- 18. Процессы могут быть: Термодинамически обратимым называется процесс, который можно реализовать в прямом и обратном направлениях при
- 19. Теплота не может сама собой переходить от холодного тела к горячему, не оставляя изменений в окружающей
- 21. 3) Энтропия- мера беспорядка, хаоса в системе. Чем больше ∆T, тем беспорядочнее тепловое движение частиц, следовательно
- 22. В изолированной системе процесс протекает самопроизвольно только, если энтропия возрастает: ∆S≥0 В открытых и закрытых системах
- 23. Свободная энергия Гиббса – функция состояния при изобарно-изотермическом процессе – это та часть энергии, которая может
- 24. Химическое равновесие Обратимая реакция - химическая реакция, которая при одних и тех же условиях может идти
- 25. В состоянии химического равновесия ∆G = 0 Существует полезное соотношение, связывающее изменение свободной энергии Гиббса ∆G
- 27. Скачать презентацию























 Антагонист ГК рецепторов
Антагонист ГК рецепторов ФИЗИЧЕСКИЕ И ХИМИЧЕСКИЕ СВОЙСТВА ОСНОВАНИЙ 8 класс Презентация учителя химии МКОУ «СОШ №85» г. Тайшет Никитюк Л.Ф.
ФИЗИЧЕСКИЕ И ХИМИЧЕСКИЕ СВОЙСТВА ОСНОВАНИЙ 8 класс Презентация учителя химии МКОУ «СОШ №85» г. Тайшет Никитюк Л.Ф. Водород как элемент и простое вещество
Водород как элемент и простое вещество Красители для волос. Первая группа
Красители для волос. Первая группа Углеводороды. Алканы
Углеводороды. Алканы Литье под давлением термопластов
Литье под давлением термопластов Взаимодействие веществ
Взаимодействие веществ Дисперсні системи. Загальні властивості розчинів
Дисперсні системи. Загальні властивості розчинів Цепочечные силикаты
Цепочечные силикаты Газоподібна і тверда фаза грунту. Методи аналізу зернового складу
Газоподібна і тверда фаза грунту. Методи аналізу зернового складу Аппараты основных химических производств
Аппараты основных химических производств Биосинтез жирных кислот и триацилглицеролов. Обмен липидов. (Лекция 13)
Биосинтез жирных кислот и триацилглицеролов. Обмен липидов. (Лекция 13) Обнаружение липидов с помощью качественной реакции
Обнаружение липидов с помощью качественной реакции Мир стекла
Мир стекла Алюминий и бор
Алюминий и бор Эфиры. Жиры
Эфиры. Жиры Типы процессов химической технологии
Типы процессов химической технологии Занятие по познавательному развитию на тему: «Где спрятался воздух?» в средней группе.
Занятие по познавательному развитию на тему: «Где спрятался воздух?» в средней группе.  Введение в биологию клетки. (Лекция 6)
Введение в биологию клетки. (Лекция 6) Kristālisku vielu uzbūve
Kristālisku vielu uzbūve Производные хромана. Фенилхромановые соединения, флавоноиды. (Лекция 3)
Производные хромана. Фенилхромановые соединения, флавоноиды. (Лекция 3) Масса и формулы
Масса и формулы Комплексные соединения
Комплексные соединения Метод электронного баланса для уравнивания окислительно-восстановительных реакций
Метод электронного баланса для уравнивания окислительно-восстановительных реакций Чугуны. Лекция 6
Чугуны. Лекция 6 Получение водорода с использованием технологии газификации угля и отходов угольной промышленности
Получение водорода с использованием технологии газификации угля и отходов угольной промышленности Соли
Соли Химическая связь
Химическая связь