Содержание
- 2. 1) NaOH + HCl → NaCl + H2O; 2) H2 + I2 → 2HI; 3) C
- 3. H2 + I2 2HI видеофильм
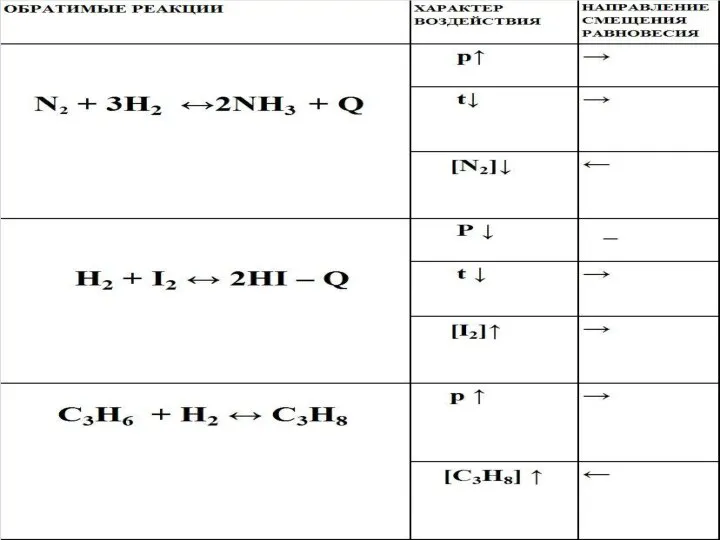
- 5. N2 + 3H2 ↔ 2NH3 1объем 3 объема 2 объема 4 объема 2 объема 1 ФАКТОР
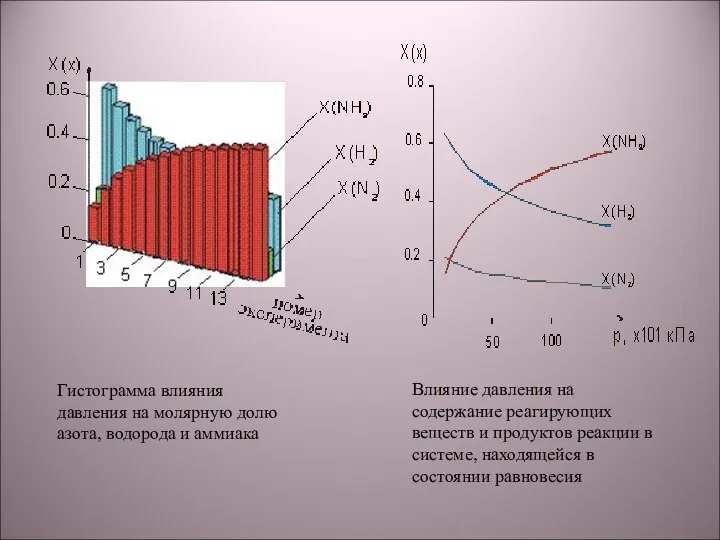
- 6. Гистограмма влияния давления на молярную долю азота, водорода и аммиака Влияние давления на содержание реагирующих веществ
- 7. Модельная демонстрация влияния давления на смещение равновесия в системе: N2 + 3H2 ↔ 2NH3.
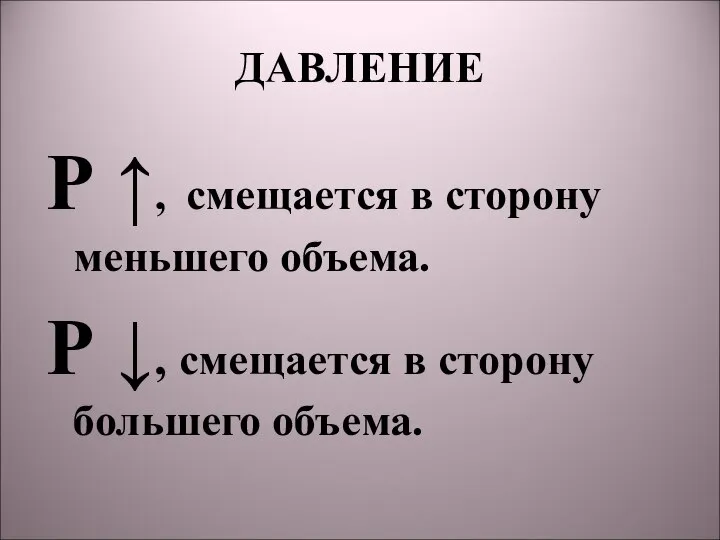
- 8. ДАВЛЕНИЕ Р ↑, смещается в сторону меньшего объема. Р ↓, смещается в сторону большего объема.
- 9. H2 + I2 ↔ 2HI
- 10. 2 ФАКТОР - ТЕМПЕРАТУРА N2 + 3H2 → 2NH3 + Q 2NH3 → N2 + 3H2
- 11. Влияние температуры на содержание реагирующих веществ и продуктов реакции в системе, находящейся в состоянии равновесия Влияние
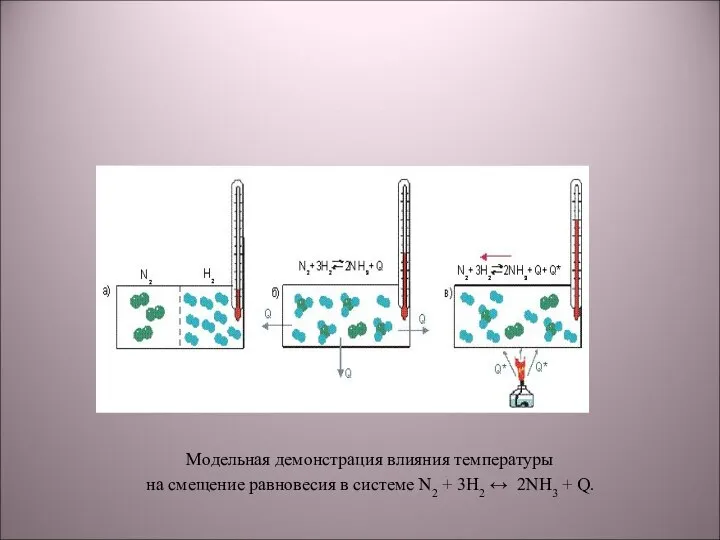
- 12. Модельная демонстрация влияния температуры на смещение равновесия в системе N2 + 3H2 ↔ 2NH3 + Q.
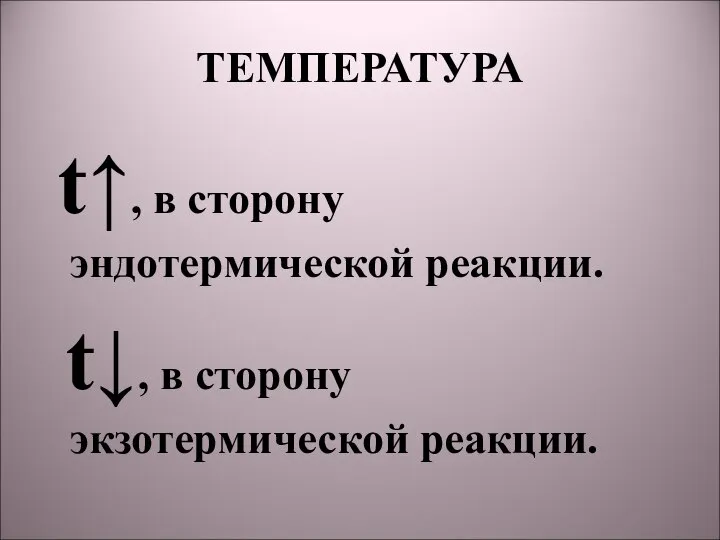
- 13. ТЕМПЕРАТУРА t↑, в сторону эндотермической реакции. t↓, в сторону экзотермической реакции.
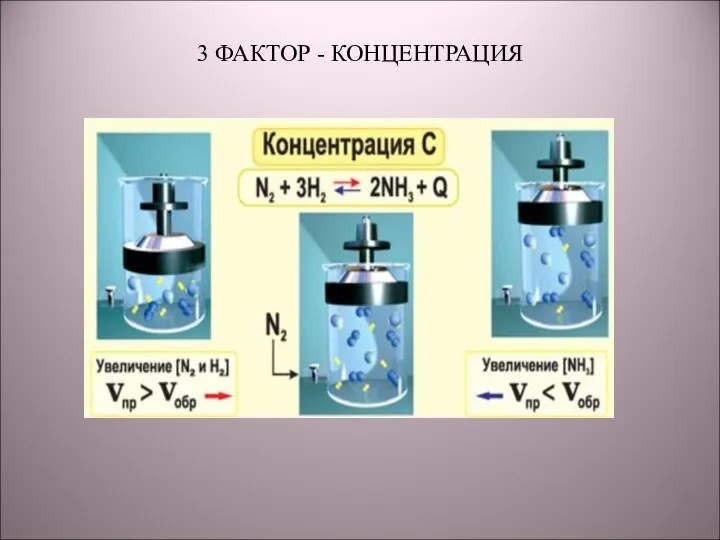
- 14. 3 ФАКТОР - КОНЦЕНТРАЦИЯ
- 15. КОНЦЕНТРАЦИЯ Концентрация реагентов ↑, в сторону продуктов. Концентрация продуктов ↑, в сторону реагентов.
- 16. ФАКТОРЫ, ВЛИЯЮЩИЕ НА СИНТЕЗ АММИАКА N2 + 3H2 →2NH3 + Q Р t [N2 ], [H2]
- 17. ВЛИЯНИЕ КАТАЛИЗАТОРОВ НА РАВНОВЕСИЕ КАТАЛИЗАТОРЫ В РАВНОЙ СТЕПЕНИ УСКОРЯЮТ И ПРЯМУЮ И ОБРАТНУЮ , ИЗМЕНЯЯ ЭНЕРГИЮ
- 18. Анри Луи Ле Шателье (1850–1936) Принцип Ле-Шателье (принцип смещения хим.равновесия) (принцип противоложностей) был высказана в общем
- 19. ПРИНЦИП ЛЕ-ШАТЕЛЬЕ Если на систему, находящуюся в равновесии оказывается воздействие (изменяется концентрация, давление, температура), то равновесие
- 21. «ВСЯКОЕ ЗНАНИЕ ИСХОДИТ ИЗ НАБЛЮДЕНИЯ И ОПЫТА» Ш. СЕНТ-БЕВ
- 23. СО2 + Н2О прямая Н2СО3 Н2СО3 обратнаяСО2 + Н2О СО2 + Н2О ↔ Н2СО3
- 24. УНИВЕРСАЛЬНОСТЬ ПРИПЦИПА В химии используется для увеличения выхода реакции; В фармакологии – для уточнения условий баланса
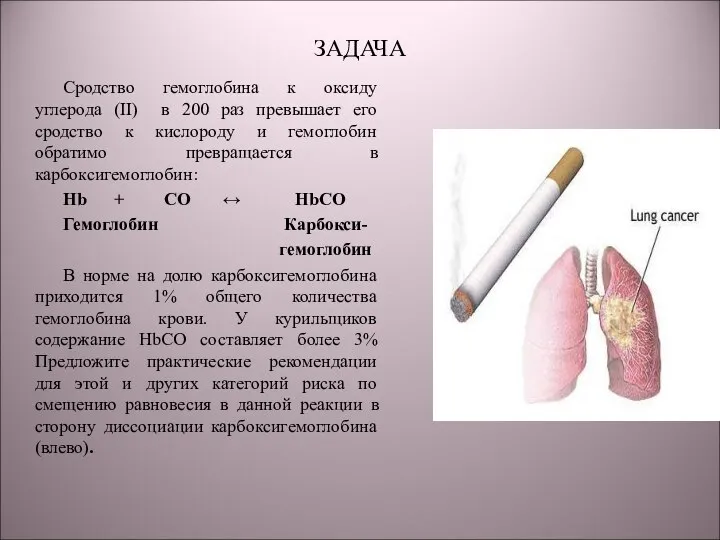
- 26. ЗАДАЧА Cродство гемоглобина к оксиду углерода (II) в 200 раз превышает его сродство к кислороду и
- 27. ВЫВОДЫ Р ↑, смещается в сторону меньшего объема. Р ↓, смещается в сторону большего объема. t↑,в
- 28. ДОМАШНЕЕ ЗАДАНИЕ §14 (Габриелян О.С.) Упр1,3,4 стр. 152. Где можно использовать полученные знания в жизни?
- 30. Скачать презентацию

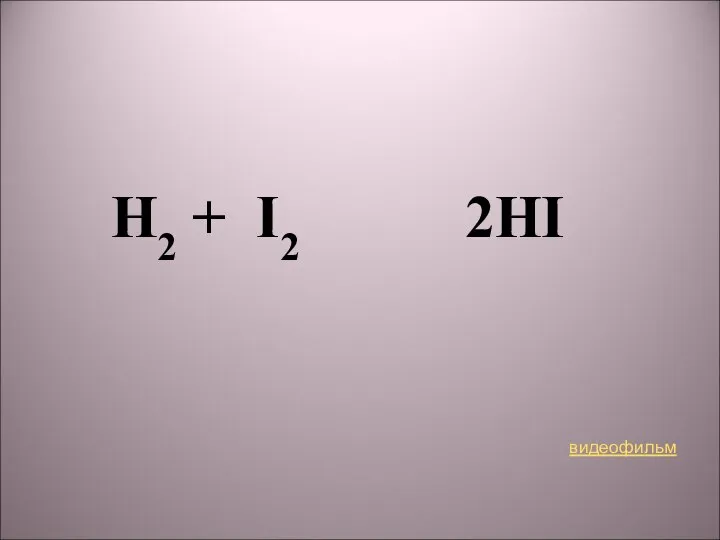


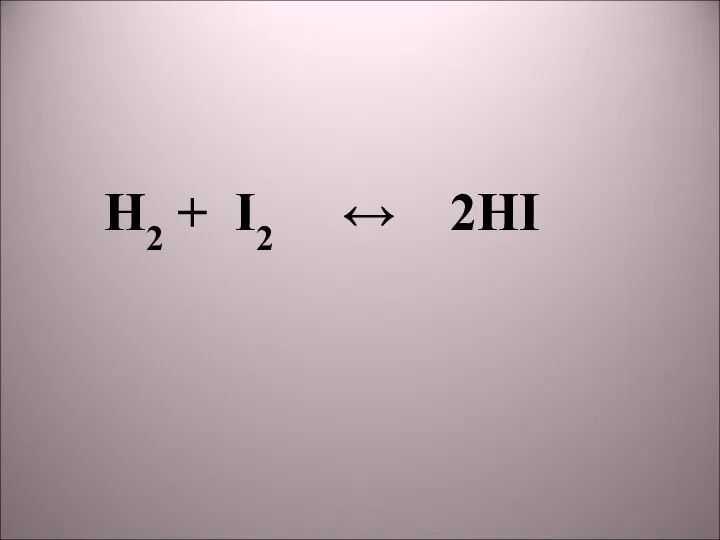



![ФАКТОРЫ, ВЛИЯЮЩИЕ НА СИНТЕЗ АММИАКА N2 + 3H2 →2NH3 + Q Р t [N2 ], [H2]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1151063/slide-15.jpg)










 Открытие водорода
Открытие водорода Фотодыхание
Фотодыхание Гидротермальные месторождения. (Лекция 10)
Гидротермальные месторождения. (Лекция 10) ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ 1.ОВР.Классификация ОВР. 2.Метод электронного баланса. 3.Метод полуреакций.
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ 1.ОВР.Классификация ОВР. 2.Метод электронного баланса. 3.Метод полуреакций.  Функціональні матеріали в аналітичній хімії. Лекція 1
Функціональні матеріали в аналітичній хімії. Лекція 1 Побочная подгруппа VI группы периодической системы
Побочная подгруппа VI группы периодической системы Вычисление массовой доли растворенного вещества в растворе. Вычисление количества вещества, массы или объема вещества
Вычисление массовой доли растворенного вещества в растворе. Вычисление количества вещества, массы или объема вещества ПРЕДЕЛЬНЫЕ УГЛЕВОДОРОДЫ
ПРЕДЕЛЬНЫЕ УГЛЕВОДОРОДЫ  Метаболизм липидов. Метаболизм глицерофосфолипидов и холестерола. (Лекция 3)
Метаболизм липидов. Метаболизм глицерофосфолипидов и холестерола. (Лекция 3) Презентация по Химии "Карбонові кислоти" - скачать смотреть бесплатно
Презентация по Химии "Карбонові кислоти" - скачать смотреть бесплатно Презентация по биологии 9 класс Учитель Рякина Наталья Евгеньевна
Презентация по биологии 9 класс Учитель Рякина Наталья Евгеньевна  Углеводы. Общие представления об углеводах
Углеводы. Общие представления об углеводах Коррозия и защита материалов
Коррозия и защита материалов Предельные и непредельные углеводороды
Предельные и непредельные углеводороды Химия атмосферы
Химия атмосферы Композиты. Полимерные композиционные материалы
Композиты. Полимерные композиционные материалы Твёрдое состояние вещества
Твёрдое состояние вещества Коэффициент концентрации меди
Коэффициент концентрации меди Значення хімії у розв’язанні сировинної проблеми
Значення хімії у розв’язанні сировинної проблеми  Решение задач. Способы выражения состава раствора
Решение задач. Способы выражения состава раствора Лиофильные и лиофобные дисперсные системы
Лиофильные и лиофобные дисперсные системы Классы неорганических веществ
Классы неорганических веществ Медь и ее сплавы
Медь и ее сплавы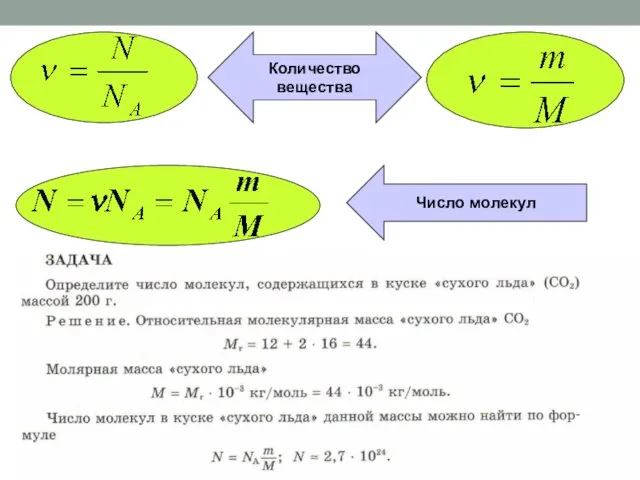 Виды состояния вещества
Виды состояния вещества Изучение стереохимии циклических формалей глицерина методом ЯМР-спектроскопии
Изучение стереохимии циклических формалей глицерина методом ЯМР-спектроскопии Растворяющаяся в воде моющая масса - мыло
Растворяющаяся в воде моющая масса - мыло Классификация сплавов. Диаграммы состояния сплавов
Классификация сплавов. Диаграммы состояния сплавов Ртуть
Ртуть