Содержание
- 2. Обратимыми по направлению химическими реакциями называются такие реакции, которые при данных внешних условиях могут самопроизвольно протекать
- 3. Н2(газ) + J2(газ) ↔ 2HJ (газ), ΔGo = 1,6 кДж/моль Hb(р-р) + О2(газ) ↔ НbО2(р-р), ΔGo
- 4. Гульдберг, Вааге и Бекетов открыли закон действующих масс (здм). Он отражает соотношение между равновесными концентрациями реагирующих
- 5. ΔGо р-ции = -RTlnkc, т.к. при равновесии ΔGо р-ции = 0 (стандартные условия) С учетом этого:
- 6. КОНСТАНТЫ РАВНОВЕСИЯ: По способу выражения а) термодинамическая Ка = б) концентрационная в) для газов через давление
- 7. КОНСТАНТЫ РАВНОВЕСИЯ: По типу реакции а) константа диссоциации (ионизации) HNO2 ↔ H+ + NO2- K(HNO2) б)
- 8. Влияние температуры на величину константы химического равновесия выражается уравнением: К2 и К1 – константы равновесия при
- 9. Если на систему, находящуюся в равновесии, воздействовать извне, изменив какое-либо из условий, то в результате протекающих
- 10. Химическая кинетика – учение о закономерностях протекания химических реакций. Она рассматривает скорость и механизм реакций. Их
- 11. По механизму реакции делятся на простые и сложные. Простые реакции осуществляются посредством однотипных элементарных актов. Под
- 12. Для осуществления сложных реакций необходимы два или более элементарных акта (биохимические реакции). V1 а) параллельные А
- 13. Молекулярность реакции – число молекул, участвующих одновременно в элементарном акте. Различают: мономолекулярные (термическое разложение, цис-транс –
- 14. Порядок реакции – это эмпирически установленная зависимость скорости от концентрации реагирующих веществ. Известны реакции: нулевого порядка
- 15. V = ± ΔCA / Δt для реакции А→ В Средняя скорость Истинная скорость Единица измерения
- 16. Гульдберг, Вааге и Бекетов (здм) Скорость простой реакции прямо пропорциональна произведению концентрации реагирующих веществ А +
- 17. Для гетерогенных реакций С(тв.фазы) = const Например: СО2 + С = 2СО V = - d(CO2)
- 18. Кинетическое уравнение реакции – функциональная зависимость концентрации реагирующих веществ от времени. Они получаются из уравнений здм.
- 19. 1) Реакции нулевого порядка (скорость не зависит о концентрации исходных веществ). Это гетерогенные реакции. А →
- 20. 2) Реакции первого порядка А → продукты реакции После интегрирования:
- 21. График зависимости от t – прямая линия, где -tgα=k Для СА = САо/2 имеем t0,5 =
- 22. 3) Реакции второго порядка 2А → продукты реакции или А + В → продукты реакции Интегральное
- 23. Есть реакции псевдопервого порядка, если концентрация одного из веществ большая и практически не меняется. СН3СООС2Н5 +
- 24. Порядок реакции определяется: Физическими методами Химическими методами (по t0,5) Биохимическими методами
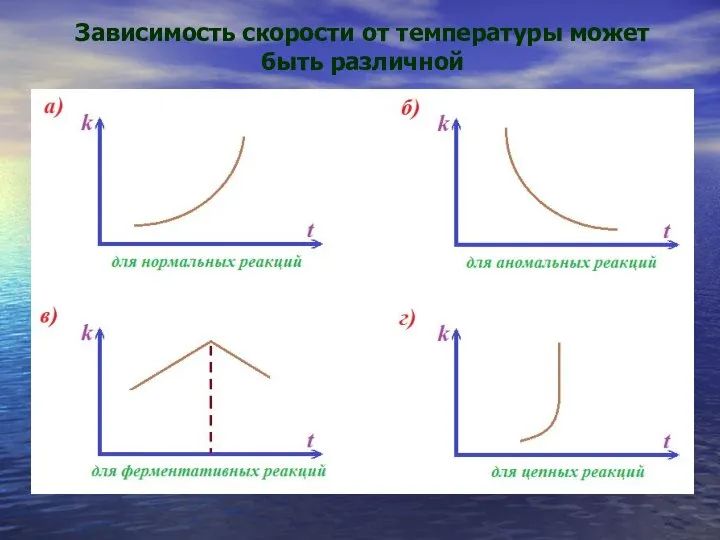
- 26. Зависимость скорости от температуры может быть различной
- 27. Правило Вант-Гоффа (для небольших температур) γ=2÷4 раз Но для биохимических реакций γ = 1,06 – 1,82
- 28. С. Аррениус создал теорию активных соударений. Уравнение Аррениуса: где А – предэкспоненциальный множитель, пропорциональный числу столкновений
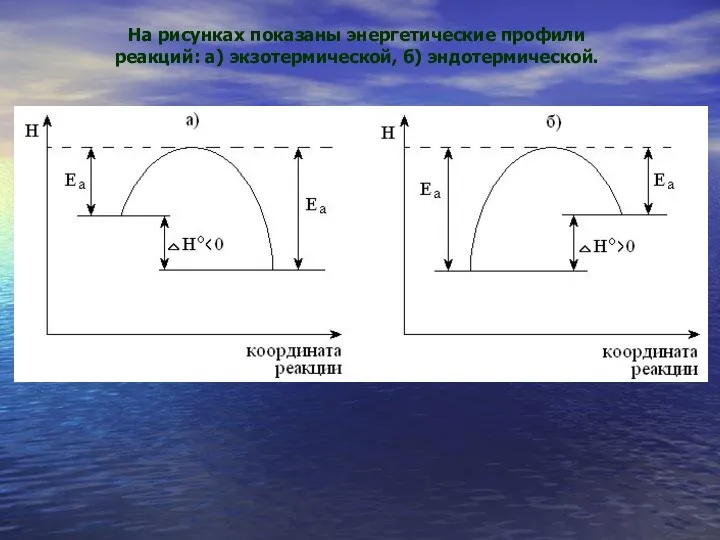
- 29. На рисунках показаны энергетические профили реакций: а) экзотермической, б) эндотермической.
- 30. Энергия активации - тот энергетический барьер, который должны преодолеть исходные вещества по пути превращения в продукты
- 31. Для двух температур уравнение Аррениуса имеет вид: или k1 и k2 – константы скорости при температурах
- 32. Катализ – это явление изменения скорости химических реакций в присутствии веществ, которые после завершения реакции остаются
- 33. Для ферментативных процессов: где Е – энзим (фермент); S – субстрат, вещество на которое действует фермент;
- 34. Михаэлис и Ментен дали уравнение ферментативного катализа (уравнение Михаэлиса – Ментен) Vст – стационарная скорость (она
- 35. Ферменты - белковые вещества. Содержат один или несколько активных центров, где и происходит превращение субстратов. Металлоферменты
- 36. Механизм действия ферментов заключается в изменении пути процесса превращения реагентов в продукты. Новый путь характеризуется меньшим
- 37. Итак, на скорость химических реакций оказывают влияние: природа реагирующих веществ; концентрации исходных веществ; температура; катализаторы; давление
- 39. Скачать презентацию


































 Химические реакции. по фазовому составу
Химические реакции. по фазовому составу Титриметрические методы анализа
Титриметрические методы анализа Периодическая таблица Д.И. Менделеева Элемент № 24 ХРОМ
Периодическая таблица Д.И. Менделеева Элемент № 24 ХРОМ Производство серной кислоты H2SO4
Производство серной кислоты H2SO4 Оксиды. Химические свойства
Оксиды. Химические свойства Мыло. Компоненты мыла
Мыло. Компоненты мыла Enzymes The classification and nomenclature. Lyases and Transferases
Enzymes The classification and nomenclature. Lyases and Transferases Глюкоза. Молекулярна формула. Фізичні та хімічні властивості глюкози. Поширення в природі
Глюкоза. Молекулярна формула. Фізичні та хімічні властивості глюкози. Поширення в природі Химия элементов VI группы главной подгруппы. Сера и ее соединения
Химия элементов VI группы главной подгруппы. Сера и ее соединения Гліцерин. Загальні відомості про гліцерин
Гліцерин. Загальні відомості про гліцерин Витаминная страна
Витаминная страна Жири. Склад жирів, їх утворення. Жири у природі. Біологічна роль жирів.
Жири. Склад жирів, їх утворення. Жири у природі. Біологічна роль жирів.  Ахрамович Наталья Михайловна учитель химии ГБОУ СОШ № 450 Курортного района Санкт – Петербурга
Ахрамович Наталья Михайловна учитель химии ГБОУ СОШ № 450 Курортного района Санкт – Петербурга Презентация по Химии "Полиэтилен" - скачать смотреть
Презентация по Химии "Полиэтилен" - скачать смотреть  Химические вещества и материалы в живописи
Химические вещества и материалы в живописи Глобальні екологічні проблеми повязані з добуванням та переробкою вуглеводної сировини Підготувала учениця 11-А класу Гребі
Глобальні екологічні проблеми повязані з добуванням та переробкою вуглеводної сировини Підготувала учениця 11-А класу Гребі Аттестационная работа. Программа элективного курса Химия в задачах
Аттестационная работа. Программа элективного курса Химия в задачах Алюминий. Строение
Алюминий. Строение Фізичні та хімічні властивості кислот (урок хімії у 8 класі)
Фізичні та хімічні властивості кислот (урок хімії у 8 класі) Вода – простой взгляд на химический состав
Вода – простой взгляд на химический состав Хлор. Отравления хлором
Хлор. Отравления хлором Хімія в побуті
Хімія в побуті Стандартизація лікарських засобів в Україні
Стандартизація лікарських засобів в Україні Теория сплавов
Теория сплавов Фізичні та хімічні явища
Фізичні та хімічні явища Предупреждение некоторых видов коррозии
Предупреждение некоторых видов коррозии Карбоновые кислоты
Карбоновые кислоты Каталитический крекинг. Промышленные установки
Каталитический крекинг. Промышленные установки