Содержание
- 2. Сера ДОБЫЧА Вручную Из по земли FeS2 → FeS + S t 4FeS2 + 11O2 →
- 3. Серная кислота – кровь химической промышленности
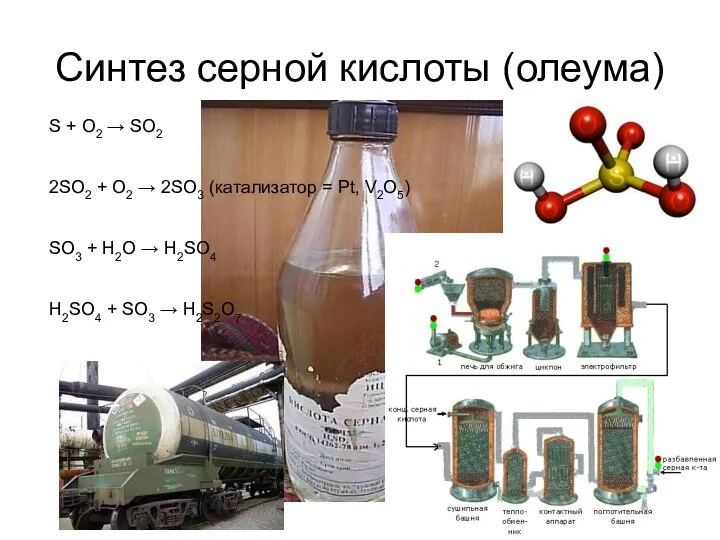
- 4. Синтез серной кислоты (олеума) S + O2 → SO2 2SO2 + O2 → 2SO3 (катализатор =
- 5. Еще о серной кислоте H2SO4 (p-p) 2H+ + SO42- Не реагирует с неметаллами и металлами стоящими
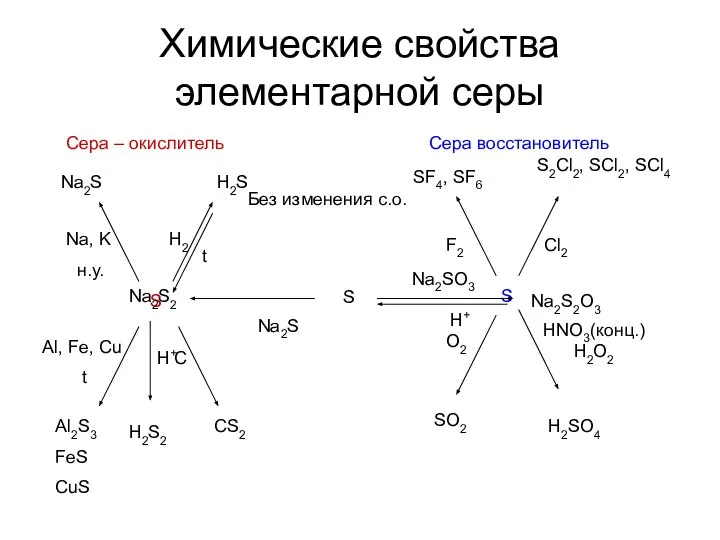
- 6. Химические свойства элементарной серы Сера – окислитель Сера восстановитель Без изменения с.о.
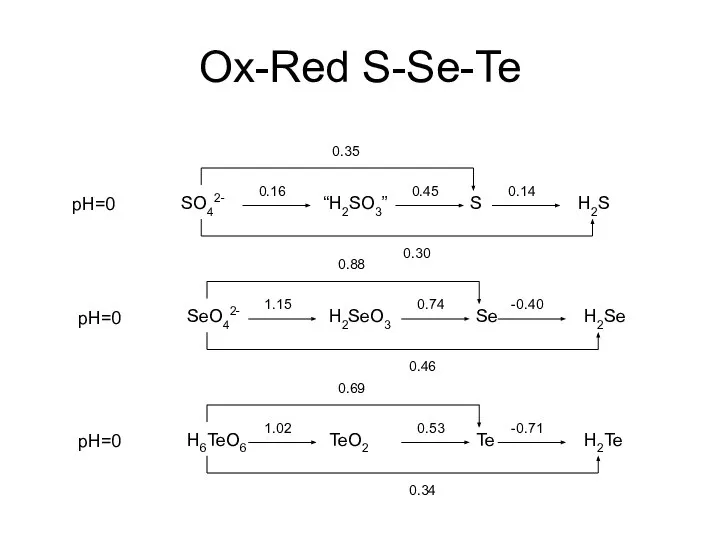
- 7. Диаграммы Латимера для S pH=0 SO42- “H2SO3” S H2S 0.35 0.30 0.16 0.45 0.14 pH=14 SO42-
- 8. S-2 Вулкан Горелый (Камчатка) Ядовитый газ, запах «тухлых яиц» Черное море При отравлении! Свежий воздух, покой,
- 9. S-2 H2 + S = H2S CnH2n+2 + S = H2S + CnHn 2Al + 3S
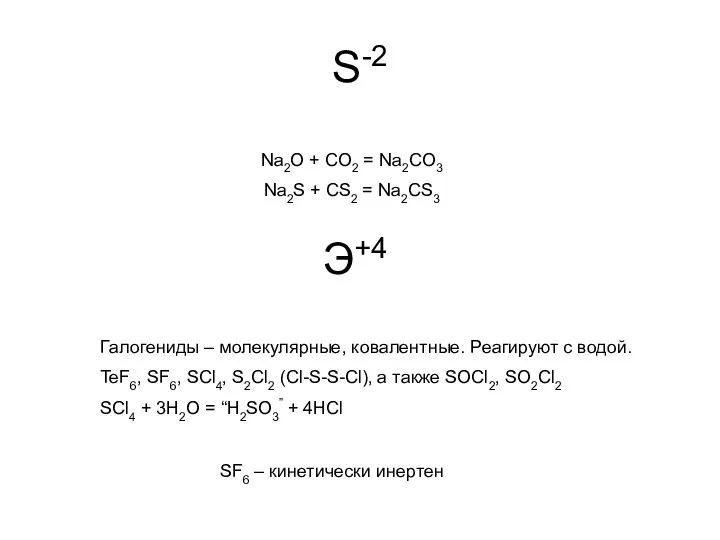
- 10. S-2 Na2O + CO2 = Na2CO3 Na2S + CS2 = Na2CS3 Э+4 Галогениды – молекулярные, ковалентные.
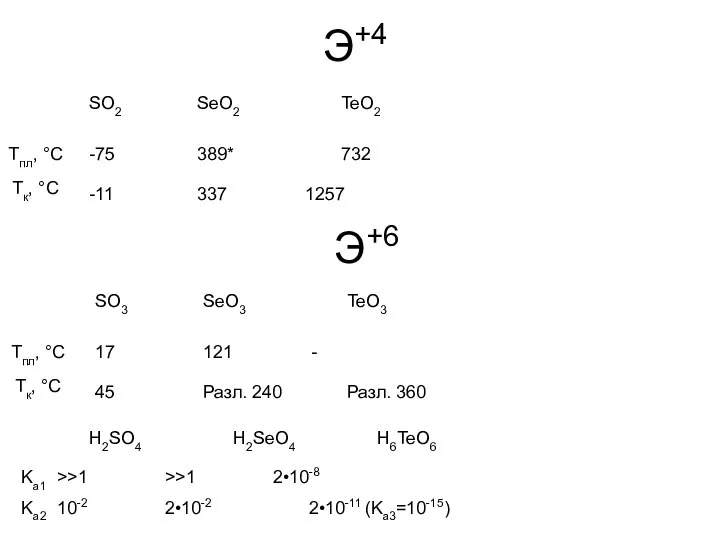
- 11. Э+4 SO2 SeO2 TeO2 -75 389* 732 Tпл, °С -11 337 1257 Tк, °С SO3 SeO3
- 12. Ox-Red S-Se-Te pH=0 SO42- “H2SO3” S H2S 0.35 0.30 0.16 0.45 0.14 pH=0 SeO42- H2SeO3 Se
- 14. Скачать презентацию






 Понятие о качественных реакциях. 9 класс
Понятие о качественных реакциях. 9 класс Група учнів - екологів 9-Б класу під керівництвом учителя хімії Видай Олени Василівни вивчала проблему:
Група учнів - екологів 9-Б класу під керівництвом учителя хімії Видай Олени Василівни вивчала проблему: Презентация по химии Тема : « Большое приключение маленькой спички»
Презентация по химии Тема : « Большое приключение маленькой спички» Обобщение по теме неметаллы
Обобщение по теме неметаллы Липиды. Общая характеристика липидов
Липиды. Общая характеристика липидов Класс органических соединений фенолы
Класс органических соединений фенолы Основания, их состав, номенклатура и основные представители
Основания, их состав, номенклатура и основные представители Морфология почв
Морфология почв Презентация по Химии "Всё на свете химия!" - скачать смотреть
Презентация по Химии "Всё на свете химия!" - скачать смотреть  Многоатомные спирты
Многоатомные спирты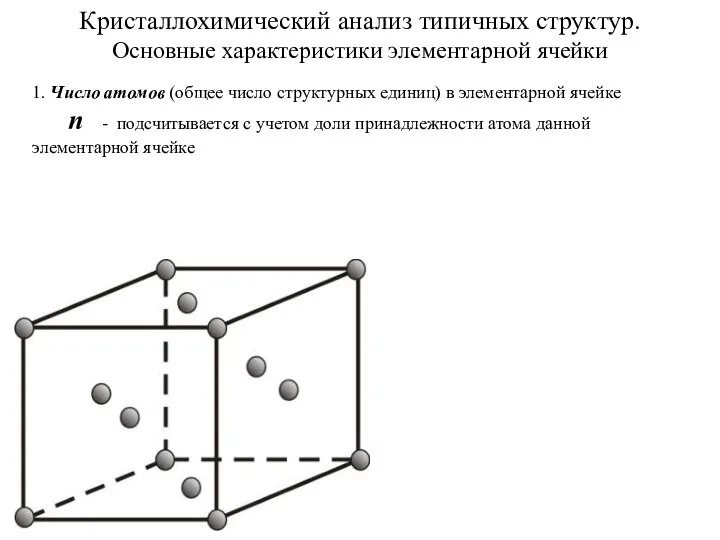 Кристаллохимический анализ типичных структур. Основные характеристики элементарной ячейки
Кристаллохимический анализ типичных структур. Основные характеристики элементарной ячейки Геохимия метасоматтческого процесса. (Лекция 7)
Геохимия метасоматтческого процесса. (Лекция 7) Типи поживних речовин
Типи поживних речовин Фараонова Змея
Фараонова Змея Стеклянные товары. Основные сырьевые материалы для производства стекла
Стеклянные товары. Основные сырьевые материалы для производства стекла Вода: строение, свойства и значение
Вода: строение, свойства и значение Алюминий в природе
Алюминий в природе Теория растворов (лекция 1)
Теория растворов (лекция 1) Składniki odżywcze
Składniki odżywcze Биогенные элементы. Критерии биогенности
Биогенные элементы. Критерии биогенности Предмет химии. Вещества и их физические свойства
Предмет химии. Вещества и их физические свойства Природный газ
Природный газ Эфирные масла. Терпены и терпеноиды
Эфирные масла. Терпены и терпеноиды Презентация по Химии "Мінеральні добрива" - скачать смотреть бесплатно
Презентация по Химии "Мінеральні добрива" - скачать смотреть бесплатно Значение органической химии в жизни человека
Значение органической химии в жизни человека Составление формул по валентности
Составление формул по валентности Каменный уголь. Химический состав каменного угля
Каменный уголь. Химический состав каменного угля Кальций в океане: кораллы и жемчуг. Кальций в строительстве: гипс и алебастр
Кальций в океане: кораллы и жемчуг. Кальций в строительстве: гипс и алебастр