Содержание
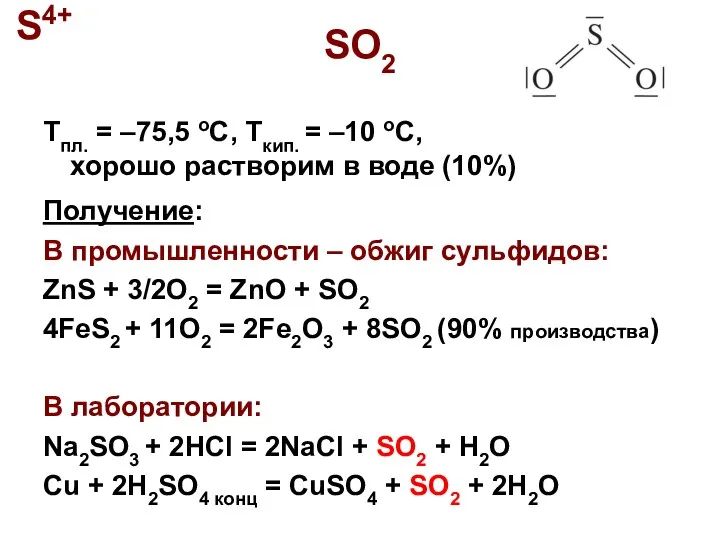
- 2. SO2 Tпл. = –75,5 oC, Tкип. = –10 oC, хорошо растворим в воде (10%) Получение: В
- 3. Равновесия в воде: SO2газ + xH2O = SO2.xH2O K >>1 SO2.xH2O = H2SO3 + (x-1)H2O K
- 4. Диспропорционирование: 4SO32– = S2– + 3SO42– (при нагревании) Окисление (S4+ S6+): SO2 + 1/2O2 = SO3
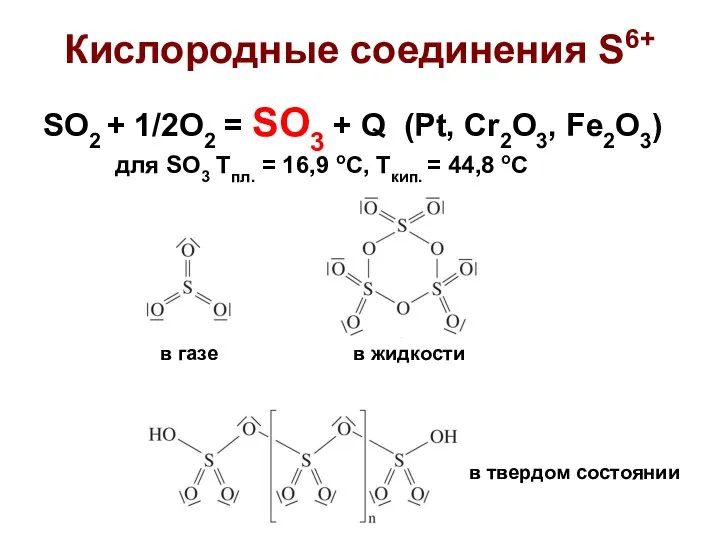
- 5. Кислородные соединения S6+ SO2 + 1/2O2 = SO3 + Q (Pt, Cr2O3, Fe2O3) для SO3 Tпл.
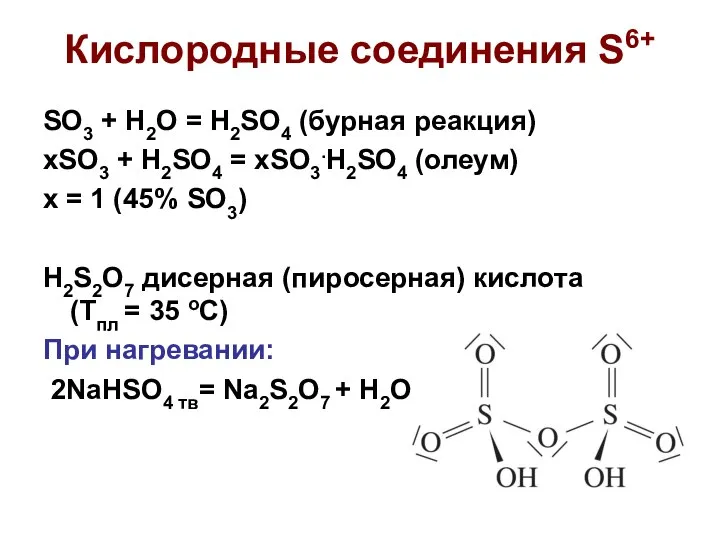
- 6. SO3 + H2O = H2SO4 (бурная реакция) xSO3 + H2SO4 = xSO3.H2SO4 (олеум) x = 1
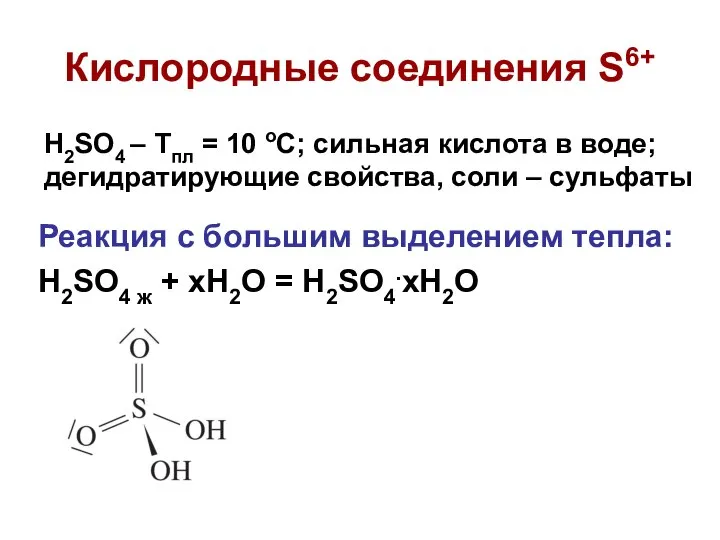
- 7. Реакция с большим выделением тепла: H2SO4 ж + xH2O = H2SO4.xH2O Кислородные соединения S6+ H2SO4 –
- 8. Кислородные кислоты S, Se и Те
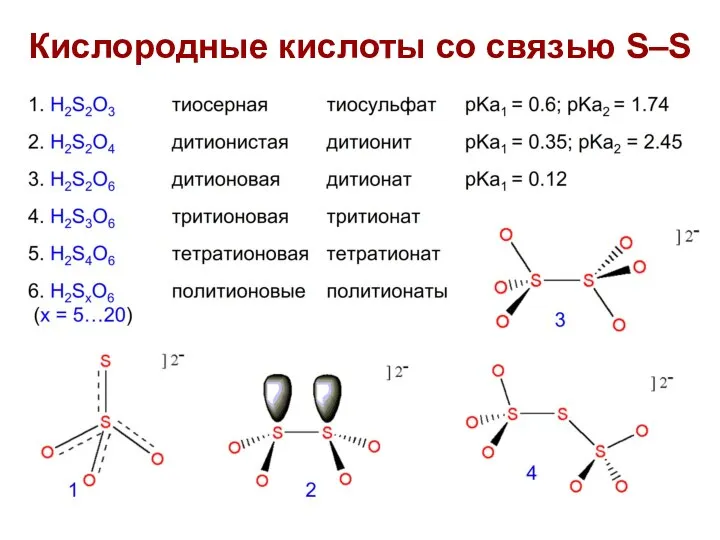
- 9. Кислородные кислоты со связью S–S
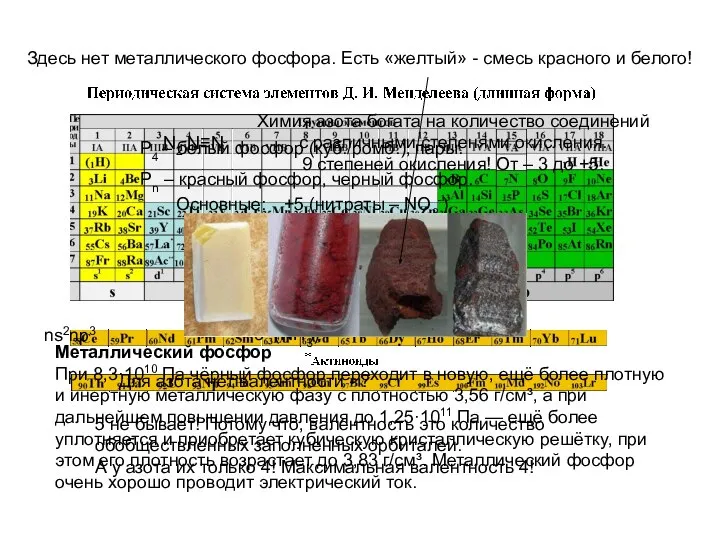
- 11. Химия элементов VA группы (пниктогены или пникти́ды)
- 12. Простые вещества, и основные степени окисления ns2np3 N2 N≡N Химия азота богата на количество соединений с
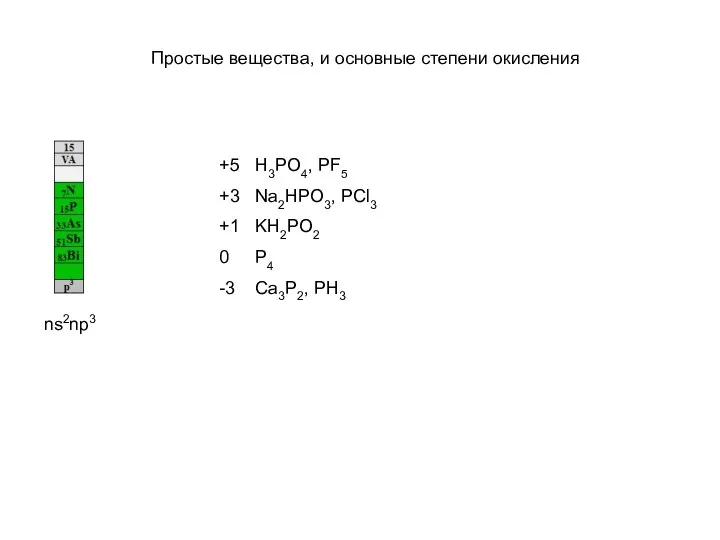
- 13. Простые вещества, и основные степени окисления ns2np3 +5 H3PO4, PF5 +3 Na2HPO3, PCl3 +1 KH2PO2 0
- 14. Простые вещества, и основные степени окисления ns2np3 As – мышьяк, arsenicum Соли – арсениды, арсениты, арсенаты.
- 15. Простые вещества, и основные степени окисления ns2np3 Bi – висмут, bismuthum. Самый «тяжелый» нерадиоактивый металл. +5
- 16. Распространенность и минералы N – 18 место, N2 (78%об. атмосферы), NaNO3 (селитра) P – 13 место;
- 17. Открытие элементов N – 1772 г., англ. Кавендиш, Пристли, Резерфорд, швед Шееле. Назвал француз Лавуазье: azote
- 19. K2Cr2O7 + (NH4)2SO4 = (NH4)2Cr2O7 + K2SO4 (NH4)2Cr2O7 →(t) Cr2O3 + N2↑ + 4H2O 2NaN3 →(t)
- 20. Диазот N2 Ткип. = –196 оС, плохо растворим в воде В N2 тройная связь Е =
- 21. Связывание диазота N2 N2 + Li = Li3N при комнатной Т, нитриды N2 + 3Mg =
- 22. «Связывание» азота 6Ti + N2 → 2TiN, 2B + N2 →2BN, CaC2 + N2 → CaCN2
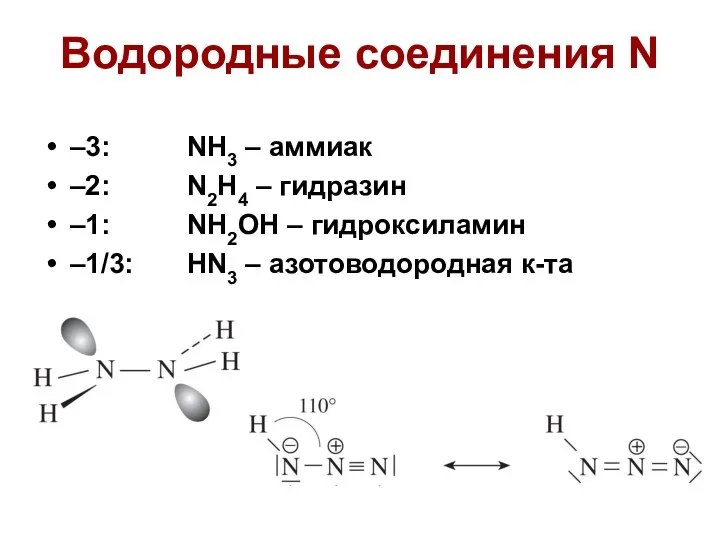
- 23. Водородные соединения N –3: NH3 – аммиак –2: N2H4 – гидразин –1: NH2OH – гидроксиламин –1/3:
- 24. Получение в лаборатории NH4Clконц + NaOHтв = NH3↑ + NaCl + H2O Для получения безводного NH3
- 25. Нитриды Ионные Li3N, Mg3N2, Cu3N, Zn3N2 Полностью гидролизуются водой: Li3N + 3H2O = 3LiOH + NH3
- 26. Свойства аммиак NH3 + H2O → NH4+ + OH−; Kb=1,8·10−5 Аммиа́к — NH3, нитрид водорода, при
- 27. NH3 – слабый восстановитель 8NH3(aq) + 3Br2 = 6NH4Br + N2 3CuOтв + 2NH3 г =
- 28. Термолиз солей аммония Соли кислот не окислителей HX (X = Cl, Br, I), H2CO3, H3PO4 (NH4)2CO3
- 30. Скачать презентацию


















 Щелочные металлы
Щелочные металлы Винная кислота
Винная кислота Презентация по Химии "Горение кислорода" - скачать смотреть
Презентация по Химии "Горение кислорода" - скачать смотреть  Амины - производные аммиака
Амины - производные аммиака Минерал гранат
Минерал гранат Живопись Англии 17 века
Живопись Англии 17 века  Алканы
Алканы Галогены. Хлор
Галогены. Хлор Конструкционные материалы на основе легких металлов: сплавы алюминия
Конструкционные материалы на основе легких металлов: сплавы алюминия Барометр – анероид. Атмосферное давление на различных высотах. Манометры
Барометр – анероид. Атмосферное давление на различных высотах. Манометры Тест по неорганической химии
Тест по неорганической химии Использование химии в медицине
Использование химии в медицине Кремний және оның қосылыстары
Кремний және оның қосылыстары Эрбий. Жалпы сипаттамасы
Эрбий. Жалпы сипаттамасы Анод + Катод = Электролиз Выполнил: ученик 11М класса МОУ лицея №6 Аббязов Эрик
Анод + Катод = Электролиз Выполнил: ученик 11М класса МОУ лицея №6 Аббязов Эрик Азотсодержащие органические соединения
Азотсодержащие органические соединения Моделирование фазовых систем. Тройные взаимные системы
Моделирование фазовых систем. Тройные взаимные системы Факторы, влияющие на смещение химического равновесия (концентрация реагентов, температура, давление )
Факторы, влияющие на смещение химического равновесия (концентрация реагентов, температура, давление ) Гетероорганические углеводороды нефти и асфальто-смолистые вещества
Гетероорганические углеводороды нефти и асфальто-смолистые вещества Поверхностные явления
Поверхностные явления Кондуктометрия. Приборы кондуктометрии. Достоинства метода. Классификация
Кондуктометрия. Приборы кондуктометрии. Достоинства метода. Классификация Химические реакции. Реакции по тепловому эффекту
Химические реакции. Реакции по тепловому эффекту МОУ «Средняя школа № 14» г. Кимры Тверской Области урок химии в 11 классе Учитель: Иванова Ирина Викторовна
МОУ «Средняя школа № 14» г. Кимры Тверской Области урок химии в 11 классе Учитель: Иванова Ирина Викторовна  Кислородсодержащие органические соединения. Спирты. Фенолы. Альдегиды
Кислородсодержащие органические соединения. Спирты. Фенолы. Альдегиды Презентация по Химии "Теория тарелок. Хроматографические идентификация. Количественный анализ" - скачать смотреть
Презентация по Химии "Теория тарелок. Хроматографические идентификация. Количественный анализ" - скачать смотреть  Растворение. Растворимость веществ в воде
Растворение. Растворимость веществ в воде Бензол. Получение бензола. Химические свойства бензола. Применение бензола на основе его свойств
Бензол. Получение бензола. Химические свойства бензола. Применение бензола на основе его свойств Химические вещества парабены
Химические вещества парабены