Содержание
- 2. 1789г. Роберт Бойль 1673г. 1748г. М. В. Ломоносов Антуан Лавуазье
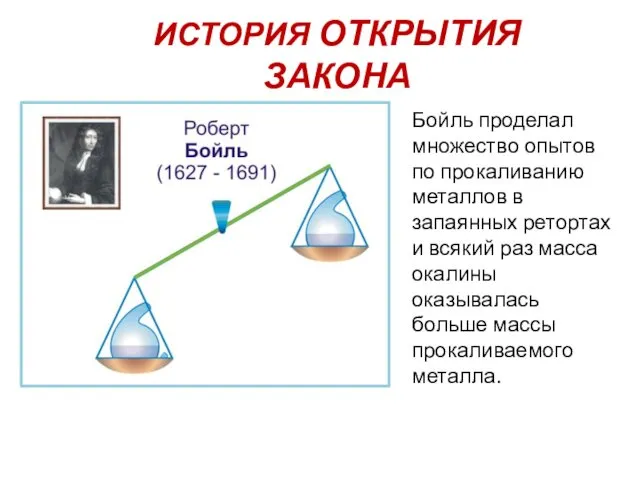
- 3. ИСТОРИЯ ОТКРЫТИЯ ЗАКОНА Бойль проделал множество опытов по прокаливанию металлов в запаянных ретортах и всякий раз
- 4. ИСТОРИЯ ОТКРЫТИЯ ЗАКОНА Русский учёный М.В. Ломоносов предположил, что чувственный опыт обманывает нас. 5 июля 1748
- 5. История открытия закона М.В Ломоносов сформулировал закон сохранения массы в 1748 г., а экспериментально подтвердил в
- 6. Химические уравнения Химическое уравнение – условная запись химической реакции с помощью химических формул и коэффициентов Исходные
- 7. Алгоритм составления уравнений 1. В левой части уравнения записываем химические формулы реагентов (веществ, вступающих в реакцию).
- 8. Алгоритм составления уравнений 3. Согласно закону сохранения массы веществ число атомов до и после реакции должно
- 12. Скачать презентацию








 Золото. Свойство золота
Золото. Свойство золота Д. И. Менделеев человек - загадка Автор: Ким Н. В. учитель химии 2008 год.
Д. И. Менделеев человек - загадка Автор: Ким Н. В. учитель химии 2008 год.  Сутегі. Оттегі. Сутекті алу және оның қасиеттерін зерттеу
Сутегі. Оттегі. Сутекті алу және оның қасиеттерін зерттеу Полярография және оның фармацияда қолданылуы
Полярография және оның фармацияда қолданылуы Нуклеиновые кислоты
Нуклеиновые кислоты Наука химия
Наука химия Тема:Хімія
Тема:Хімія  Электролитическая диссоциация
Электролитическая диссоциация Кадмий (Cadmium)
Кадмий (Cadmium) Мұнай құрамындағы тұздың мөлшерін анықтау
Мұнай құрамындағы тұздың мөлшерін анықтау Введение в органическую химию
Введение в органическую химию Химические составляющие человеческого организма
Химические составляющие человеческого организма Основы химической термодинамики
Основы химической термодинамики Метаморфические горные породы
Метаморфические горные породы Масс-спектры спиртов и фенолов
Масс-спектры спиртов и фенолов Комплексные соединения
Комплексные соединения Процессы соосаждения. Радионуклид без носителя. Индикаторные количества
Процессы соосаждения. Радионуклид без носителя. Индикаторные количества Арены. Бензол
Арены. Бензол Химическое равновесие и его смещение
Химическое равновесие и его смещение Минералы свинца
Минералы свинца Количественный анализ. Гравиметрия
Количественный анализ. Гравиметрия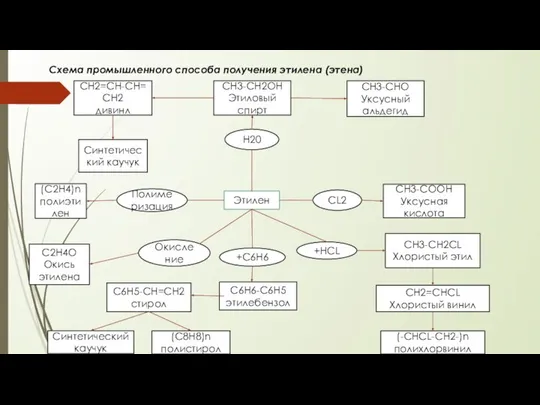 Промышленній способ получения этилена (этена)
Промышленній способ получения этилена (этена) Презентация по Химии "Вода" - скачать смотреть
Презентация по Химии "Вода" - скачать смотреть  Расчеты по уравнениям химической реакции
Расчеты по уравнениям химической реакции Темір және оның қосылыстары
Темір және оның қосылыстары Металлы
Металлы Электролитическая диссоциация. (Лекция 14)
Электролитическая диссоциация. (Лекция 14) Золото
Золото