Содержание
- 2. Состав раствора выражается через относительное содержание компонентов Мольная доля компонента : хі = nі / Σnі.
- 3. Парциальные мольные величины Z ≡ U, Н, S, V, ср ,… у = ∂Z/∂х; , ,
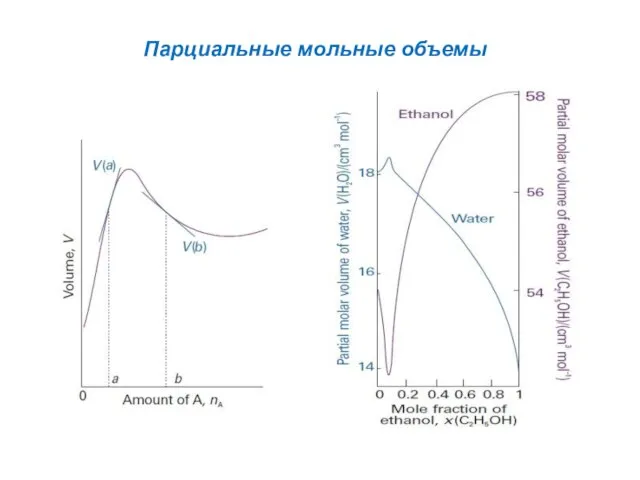
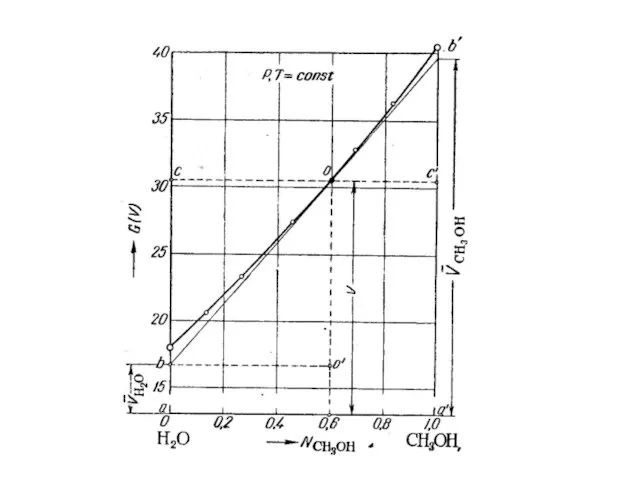
- 4. Парциальные мольные объемы
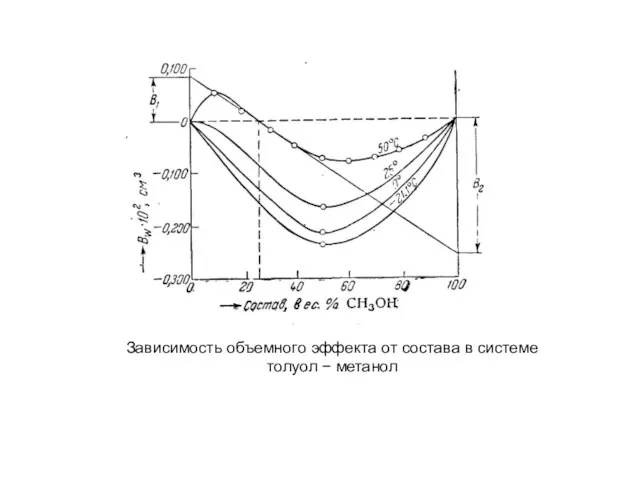
- 6. Зависимость объемного эффекта от состава в системе толуол − метанол
- 7. Кажущиеся мольные величины
- 8. Основные уравнения для парциальных мольных величин Любое экстенсивное свойство Z является однородной функцией первого порядка относительно
- 9. ; По теореме Эйлера для однородных функций первого порядка уравнения Гиббса – Дюгема
- 10. * Дополнительные сведения: уравнение Гиббса – Дюгема Внутренняя энергия также является однородной функцией первого порядка относительно
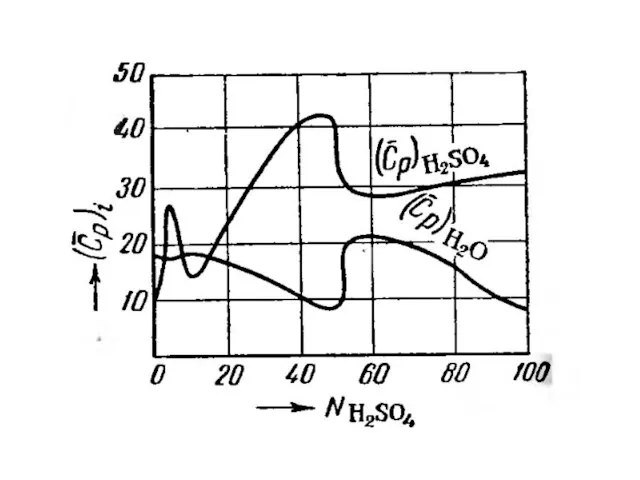
- 11. 3) максимум на одной кривой – минимум на другой кривой при том же составе. Для бинарных
- 14. Скачать презентацию







 Скалярное произведение векторов
Скалярное произведение векторов Своя игра. Действия с десятичными дробями
Своя игра. Действия с десятичными дробями Решение задача на совместную работу. 6 класс
Решение задача на совместную работу. 6 класс Умножение и деление десятичных дробей на натуральные числа
Умножение и деление десятичных дробей на натуральные числа Аттестационная работа. Решение задач на комбинации многогранников и тел вращения
Аттестационная работа. Решение задач на комбинации многогранников и тел вращения Признаки равенства треугольников
Признаки равенства треугольников Методы решения тригонометрических уравнений
Методы решения тригонометрических уравнений Тигонометрические функции и их графики
Тигонометрические функции и их графики Решение систем уравнений второй степени. 9 класс
Решение систем уравнений второй степени. 9 класс Симметрия относительно прямой и мы в мире симметрии
Симметрия относительно прямой и мы в мире симметрии Преобразование графиков тригонометрических функций
Преобразование графиков тригонометрических функций Дүртпочмаклар. Кайсы фигура артык
Дүртпочмаклар. Кайсы фигура артык Формулы. Урок изучения нового материала. Математика 5 класс
Формулы. Урок изучения нового материала. Математика 5 класс Решение систем логических уравнений
Решение систем логических уравнений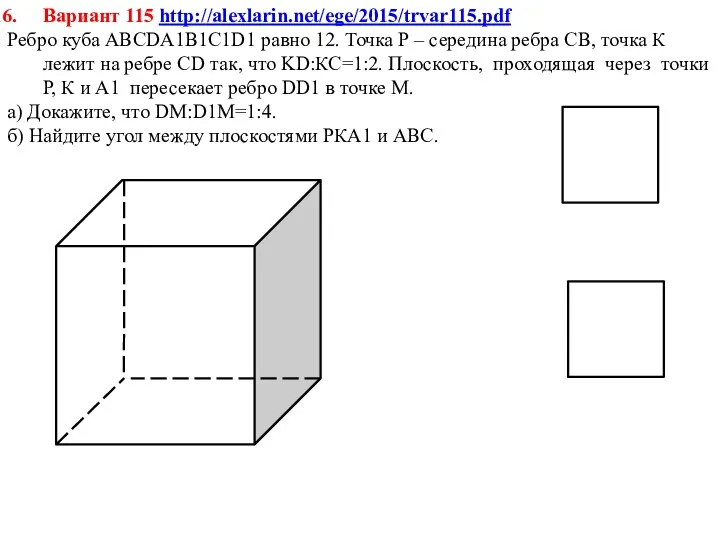 Решение задач. Куб, параллелепипед, призма
Решение задач. Куб, параллелепипед, призма Распределительный закон умножения
Распределительный закон умножения Парная регрессия и корреляция
Парная регрессия и корреляция Кубическое королевство
Кубическое королевство Сандық әдіс
Сандық әдіс Практикум по решению ключевых задач по теории вероятностей (ЕГЭ). 11 класс
Практикум по решению ключевых задач по теории вероятностей (ЕГЭ). 11 класс Квадратные уравнения: сквозь призму веков…
Квадратные уравнения: сквозь призму веков… Геометрия. Решение задач
Геометрия. Решение задач Математические методы в психологии
Математические методы в психологии Логические задачи для дошкольников
Логические задачи для дошкольников Аттестационная работа. Проект Замечательные кривые
Аттестационная работа. Проект Замечательные кривые Математические игры. Стихотворная разминка
Математические игры. Стихотворная разминка Способы представления иррациональных чисел
Способы представления иррациональных чисел Построение графиков функций с помощью сдвигов и деформаций
Построение графиков функций с помощью сдвигов и деформаций