Содержание
- 2. План лекції Роль електрохімічних явищ в медицині. Електродні потенціали. Електроди . Окисно-відновні реакції. Прогнозування напрямку окисно-відновних
- 3. Електропровідність – це здатність речовини проводити електричний струм. Електропровідність L – це величина обернена опору провідника
- 4. Провідники струму: Провідники 1 роду – проводять електричний струм за рахунок електронів і при цьому не
- 5. Питома електропровідність (χ) –електропровідність 1 м3 розчину електроліту, розміщеного між двома електродами, що мають площу 1
- 6. В реальних умовах вимірюють опір, який залежить від довжини провідника (l) і площі його поперечного перерізу
- 7. Питома електропровідність залежить від концентрації електроліту і від сили електроліту (досягає певного максимального значення а при
- 8. Молярна еквівалентна електропровідність (λс) - це електропровідність 1 моля розчиненого електроліту розміщеного між електродами розміщенні на
- 9. Молярна електропровідність досягає максимуму коли всі молекули розпадуться на йони. При такому розведенні, яке називають граничним,
- 10. Відповідно, ступінь дисоціації буде мати вигляд: Тоді, константа дисоціації:
- 11. Електропровідність різних тканин і біологічних рідин неоднакова. Високу електропровідність має спинно-мозкова рідина, лімфи, кров. Нижча електропровідність
- 12. Електрохімічна реакція – це різновид окисно-відновної реакції, особливість якої у взаємному переході хімічної енергії в електричну
- 13. Окисно-відновні процеси – це процеси, що супроводжуються зміною ступеня окиснення атомів. Відновники – речовини, які в
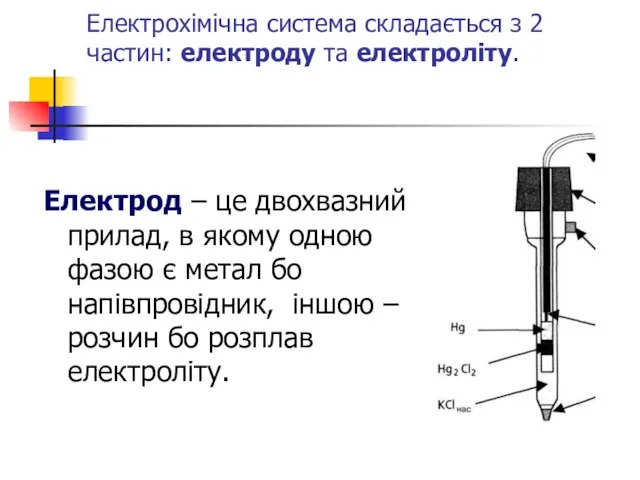
- 14. Електрохімічна система складається з 2 частин: електроду та електроліту. Електрод – це двохвазний прилад, в якому
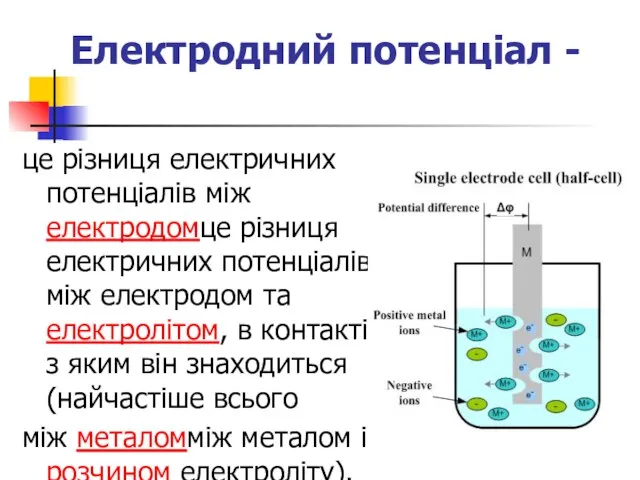
- 15. Електродний потенціал - це різниця електричних потенціалів між електродомце різниця електричних потенціалів між електродом та електролітом,
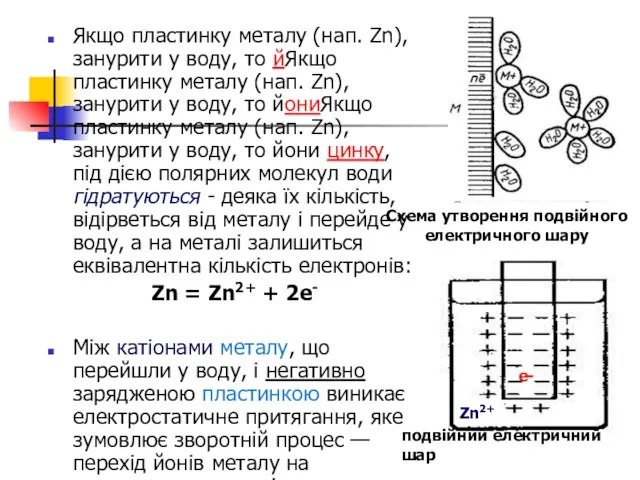
- 16. Якщо пластинку металу (нап. Zn), занурити у воду, то йЯкщо пластинку металу (нап. Zn), занурити у
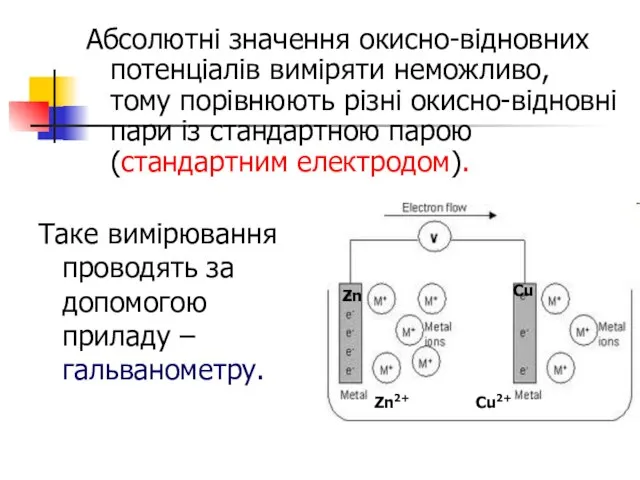
- 17. Абсолютні значення окисно-відновних потенціалів виміряти неможливо, тому порівнюють різні окисно-відновні пари із стандартною парою (стандартним електродом).
- 18. На величину електродного потенціалу впливають: температура; концентрація; активність металу; активність йонів металу; середовище розчину.
- 19. рівняння Нернста-Петерса: виражає кількісну залежність між величиною потенціалу, співвідношенням окисленої і відновленої форми і температурою: де
- 20. Якщо підставити в це рівняння числові значення константи і від натуральних логарифмів перейти до десяткових, то
- 21. Електроди діляться на Електроди І роду - це металеві пластинки занурені в розчин власних йонів. Схематично
- 22. Стандартний (нормальний) водневий електрод являє собою платинову пластинку, покриту платиною, занурену в розчин кислоти активність іонів
- 23. Електрод, потенціал якого визачають, називають електродом визначення. Інший електрод з відомим значенням електродного потенціалу називають електродом
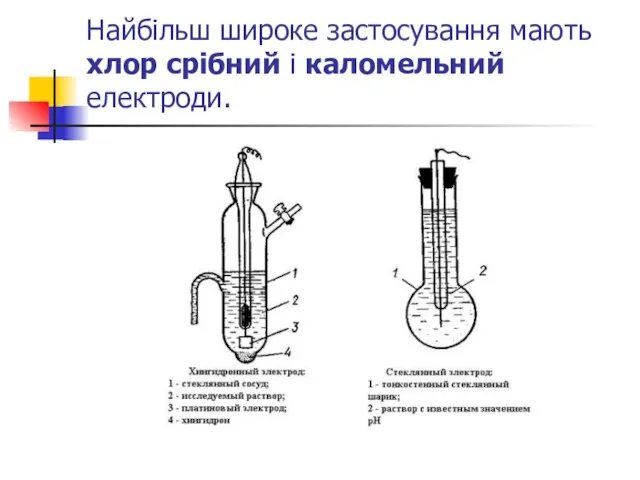
- 24. Найбільш широке застосування мають хлор срібний і каломельний електроди.
- 25. Потенціал спокою – 75 МВ Цей потенціал виміряний у стані фізіологічного спокою клітини. Якщо нервову тканину
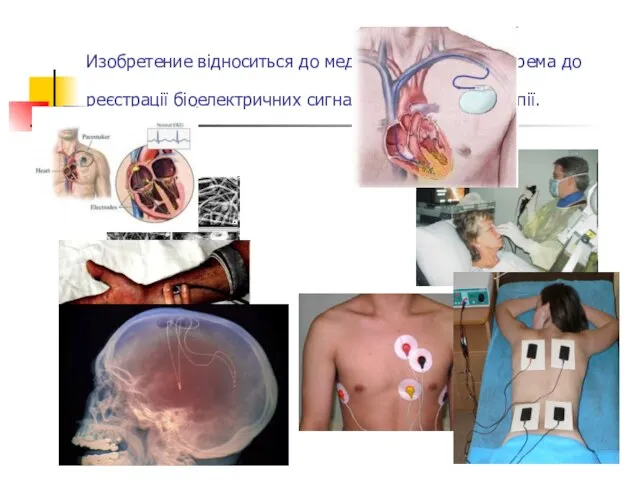
- 26. Изобретение відноситься до медицини і біології, зокрема до реєстрації біоелектричних сигналів і до електротерапії.
- 28. Скачать презентацию



















 Лекция 18. Фармакологическая регуляция гемостаза
Лекция 18. Фармакологическая регуляция гемостаза Работа врачей общей практики в г. Гродно
Работа врачей общей практики в г. Гродно Любовь или созависимость
Любовь или созависимость Общая и частная психопатология
Общая и частная психопатология Зарубежная психология периода открытого кризиса (10-е - середина 30-х годов 20 века)
Зарубежная психология периода открытого кризиса (10-е - середина 30-х годов 20 века)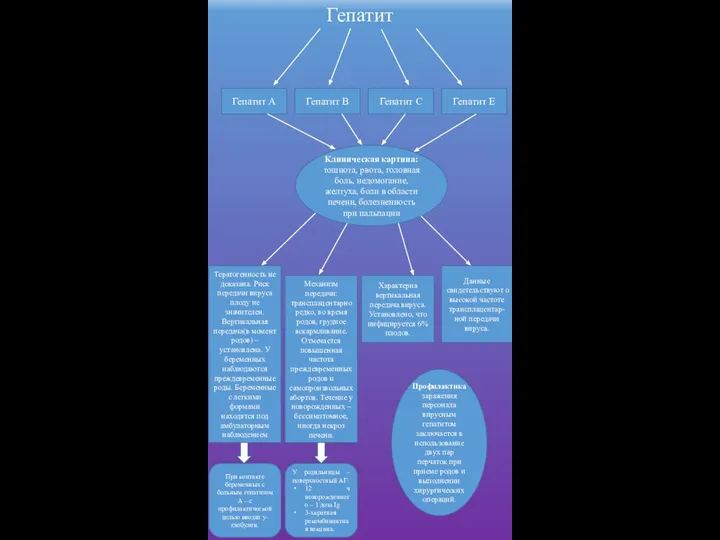 Гепатит
Гепатит Правильное питание
Правильное питание Психологическая классификация профессий (специальностей)
Психологическая классификация профессий (специальностей) Ведение пациентов с внебольничной пневмонией
Ведение пациентов с внебольничной пневмонией ЭТИОЛОГИЯ
ЭТИОЛОГИЯ Одонтогенные опухоли
Одонтогенные опухоли Причины конфликтов
Причины конфликтов презентация_авт
презентация_авт Расстройства воли и влечений, двигательные нарушения
Расстройства воли и влечений, двигательные нарушения Особенности Профессиональной гигиены у детей и подростков
Особенности Профессиональной гигиены у детей и подростков Лечебная физкультура при нарушениях осанки
Лечебная физкультура при нарушениях осанки Практики выявления и исцеления психосоматических заболеваний
Практики выявления и исцеления психосоматических заболеваний Диагностика заболеваний глотки и гортани. Аденоиды
Диагностика заболеваний глотки и гортани. Аденоиды Венерические болезни. Раздел 4. Гонорея у мужчин, женщин и детей
Венерические болезни. Раздел 4. Гонорея у мужчин, женщин и детей Гонококковая инфекция у женщин
Гонококковая инфекция у женщин Антигипертензивные лс. Мочегонные лс ( диуретики) . Лс повышающие артериальное давление (гипертензивные лс)
Антигипертензивные лс. Мочегонные лс ( диуретики) . Лс повышающие артериальное давление (гипертензивные лс) Влияние излучения, исходящего из сотового телефона на организм человека
Влияние излучения, исходящего из сотового телефона на организм человека Презентация по медицине Гнойные заболевания костей и суставов
Презентация по медицине Гнойные заболевания костей и суставов  Острое воспаление
Острое воспаление Искусственные органы
Искусственные органы Отчет о производственной практике в стоматологической поликлинике
Отчет о производственной практике в стоматологической поликлинике Инфекциялық иммунология негіздері. Иммунитет түрлері және формалары. Организмнің бейспецификалық қорғаныс
Инфекциялық иммунология негіздері. Иммунитет түрлері және формалары. Организмнің бейспецификалық қорғаныс 10 аргументов, чтобы прекратить потребление алкоголя
10 аргументов, чтобы прекратить потребление алкоголя