Содержание
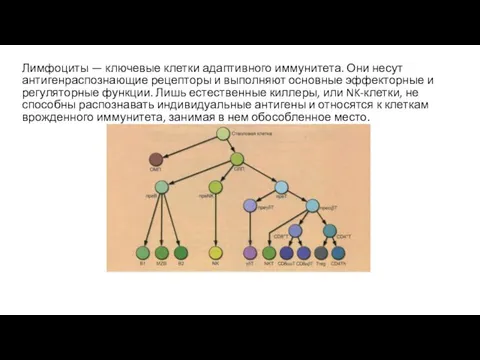
- 2. Лимфоциты — ключевые клетки адаптивного иммунитета. Они несут антигенраспознающие рецепторы и выполняют основные эффекторные и регуляторные
- 3. Мембранные маркеры лимфоцитов. Мембранные молекулы отмечены линиями, пересекающими круг. Цветом выделены разные функциональные группы молекул. NKT-клетка
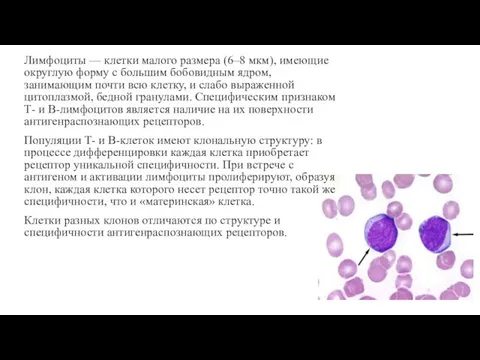
- 4. Лимфоциты — клетки малого размера (6–8 мкм), имеющие округлую форму с большим бобовидным ядром, занимающим почти
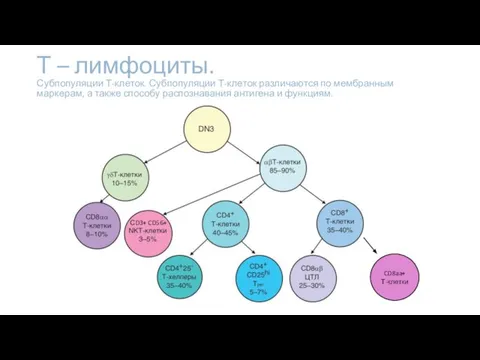
- 5. Т – лимфоциты. Субпопуляции Т-клеток. Субпопуляции Т-клеток различаются по мембранным маркерам, а также способу распознавания антигена
- 6. Т-клетки — разновидность лимфоцитов, основные этапы развития которых проходят в тимусе, что и определило их название
- 7. Наивные Т-лимфоциты включают 2 основных варианта клеток, отличающихся по структуре TCR: γδT-клетки (TCR образован цепями γ
- 9. В составе αβТ-клеток выявляют 4 субпопуляции: CD8+ Т-лимфоциты выполняют функции цитотоксических клеток, что и определило их
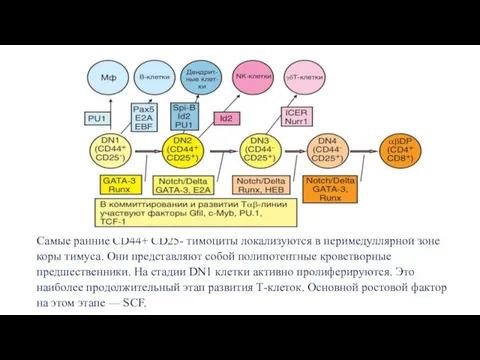
- 10. В развитие αβТ-клеток выделяют следующие стадии: Миграция в тимус клеток-предшественников; Развитие дважды отрицательных тимоцитов и перестройка
- 11. В тимус мигрируют ранние лимфоидные предшественники (ELP) — клетки, находящиеся на более ранней стадии развития, чем
- 12. Самые ранние CD44+ CD25- тимоциты локализуются в перимедуллярной зоне коры тимуса. Они представляют собой полипотентные кроветворные
- 13. На стадии DN2 тимоциты перемещаются в сторону наружных слоев коры. Длительность стадии — 2 суток. Клетки
- 14. К концу фазы DN3 тимоциты приобретают фенотип CD44-CD25+. Длительность фазы DN3 до β-селекции составляет 2 сут,
- 15. Селекция тимоцитов и формирование субпопуляций CD4+ и CD8+ клеток. Дважды положительные клетки очень чувствительны к апоптозу.
- 16. Если TCR обладает сродством к молекуле MHC, тимоцит получает поддерживающий сигнал. На поверхности экспрессируется маркера активации
- 17. Т-лимфоциты, рецепторы которых лишены сродства к МНС, подвергаются апоптозу «по умолчанию», т.е. не в силу сигнала
- 18. Отрицательная селекция. Клетки, обладающие высоким сродством, подвергаются апоптозу как потенциально опасные, низким сродством- как не эффективные.
- 19. Дифференцировка CD4+ и CD8+ тимоцитов Одновременно с селекцией тимоцитов происходит разделение их на субпопуляции CD4 или
- 20. После такой селекции путем подтверждения адекватности корецептора клетка приобретает функциональные свойства, соответствующие ее назначению. CD8+ T-клетки
- 21. Естественные субпопуляции переферических Т-лимфоцитов Развитие Т-клеток в тимусе длится около 20 сут. За это время, с
- 22. Т-цитотоксические лимфоциты CD8ab Цитотоксические T-лuмфоциты. Наивные CD8 Т-клетки являются предшественниками Тс-лимфоцитов. Они не проявляю цитотоксической активности
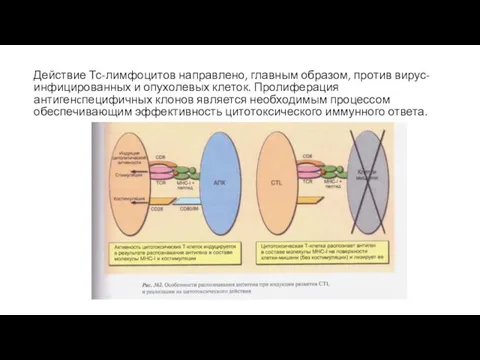
- 23. Действие Тс-лимфоцитов направлено, главным образом, против вирус-инфицированных и опухолевых клеток. Пролиферация антигенcпецифичных клонов является необходимым процессом
- 24. Однако накопление клеточных эффекторов занимает период в 5-7 дней. Это и определяет подключение на ран лимфоцитов,
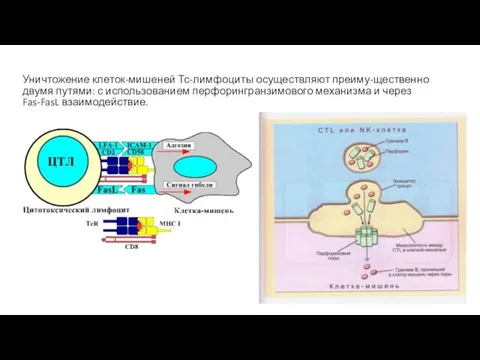
- 25. Уничтожение клеток-мишеней Тс-лимфоциты осуществляют преиму-щественно двумя путями: с использованием перфорингранзимового механизма и через Fas-FasL взаимодействие.
- 26. Т –хелперы CD4+ CD25- T-лимфоциты, главной функцией которых является усиление адаптивного иммунного ответа. Активируют Т-киллеры, B-лимфоциты,
- 27. Дифференцировка Т-хелперов Под влиянием активации в результате изменений структуры хроматина гены цитокинов становятся доступными для регулирующих
- 28. Адаптивные субпопуляции Т-хелперов
- 29. За дифференцировку Тh-клеток отвечают цитокины
- 30. Различие спектра гуморальных продуктов, прежде всего ключевых цитокинов Th1- и Th2-клеток (соответственно IFNγ и IL-4) определяет
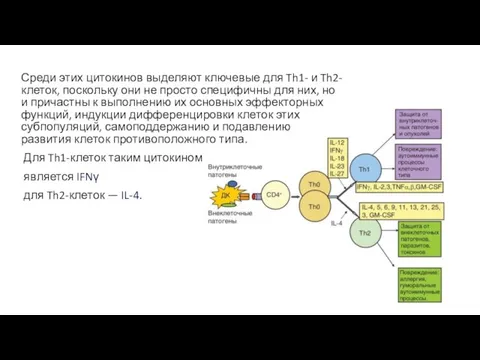
- 31. Среди этих цитокинов выделяют ключевые для Th1- и Th2-клеток, поскольку они не просто специфичны для них,
- 33. Факторы запускающую дифференцировку Th1- и Th2-клеток: первый поступает через TCR и ≪сообщает≫ о распознавании антигена в
- 34. Th1- лимфоциты Они активны в отношении внутриклеточных микроорганизмов. Включая пролиферацию наивных CD8+ Тс- лимфоцитов (IL-2) и
- 35. Th2- лимфоциты Дифференцировка Th2-лимфоцитов приводит к индукции антипарзиторного иммунитета. Продукция IL-5 приводит к развитию эозинофилии. IL-4
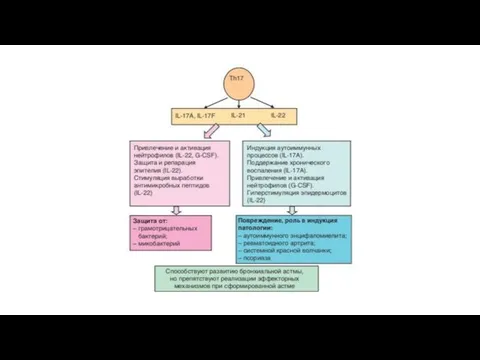
- 36. Th-17 лимфоциты Образование Th17-клеток преимущественно направлено против ряда внеклеточных микроорганизмов (бактерий и грибов) и сопровождается включением
- 39. iTreg- лимфоциты Еще одна субпопуляция, развивающаяся из наивных CD4 T-клеток iTreg. Она занимает особое место, так
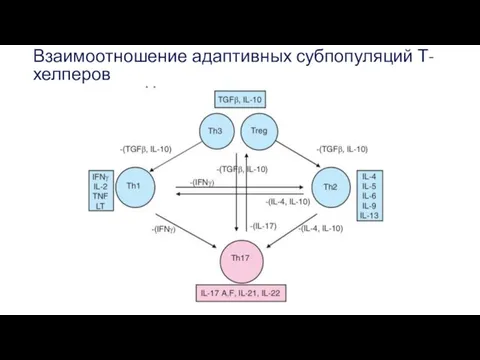
- 40. Взаимоотношение адаптивных субпопуляций Т-хелперов
- 41. Естественные регуляторные Т-клетки (Тreg). Они выполняют супрессорные функции, и их главная задача — предотвращение развития аутоиммунных
- 42. Кроме того, на их поверхности присутствуют супрессорные аналоги костимулирующих молекул CTLA-4 и PD-1 и представитель семейства
- 43. Показано, что супрессорная активность CD4+ регуляторных T-клеток связана с транскрипционным фактором FОХР3 ( скурфин). мутации гена
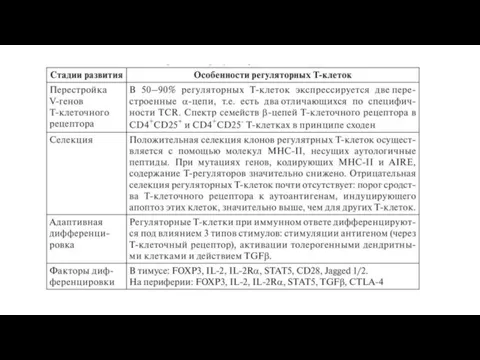
- 44. Развитие Т-регуляторных клеток Естественные регуляторные T-клетки развиваются преимущественно в тимусе. Необычность их дифференцировки состоит в приобретении
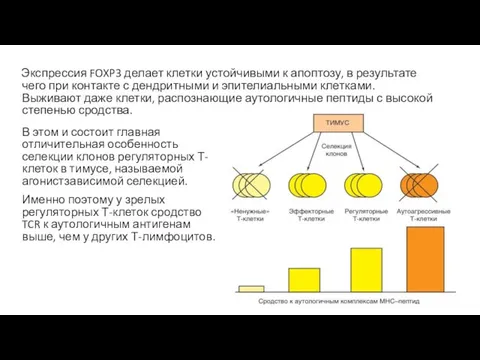
- 46. Экспрессия FOXP3 делает клетки устойчивыми к апоптозу, в результате чего при контакте с дендритными и эпителиальными
- 47. Функциональные особенности этих клеток гарантируют подавление активности аутреактивных эффекторных клеток, избежавших негативной селекции при развитии. По
- 48. В-лимфоциты Основное свойство В-лимфоцитов — экспрессия иммуноглобулинового рецептора для распознавания антигенов — BCR. На поверхности зрелой
- 49. Так, В-клетки несут на поверхности молекулы MHC I и II класса, костимулирующие молекулы CD40, CD86, а
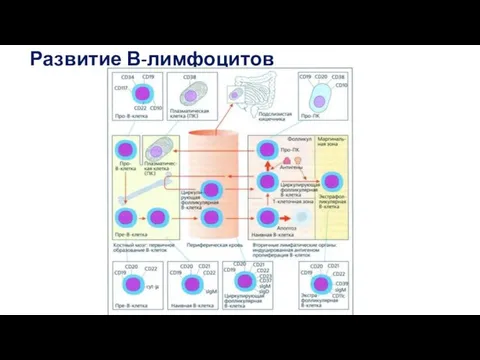
- 50. Развитие В-лимфоцитов
- 51. Основное событие дифференцировки В-клеток — формирование BCR, а точнее, лежащая в его основе перестройка V-генов иммуноглобулинов.
- 52. Перестройку V-генов в В-клетках контролирует микроокружение, индуцирующее экспрессию в них дифференцировочных факторов. Развитие лимфоцитов в направлении
- 54. Первым типом Н-цепейкоторые появляется на поверхности, является IgM. Стадию, на которой на поверхности В-клетки присутствуют только
- 55. Экспрессия мембранных маркеров
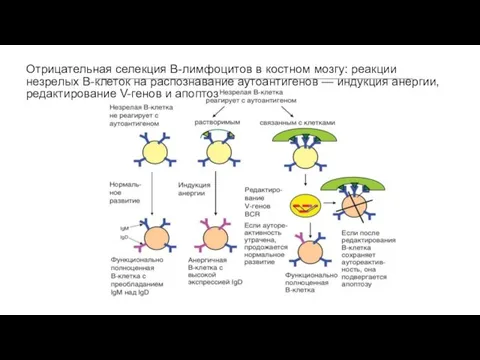
- 56. Установлено, что 55–75% В-клеток, образующихся в костном мозгу, специфичны к собственным антигенам организма — аутоантигенам. Уже
- 57. Отрицательная селекция В-лимфоцитов в костном мозгу: реакции незрелых В-клеток на распознавание аутоантигенов — индукция анергии, редактирование
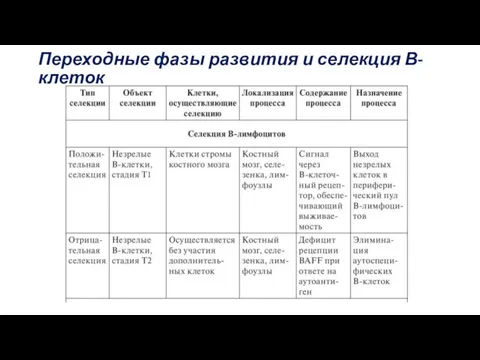
- 58. Переходные фазы развития и селекция В-клеток
- 59. Стадии T1. Фенотип В-клеток на стадии Т1 —IgMhi IgD-/lo CD23- CD21lo CD24hi.. В-клетки получают через BCR-сигнал,
- 60. Несмотря на ≪щадящий≫ режим селекции, на этом этапе сохраняется лишь 10–30% В-клеток, вышедших из костного мозга,
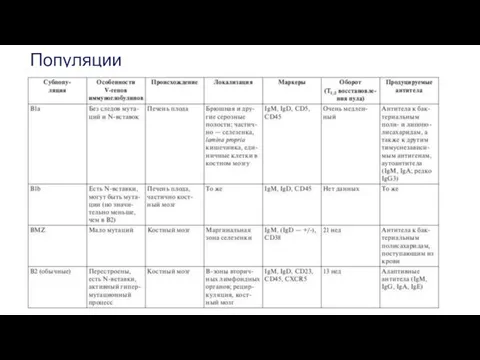
- 61. Популяции
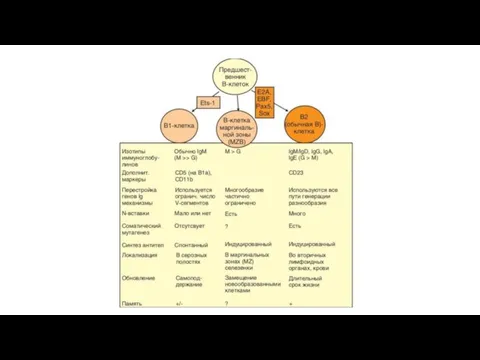
- 63. В1-клетки В1-клетки локализуются преимущественно в серозных полостях — брюшной и плевральной. Небольшое количество В1-лимфоцитов, преимущественно клетки,
- 64. B1а- и B1b-клетки экспрессируют BCR, содержащий мембранную форму IgM. Известны исключения: описано переключение IgM на IgA
- 65. Обе разновидности В1-клеток могут дифференцироваться в антителообразующие клетки без стимуляции антигеном. При этом они секретируют преимущественно
- 66. В2-лимфоциты В2-клетки , локализующиеся преимущественно в селезенке, костном мозгу, лимфоузлах, пейеровых бляшках и отдельных фолликулах лимфоидной
- 67. B-клетки маргинальной зоны (MZB) Они локализуются почти исключительно в маргинальной зоне селезенки, отделяющей белую пульпу от
- 68. Отделение линии MZB-клеток от общей линии В2-клеток происходит на переходной стадии транзиторных клеток (Т3), когда будущие
- 70. Скачать презентацию



















































 Книги Анатолия Некрасова. Дела семейные
Книги Анатолия Некрасова. Дела семейные Объекты и методы гистологических исследований. Основы цитологии
Объекты и методы гистологических исследований. Основы цитологии Сестринский уход при травмах глаза
Сестринский уход при травмах глаза Рекомендации ESC по клапанным порокам сердца
Рекомендации ESC по клапанным порокам сердца 15 октября - Всемирный день чистых рук
15 октября - Всемирный день чистых рук Чем характеризуется юность как часть жизненного пути
Чем характеризуется юность как часть жизненного пути Вирусные гепатиты
Вирусные гепатиты Деятельность телефонов доверия
Деятельность телефонов доверия Антиген
Антиген Bacterial infections, sepsis
Bacterial infections, sepsis Хронический колит
Хронический колит Социальная психология конфликтов
Социальная психология конфликтов Микробиологическая диагностика заболеваний, передающихся половым путем
Микробиологическая диагностика заболеваний, передающихся половым путем Іш қатудың дифференциальды диагностикасы
Іш қатудың дифференциальды диагностикасы Созылмалы панкреатит
Созылмалы панкреатит Перифериялық қанайналымның физиологиясы. Микроциркуляция
Перифериялық қанайналымның физиологиясы. Микроциркуляция Лихорадка Эбола. Руководство для сотрудников Shlumberger
Лихорадка Эбола. Руководство для сотрудников Shlumberger Средневековая медицина в христианском мире (VI-XVI вв.)
Средневековая медицина в христианском мире (VI-XVI вв.) Справка в один шаг
Справка в один шаг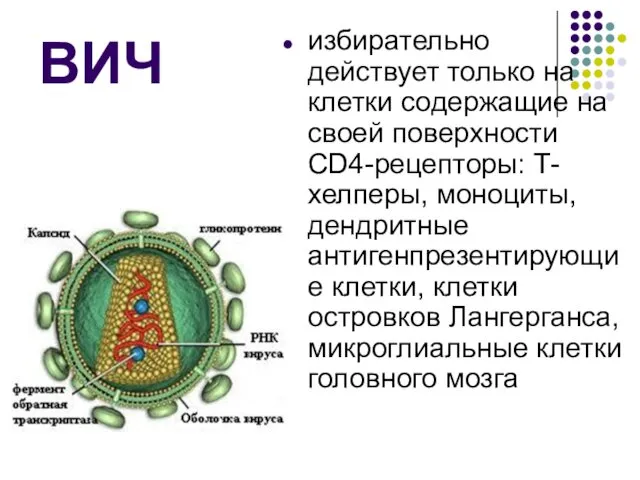 ВИЧ-инфекция
ВИЧ-инфекция Особенности логопедической работы с детьми с множественными нарушениями развития
Особенности логопедической работы с детьми с множественными нарушениями развития Буллинг и кибербуллинг: актуальные вопросы
Буллинг и кибербуллинг: актуальные вопросы Гигиена. Занятие 2
Гигиена. Занятие 2 Жатырдың тусуі
Жатырдың тусуі Питание детей дошкольного возраста
Питание детей дошкольного возраста Психология лени
Психология лени Атеросклероз. Стадии
Атеросклероз. Стадии Санитарно-эпидемиологические требования
Санитарно-эпидемиологические требования