Пример: выявление Escherichia coli (метод чашечного подсчета)
1. Образец готовят аналогично
как и для выявления ОКА и ОКГ
2. Испытанию подвергают количество, эквивалентное 1 г или 1 мл продукта
3. Инокулируют подходящее количество бульона на основе гидролизата казеина и соевых бобов, перемешивают, инкубируют при температуре 30-35°С в течение 18-24 ч.
4. Встряхивают контейнер, переносят 1 мл образца, полученного при выполнении п.3, в 100 мл бульона Макконки и инкубируют при температуре 42-44°С в течение 24 - 48 ч. – обогащение
5. Пересевают подходящее количество образца, полученного при выполнении п.4, на чашки с агаром Макконки и инкубируют при температуре 30-35°С в течение 18-72 ч. – индикация
6. Интерпретация результатов: рост характерных колоний свидетельствует о возможном присутствии Escherichia coli. Результат подтверждается идентификационными испытаниями.
7. Продукт выдерживает испытания, если подобные колонии не обнаруживаются или испытания идентификации дают отрицательный результат.
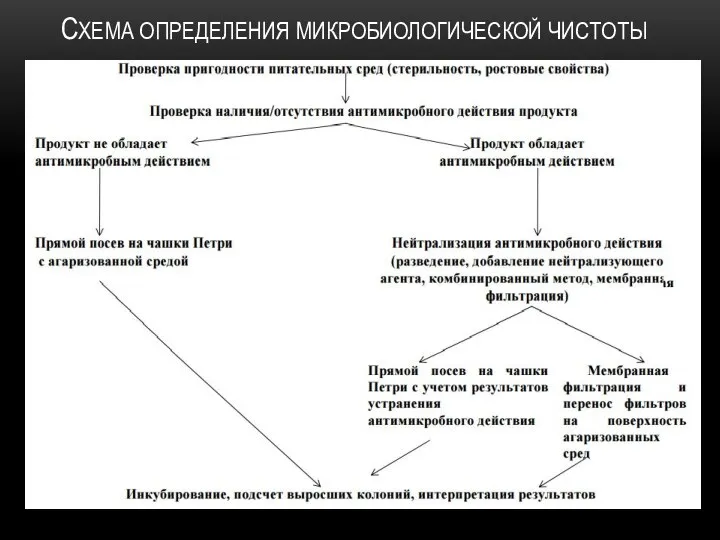
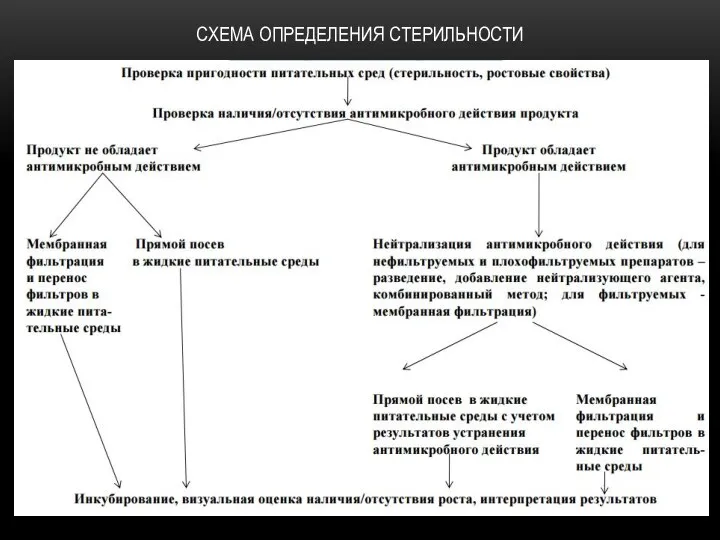
ОПРЕДЕЛЕНИЕ МИКРОБИОЛОГИЧЕСКОЙ ЧИСТОТЫ : ИСПЫТАНИЯ НА НАЛИЧИЕ СПЕЦИФИЧЕСКИХ МИКРООРГАНИЗМОВ












 СНК Организатор Здравоохранения кафедры организации здравоохранения и общественного здоровья
СНК Организатор Здравоохранения кафедры организации здравоохранения и общественного здоровья Дәлелді медицина және маркетинг
Дәлелді медицина және маркетинг Противоболевые лекарственные средства. Анальгетики (analgetica)
Противоболевые лекарственные средства. Анальгетики (analgetica) Зупинимо булінг разом
Зупинимо булінг разом Ваша личность из 1800 деталей
Ваша личность из 1800 деталей Биорезонансноая терапия аллергических заболеваний
Биорезонансноая терапия аллергических заболеваний Современный подход к производству биологически активных комплексов. Арт Лайф
Современный подход к производству биологически активных комплексов. Арт Лайф Результаты применения ремаксола при проведении полихимиотерапии
Результаты применения ремаксола при проведении полихимиотерапии Імуносуспресивна дія мезенхімних стовбурових (стромальних) клітин
Імуносуспресивна дія мезенхімних стовбурових (стромальних) клітин Травмы головы, позвоночника и спины
Травмы головы, позвоночника и спины Беременность и сахарный диабет
Беременность и сахарный диабет Миокардиты
Миокардиты Система психологического образования в России и в мире
Система психологического образования в России и в мире Геморрой — царская болезнь
Геморрой — царская болезнь Компрессионно-дистракционный остеосинтез
Компрессионно-дистракционный остеосинтез Хирургия. Анестезиология. Кровезаменители
Хирургия. Анестезиология. Кровезаменители Гонорея
Гонорея Хронический гнойный эпитимпанит
Хронический гнойный эпитимпанит Вакциопрофилактика
Вакциопрофилактика Свойства салициловой кислоты и ее производных. Их использование в медицинских препаратах
Свойства салициловой кислоты и ее производных. Их использование в медицинских препаратах Синдром дефицита внимания с гиперактивностью
Синдром дефицита внимания с гиперактивностью Медицина қызметкерлерінің еңбек гигиенасының негізгі аспектілері
Медицина қызметкерлерінің еңбек гигиенасының негізгі аспектілері Биомаркеры, как новый метод диагностики синдрома раздраженной кишки
Биомаркеры, как новый метод диагностики синдрома раздраженной кишки Базовые реанимационные мероприятия
Базовые реанимационные мероприятия Патопсихология эмоций и двигательно-волевой сферы
Патопсихология эмоций и двигательно-волевой сферы Рекомендации по лечению острого коронарного синдрома без стойкого подъема сегмента ST (ESC 2015)
Рекомендации по лечению острого коронарного синдрома без стойкого подъема сегмента ST (ESC 2015) Вильгельм Конрад Рентген
Вильгельм Конрад Рентген Автоматизированные системы медицинских осмотров
Автоматизированные системы медицинских осмотров