Содержание
- 2. Основные разделы курса: 1. Метаболизм ксенобиотиков и эндогенных соединений 2. Механизмы повреждения макромолекул 3. Защитные механизмы
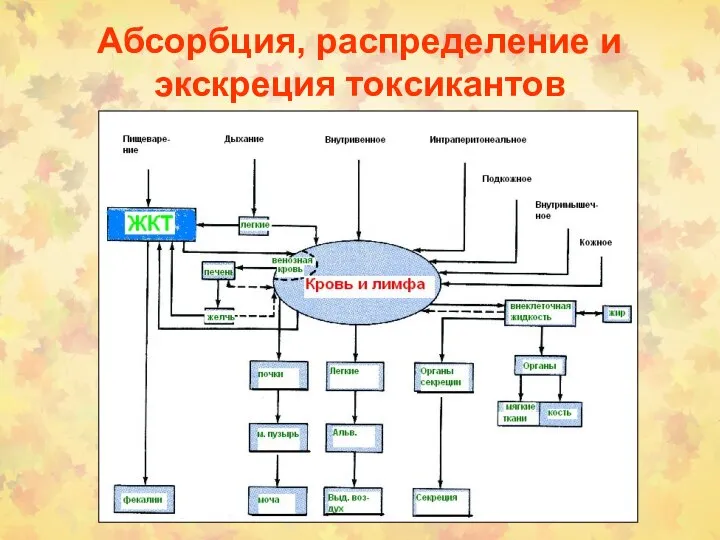
- 3. Абсорбция, распределение и экскреция токсикантов
- 5. Метаболизм ксенобиотиков
- 6. Ксенобиотики. Примеры Синтетические Природные Пищевые добавки, стабилизаторы, красители, инсектициды, гербициды, лекарства, косметические средства и т.д. Токсины
- 7. Этапы метаболизма ксенобиотиков 1-я фаза (окисление, гидролиз, восстановление) 2-я фаза (реакции, катализируемые трансферазами) 3-я фаза (белки-транспортеры)
- 8. Этапы метаболизма КСБ I фаза: окисление/восстановление (оксидоредуктазы) II фаза: присоединение функциональных групп (трансферазы)
- 10. 2-я фаза метаболизма КСБ
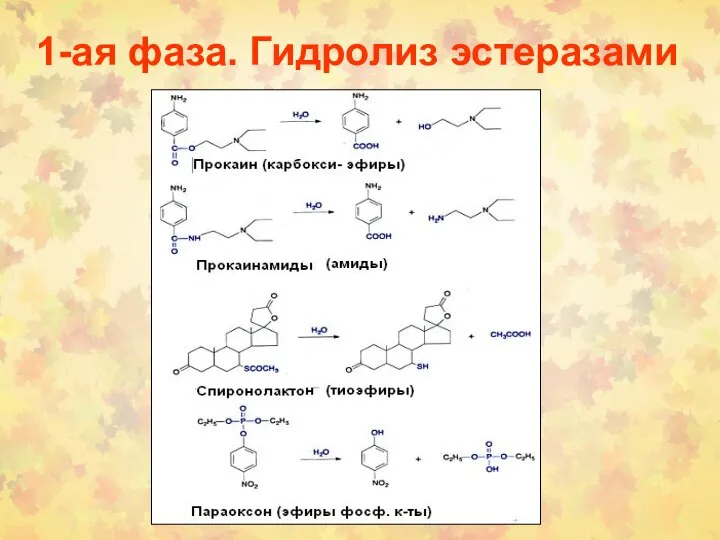
- 11. 1-ая фаза. Гидролиз эстеразами
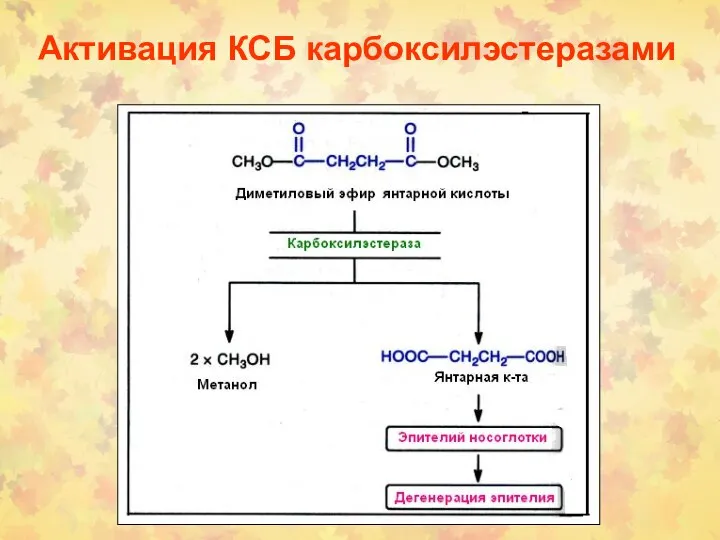
- 12. Активация КСБ карбоксилэстеразами
- 13. Активация КСБ карбоксилэстеразами
- 14. Структура и функции цитохрома Р450 (CYP)
- 15. История вопроса В 1956 г. Аксельрод описал N-деметилирование наркотических веществ в ЭПР гепатоцитов крыс В 1958
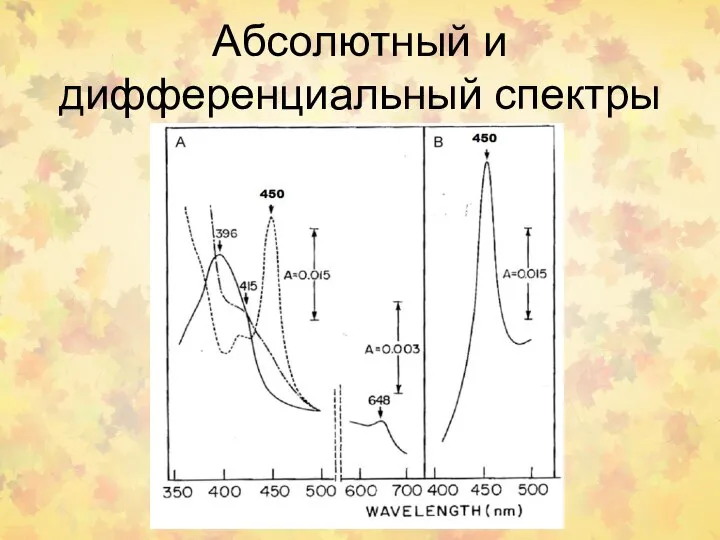
- 16. Абсолютный и дифференциальный спектры
- 17. Реакция, катализируемая цитохромами Р450 RH + О2 + NADPH + H+ → ROH + Н2O +
- 18. Реакции, катализируемые оксидазами
- 19. Микросомальная электрон-транспортная цепь
- 20. Р450 микросом и митохондрий
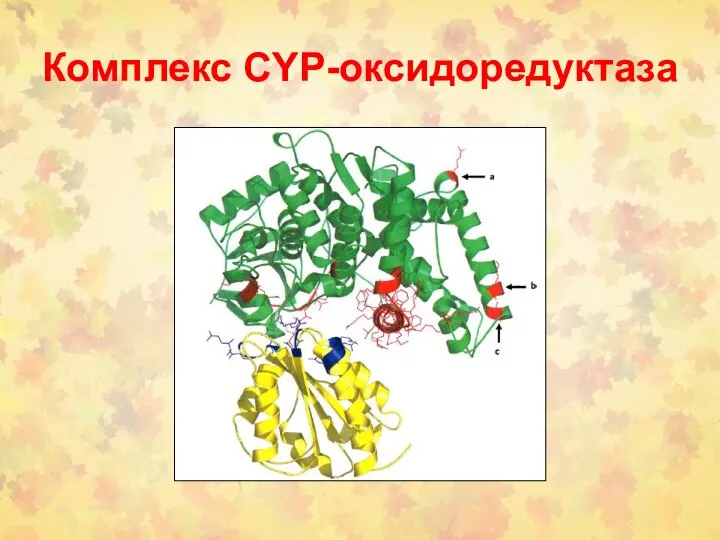
- 21. Комплекс CYP-оксидоредуктаза
- 22. Этапы гидроксилирования цитохромом Р450
- 23. Этапы гидроксилирования цитохромом Р450
- 24. Содержание CYP в разных органах человека
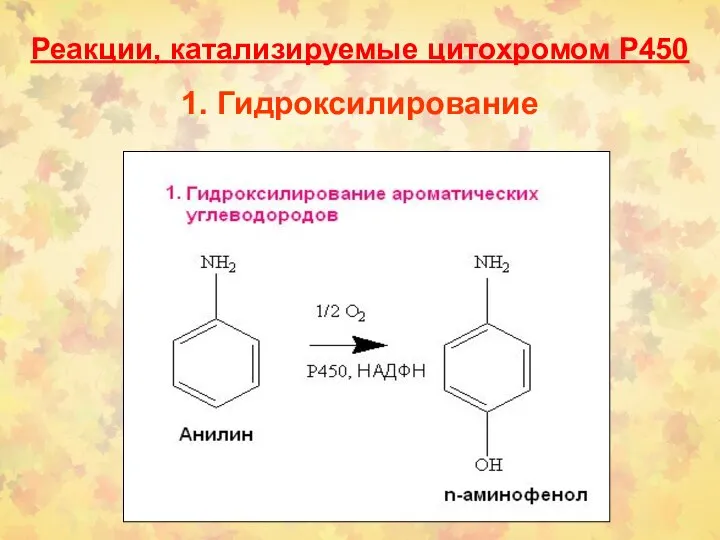
- 25. Реакции, катализируемые цитохромом Р450 1. Гидроксилирование
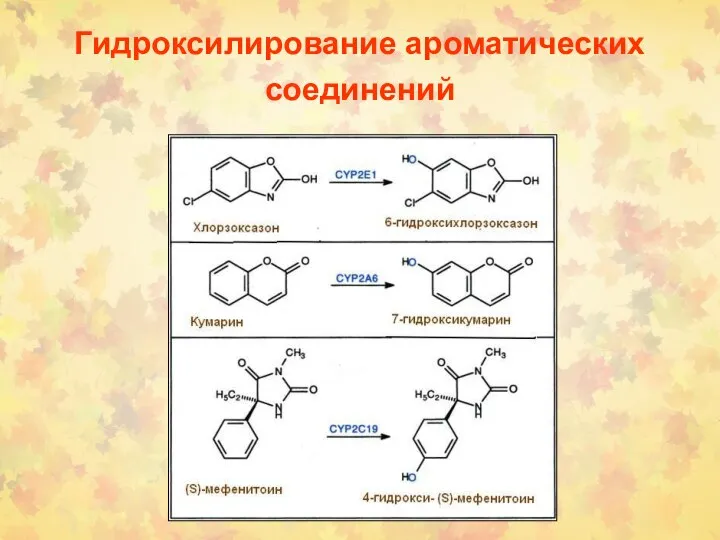
- 26. Гидроксилирование ароматических соединений
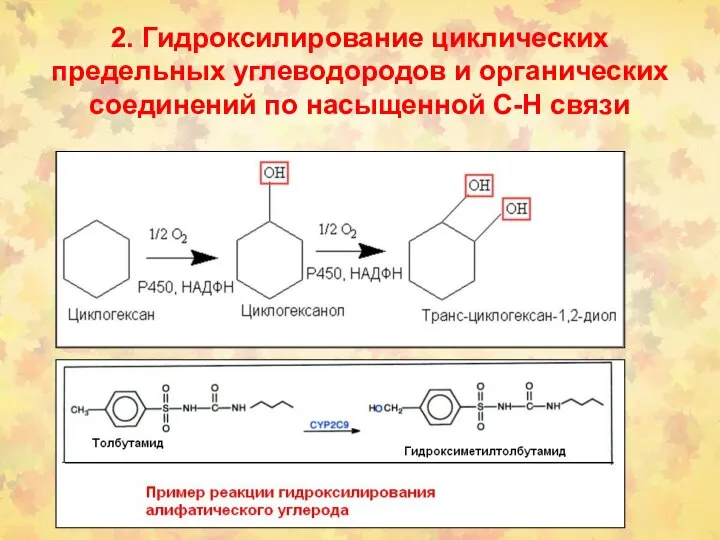
- 27. 2. Гидроксилирование циклических предельных углеводородов и органических соединений по насыщенной С-Н связи
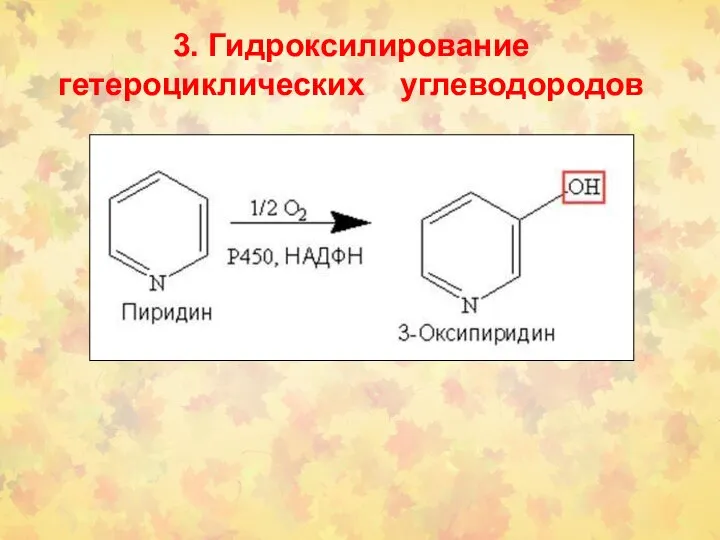
- 28. 3. Гидроксилирование гетероциклических углеводородов
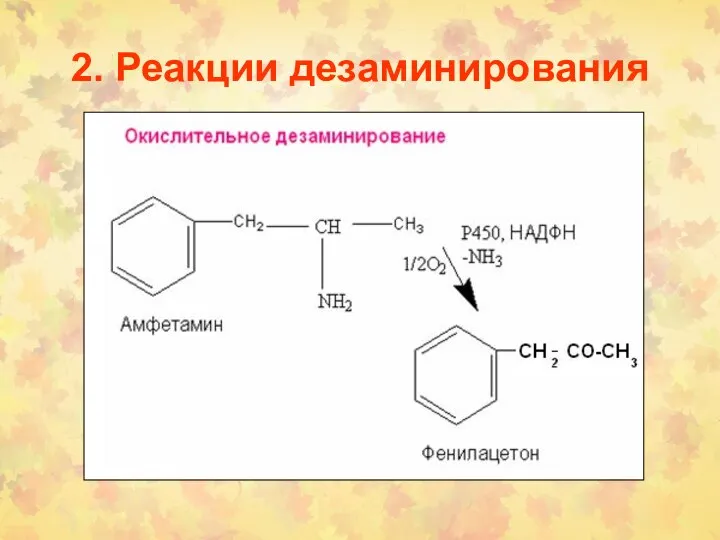
- 29. 2. Реакции дезаминирования
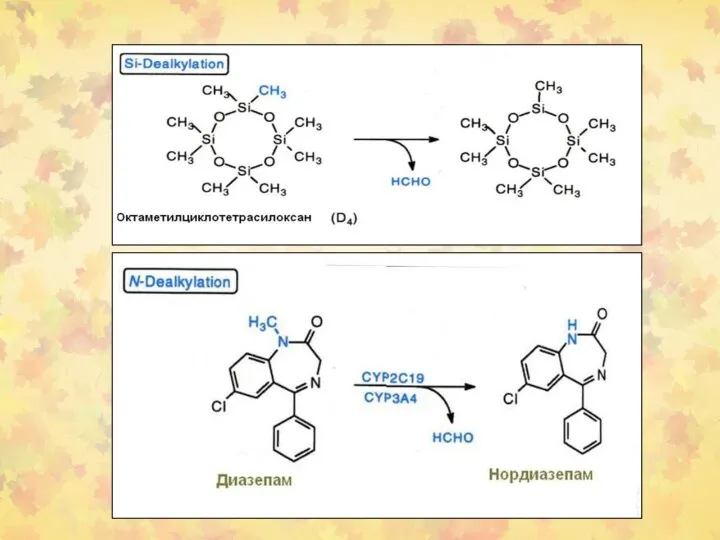
- 30. 3. Окислительное деалкилирование
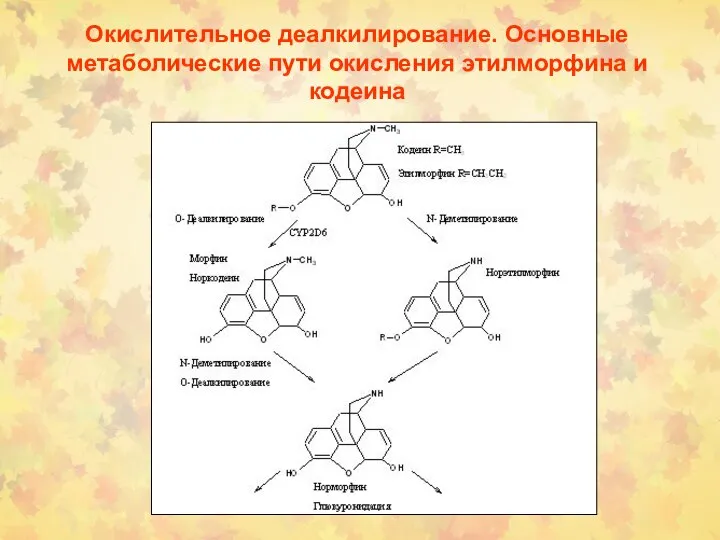
- 34. Окислительное деалкилирование. Основные метаболические пути окисления этилморфина и кодеина
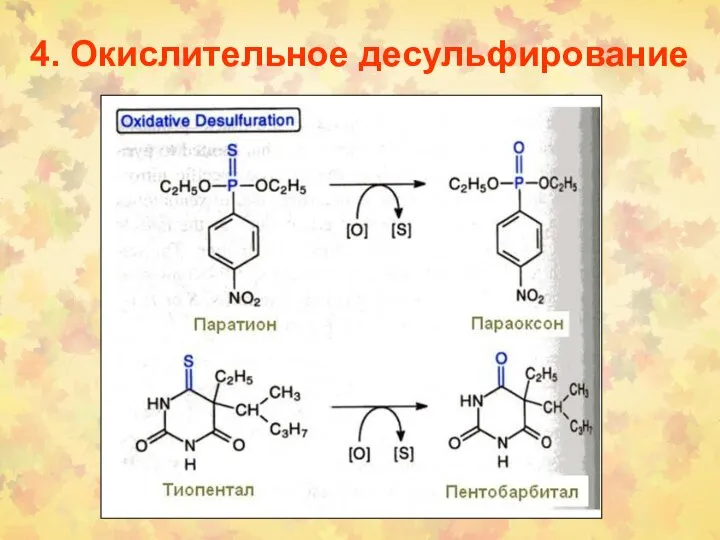
- 35. 4. Окислительное десульфирование
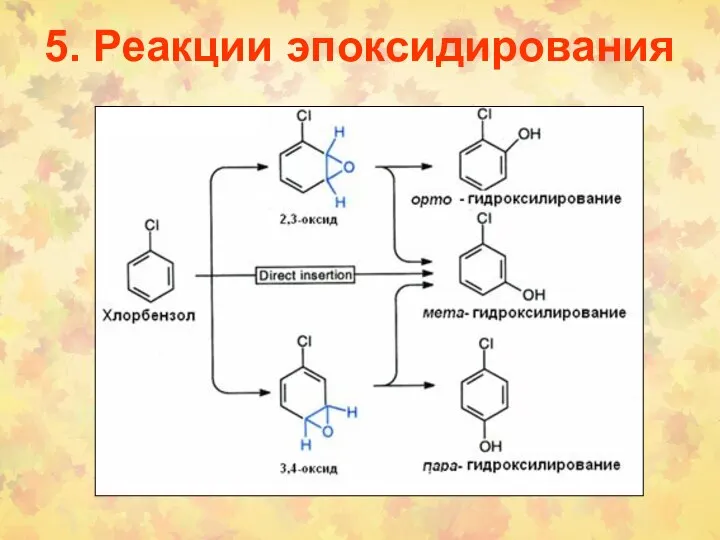
- 36. 5. Реакции эпоксидирования
- 38. Примеры реакций восстановления лекарств
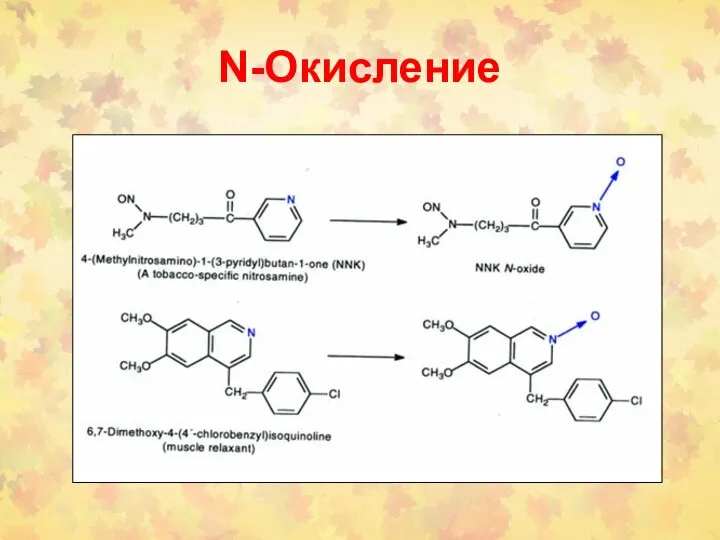
- 39. N-Окисление
- 40. NADPH-зависимые монооксигеназы
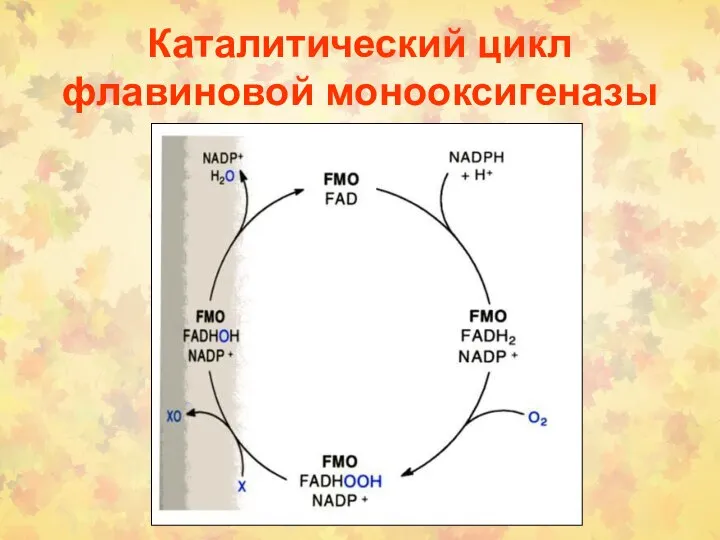
- 41. Каталитический цикл флавиновой монооксигеназы
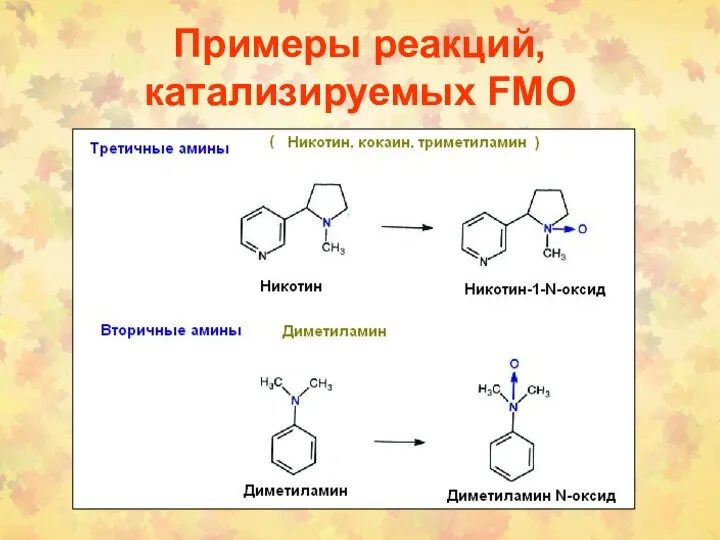
- 42. Примеры реакций, катализируемых FMO
- 44. Множественные формы цитохрома Р450
- 45. Множественные формы цитохрома Р450 У человека открыто 58 цитохромов P450 (CYP), принадлежащих к 18-ти семействам. Они
- 46. Характеристика CYPs человека
- 47. Цитохромы Р450 человека, окисляющие ксенобиотики
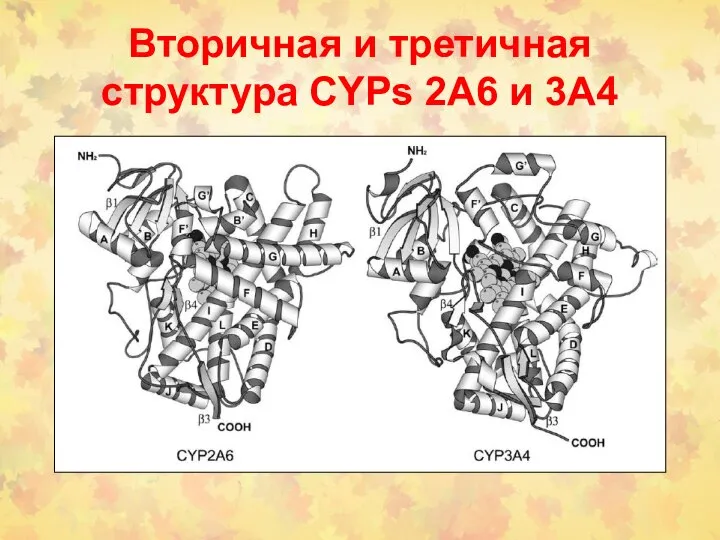
- 50. Вторичная и третичная структура CYPs 2A6 и 3A4
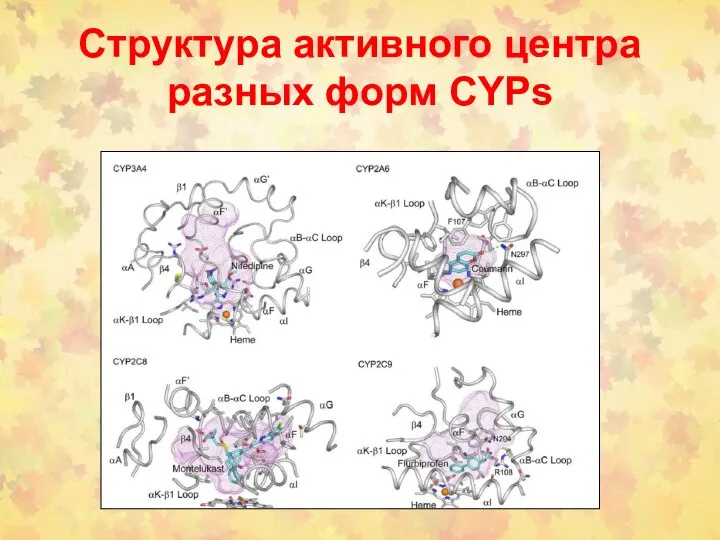
- 51. Структура активного центра разных форм CYPs
- 52. Доменная организация разных типов Р450 1- растворимая форма 2-митохондриальная 3-мембраносвязанная
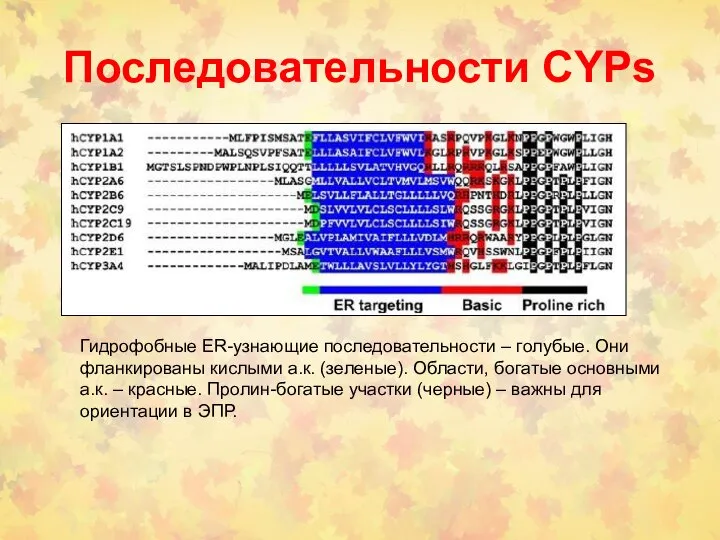
- 53. Последовательности CYPs Гидрофобные ER-узнающие последовательности – голубые. Они фланкированы кислыми а.к. (зеленые). Области, богатые основными а.к.
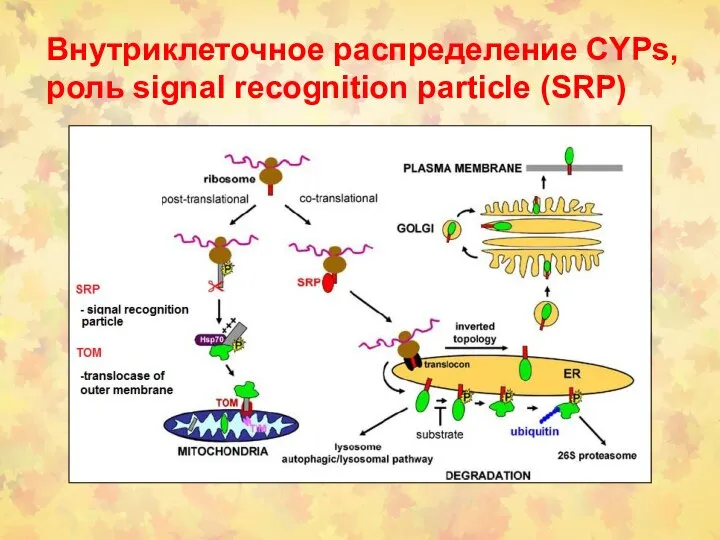
- 54. Внутриклеточное распределение CYPs, роль signal recognition particle (SRP)
- 55. Индукция CYPs Одним из важнейших свойств компонентов монооксигеназной системы, в частности цитохрома Р-450, является способность к
- 56. Уровни регуляции ферментативной активности цитохрома Р450
- 57. Индукция цитохромов Р450 различными соединениями
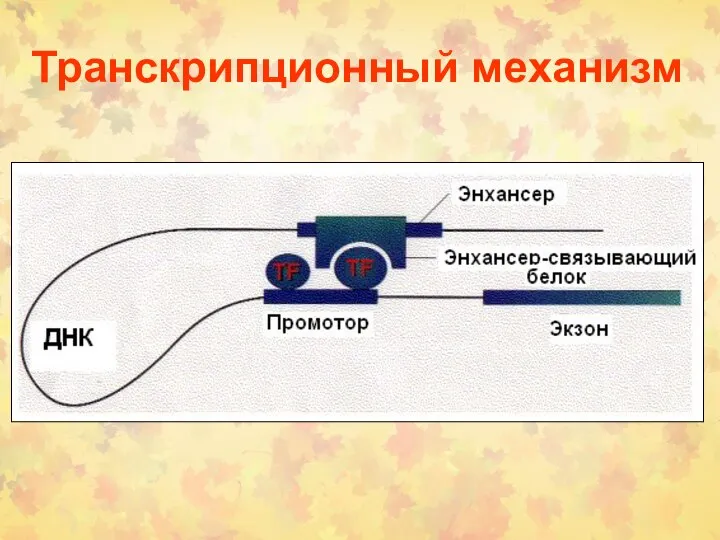
- 58. Транскрипционный механизм
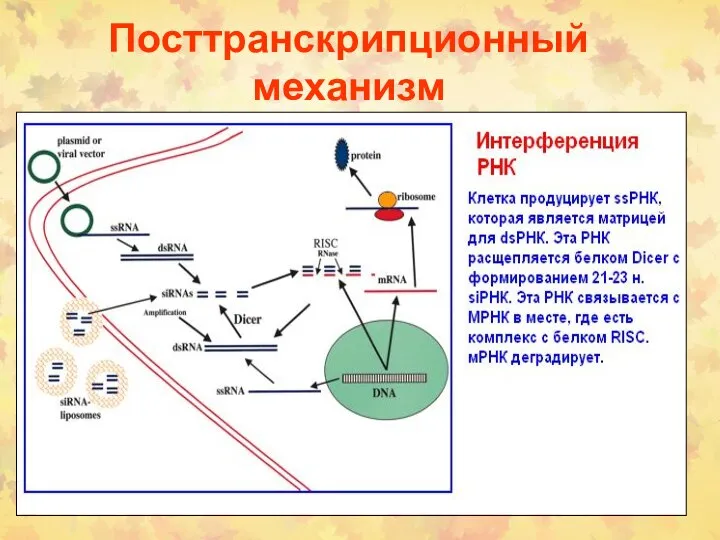
- 59. Посттранскрипционный механизм
- 60. Механизмы индукции CYPs Факторы транскрипции ТФ могут классифицироваться по (1) механизму действия (2) регуляторной функции (3)
- 61. Выделяют 3 класса факторов транскрипции (ФТ): Базальные ФТ, обеспечивающие нерегулируемый базальный уровень транскрипции и функционирующие в
- 62. ТФ по ключевым особенностям ДНК-связывающих доменов разделены на 4 следующих суперкласса: 1. Факторы, ДНК-связывающий домен которых
- 63. Структурная классификация ТФ 1 Надкласс: Basic Domains (Basic-helix-loop-helix) 1.1 Класс: Leucine zipper factors (bZIP) 1.1.1 Семейство:
- 64. Структурная классификация ТФ 2 Надкласс: Zinc-coordinating DNA-binding domains 2.1 Класс: Cys4 zinc finger of nuclear receptor
- 65. Структурная классификация ТФ 4 Надкласс: beta-Scaffold Factors with Minor Groove Contacts 4.1 Класс: RHR (Rel homology
- 66. Структурная классификация ТФ 0 Надкласс: Other Transcription Factors 0.1 Класс: Copper fist proteins 0.2 Класс: HMGI(Y)
- 67. Основные типы ФТ
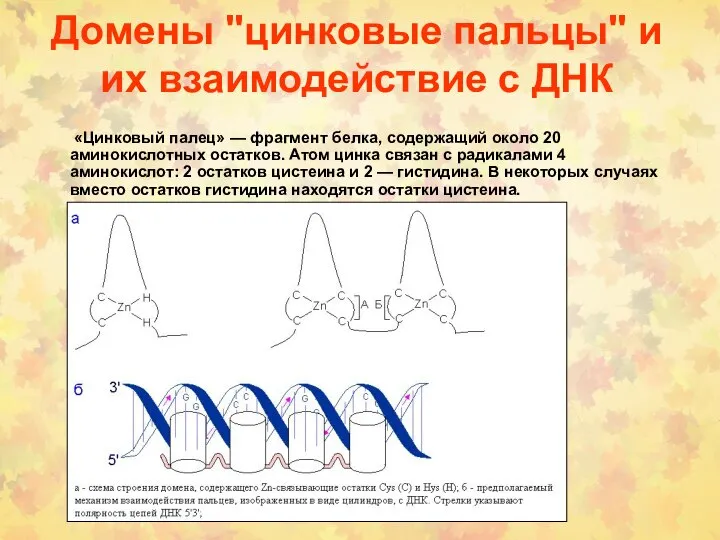
- 68. Домены "цинковые пальцы" и их взаимодействие с ДНК «Цинковый палец» — фрагмент белка, содержащий около 20
- 69. Домены лейциновая застежка Лейциновая молния leucine zipper. Содержит характерное распределение нескольких лейцинов, отделенных друг от друга
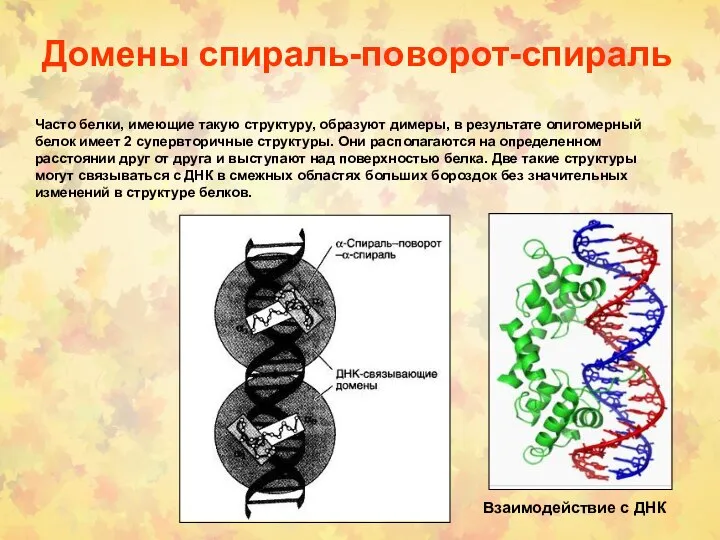
- 70. Домены спираль-поворот-спираль В данный структурный мотив входят 2 альфа-спирали: одна более короткая, другая более длинная, соединенные
- 71. Домены спираль-поворот-спираль Взаимодействие с ДНК Часто белки, имеющие такую структуру, образуют димеры, в результате олигомерный белок
- 72. Домены спираль-петля-спираль bHLH Белки bHLH контактируют с ДНК посредством своего положительно заряженного района. Они взаимодействуют с
- 73. Транскрипционные механизмы активации генов цитохрома Р450
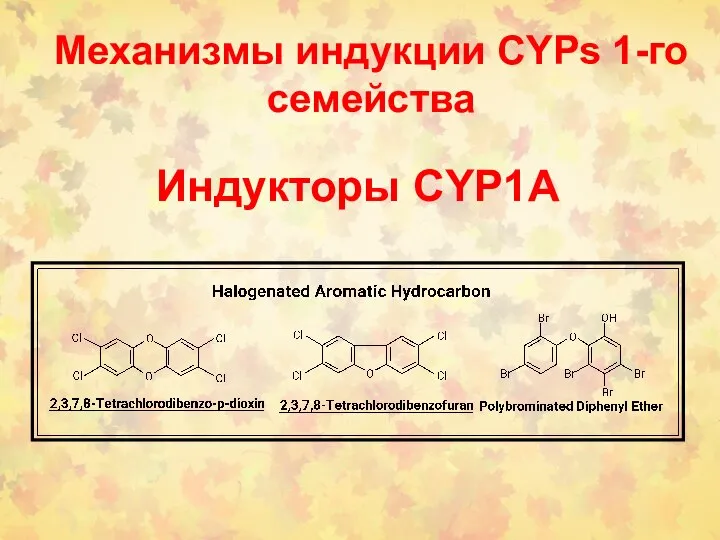
- 74. Индукторы CYP1A Механизмы индукции CYPs 1-го семейства
- 75. ПАУ-соединения – типичные индукторы CYP1А
- 76. Характеристика AHR AHR принадлежит к basic-helix-loop-helix (bHLH)/PAS : Per (“period,” regulator of circadian rhythms), Arnt (“Ah
- 77. Структура AHR
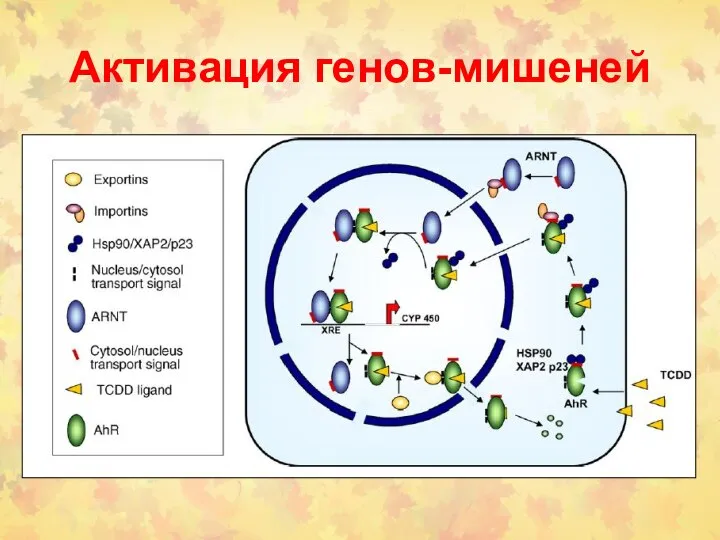
- 78. Активация генов-мишеней
- 79. Механизм активации AHR
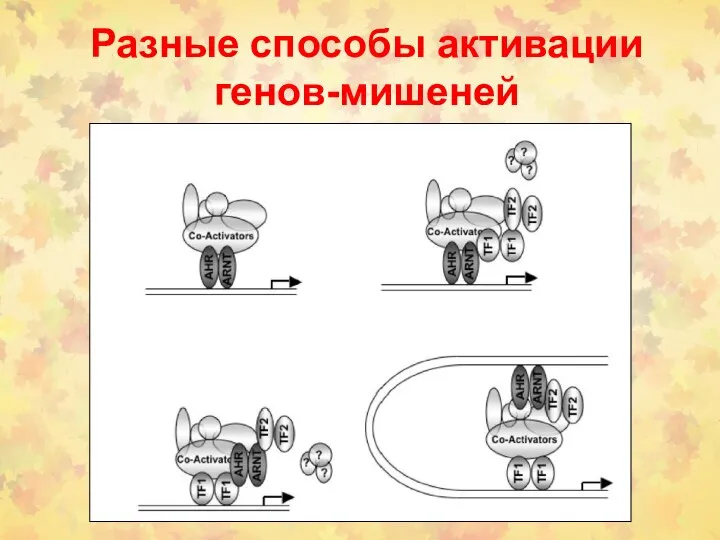
- 80. Разные способы активации генов-мишеней
- 81. Транскрипционная регуляция AhR/Arnt активаторного комплекса
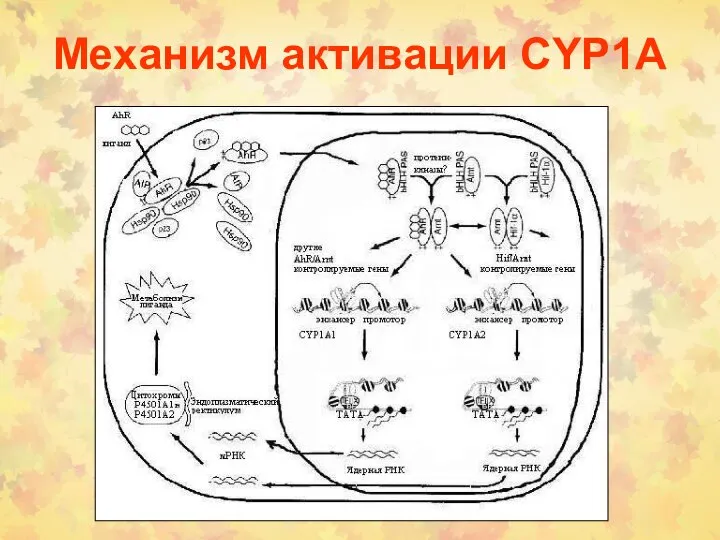
- 82. Механизм активации CYP1A
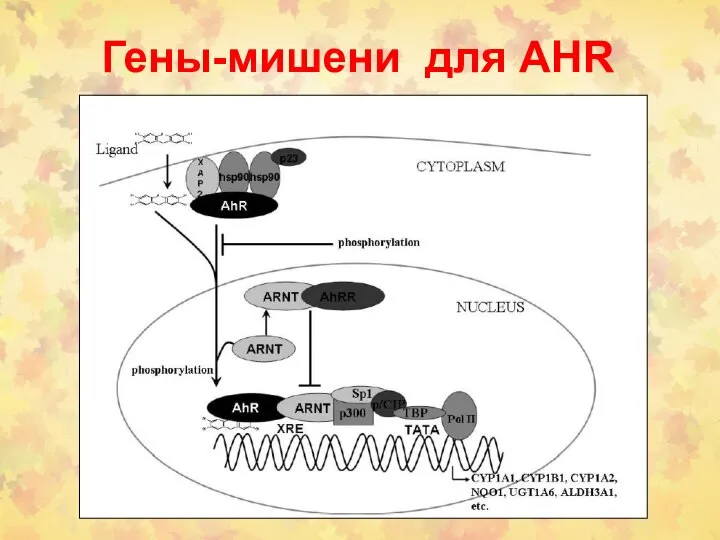
- 84. Гены-мишени для AHR
- 85. AHR нокаутные мыши Печень имеет небольшой размер, с портальным фиброзом, ранним накоплением липидов. Имеются васкулярные дефекты
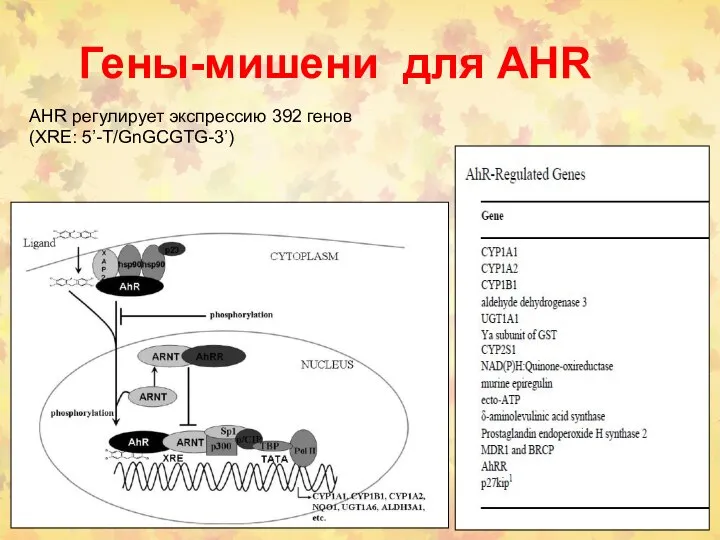
- 86. Гены-мишени для AHR AHR регулирует экспрессию 392 генов (XRE: 5’-T/GnGCGTG-3’)
- 87. Регуляция активности AHR
- 88. Взаимосвязь с ER
- 89. Токсические эффекты ТХДД
- 90. Трагедия в Севесо
- 91. Токсические эффекты ТХДД Ожидаемое время полувыведения ТХДД – около 5 лет (для индивидуумов, получивших высокую дозу
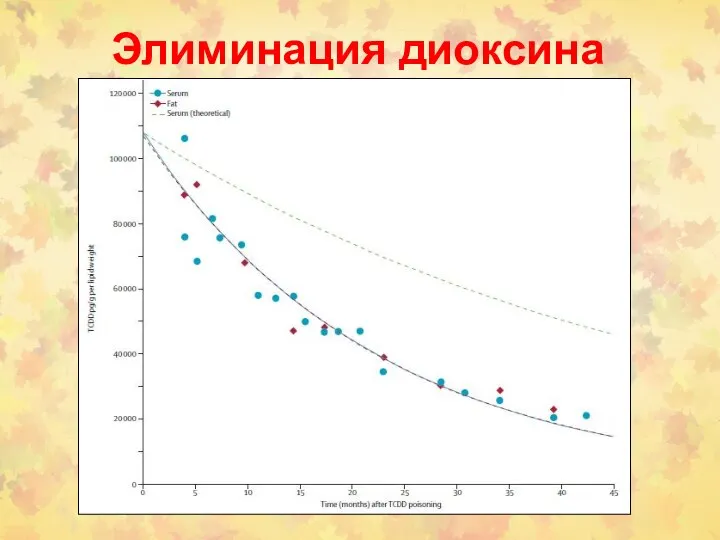
- 92. Элиминация диоксина
- 93. Динамика воздействия
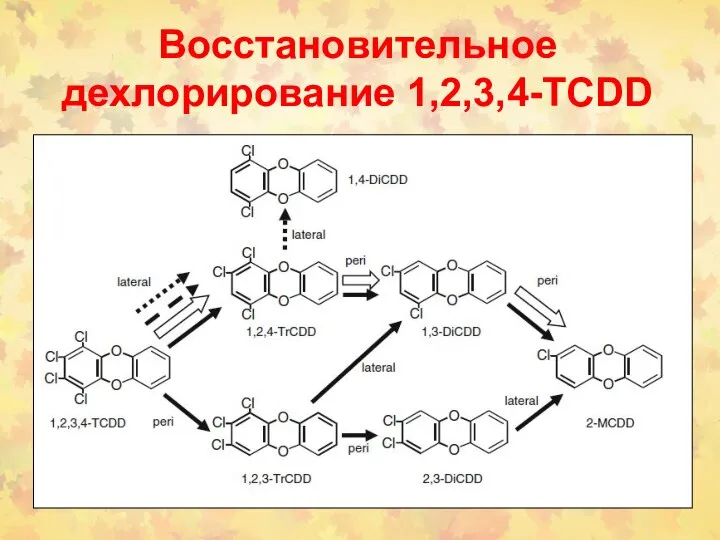
- 94. Восстановительное дехлорирование 1,2,3,4-TCDD
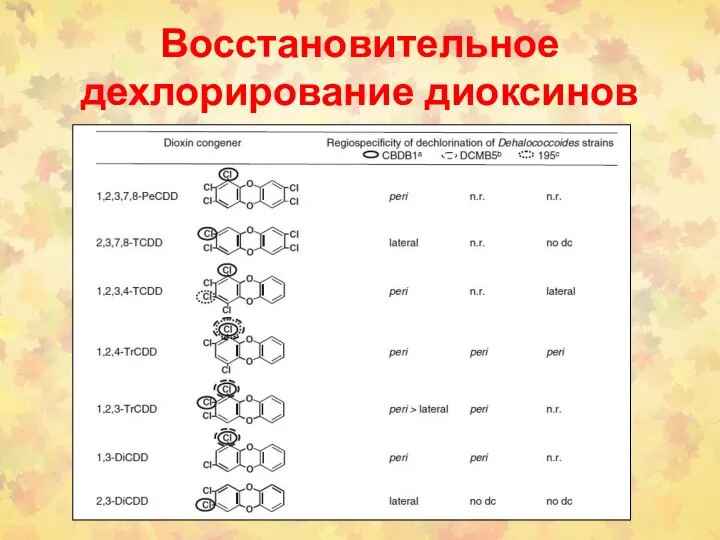
- 95. Восстановительное дехлорирование диоксинов
- 96. Токсические эффекты ТСDD (ТХДД) AHR/null мыши нечувствительны к ТХДД в дозе 2000 microg/kg (на порядок большей,
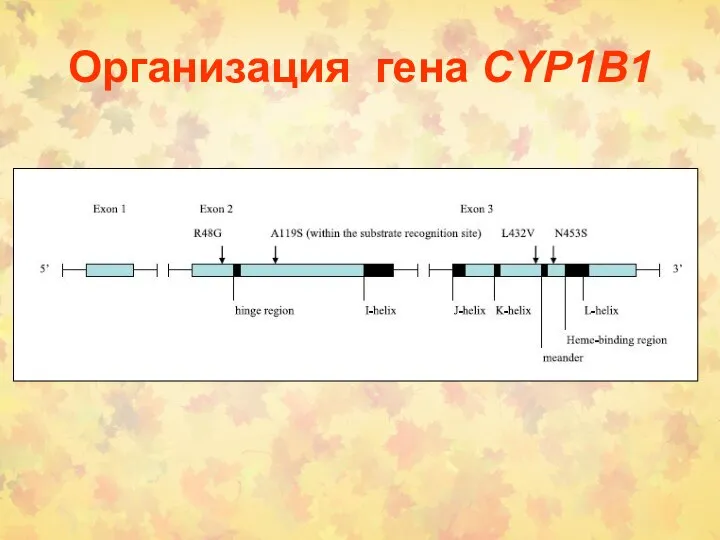
- 97. Организация гена CYP1B1
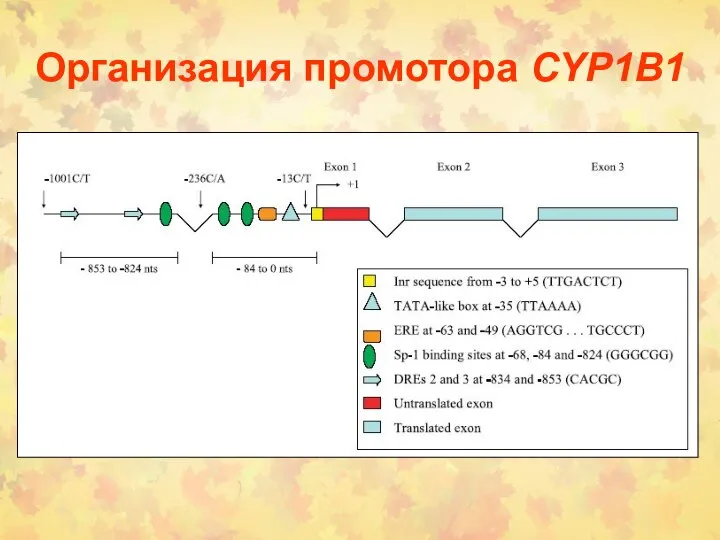
- 98. Организация промотора CYP1B1
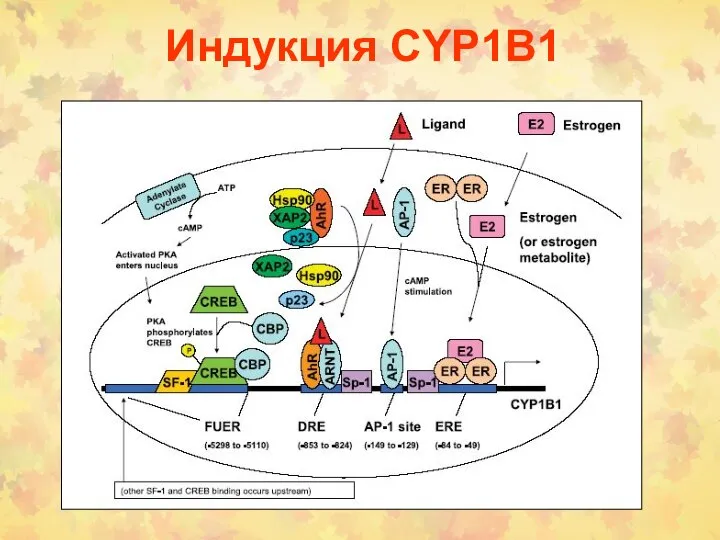
- 99. Индукция CYP1B1
- 100. CYP1B1 в метаболизме E2
- 101. CYP1B1 в метаболизме тестостерона
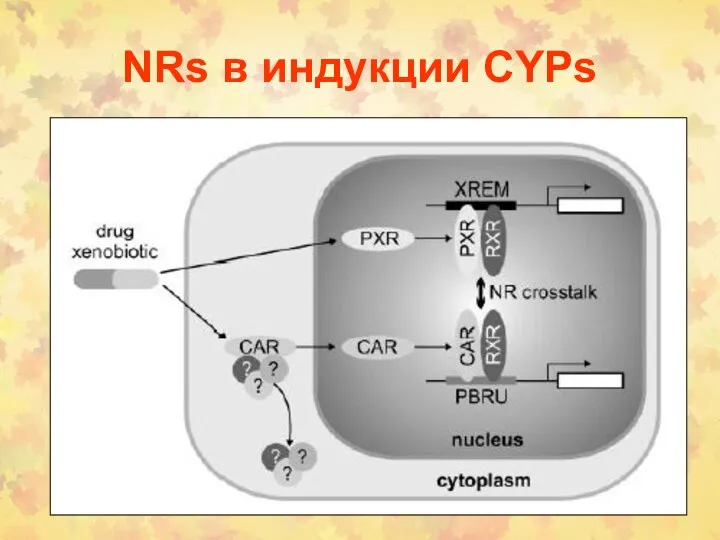
- 102. Ядерные рецепторы (NRs) в индукции CYPs
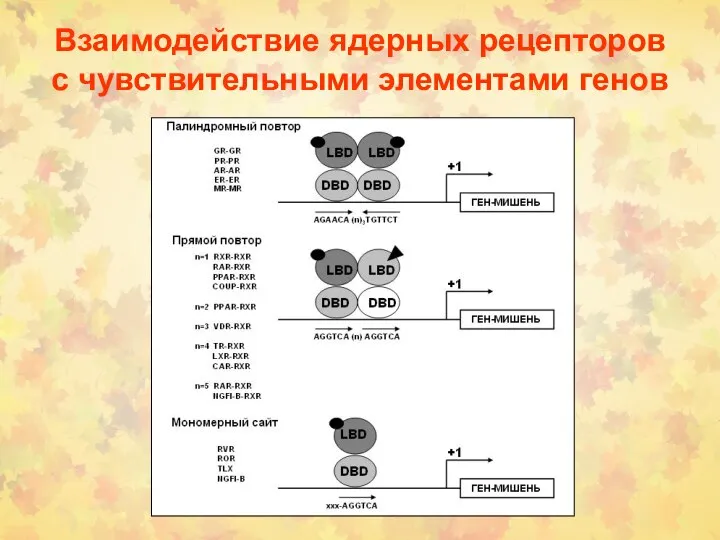
- 106. Взаимодействие ядерных рецепторов с чувствительными элементами генов
- 107. Участие белков-шейперонов в фолдинге ядерного рецептора и его активации
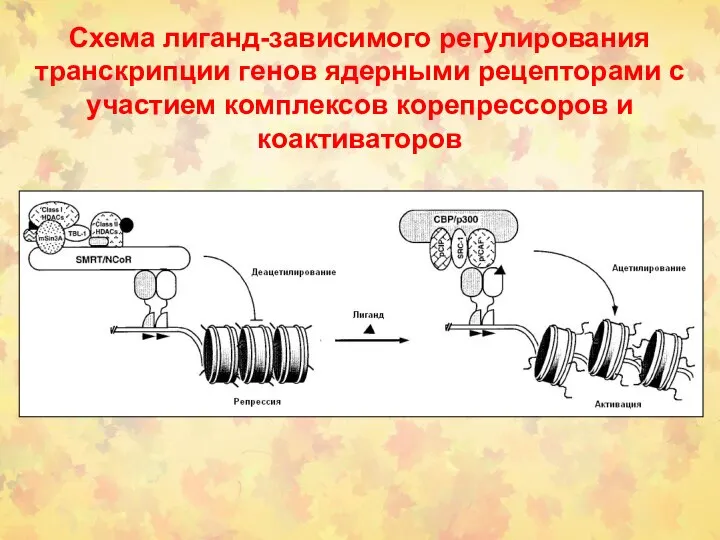
- 108. Схема лиганд-зависимого регулирования транскрипции генов ядерными рецепторами с участием комплексов корепрессоров и коактиваторов
- 109. Схема деградации ядерных рецепторов с участием убиквитин-протеасомного пути Е1 – активирующий фермент Е2 – фермент, осуществляющий
- 114. Механизмы индукции CYPs 2-го семейства
- 115. Индукторы CYP семейства 2
- 116. Другие индукторы ФБ-типа
- 117. Структура ядерного рецептора (NR)
- 118. Схема активации генов Р450 фенобарбиталом
- 119. ДНК элементы, найденные в гене CYP2B
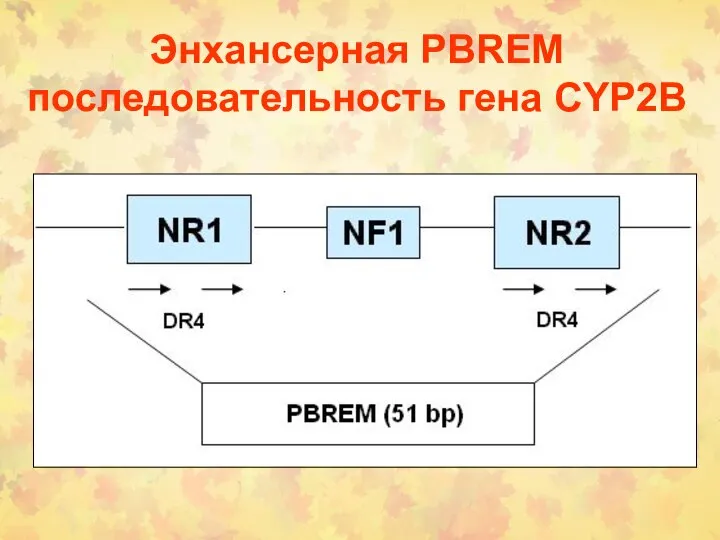
- 120. Энхансерная PBREM последовательность гена CYP2B
- 121. NRs в индукции CYPs
- 122. Индукция CYP3A Обе последовательности ER6 в проксимальном промоторе -170/-153 (PER6), XREM последовательность (расположена в 5'дистальной части
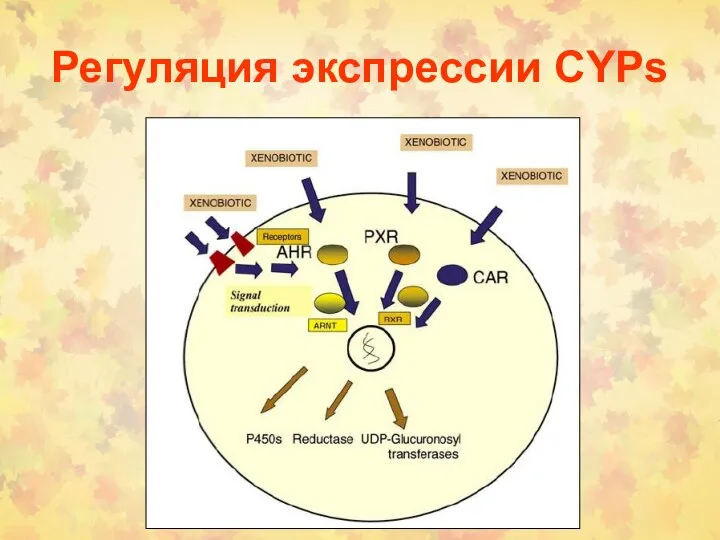
- 123. Регуляция экспрессии CYPs
- 124. Эволюция орфановых рецепторов
- 125. Механизмы индукции CYP2E
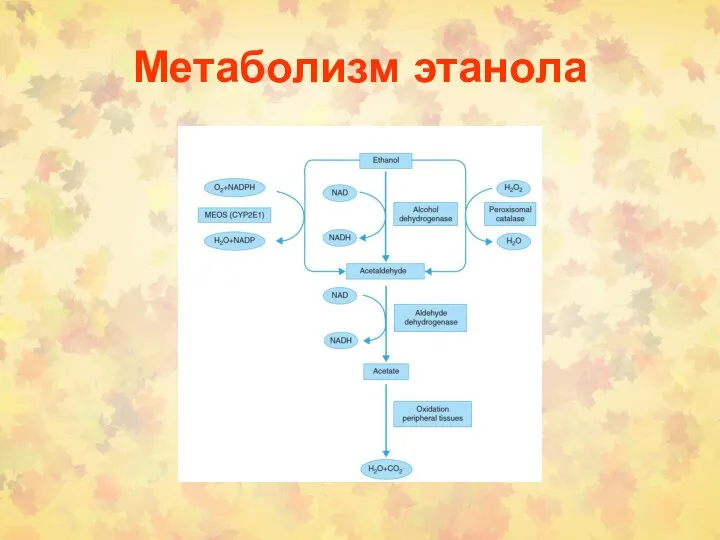
- 126. Метаболизм этанола
- 127. Метаболизм этанола
- 128. Алкоголь в крови человека ВАС (blood alcohol concentration): 0,05-0,1 г/л – kм АДГ близка к этой
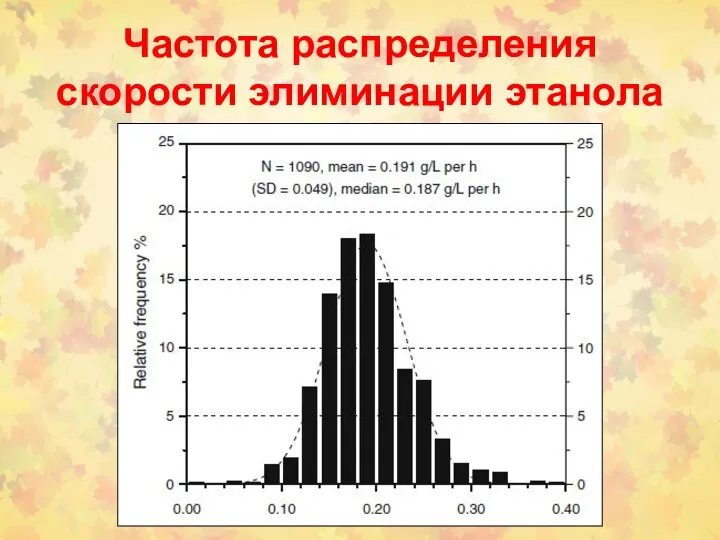
- 129. Частота распределения скорости элиминации этанола
- 130. Содержание СYP2Е1 в печени человека
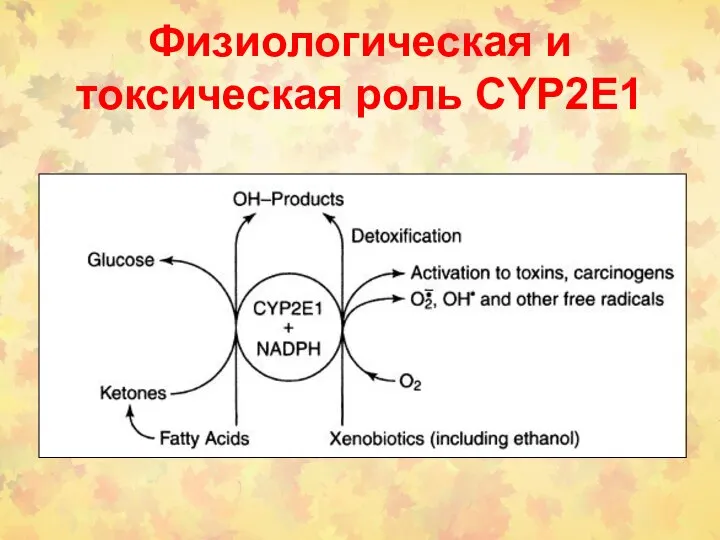
- 131. Физиологическая и токсическая роль СYP2Е1
- 132. СYP2Е1-зависимый окислительный стресс и токсичность AIF, apoptosisinducing factor; AP-1, activator protein-1; ARE, anti-oxidant-responsive element; ATP, adenosine
- 133. Индукторы и субстраты для CYP2E1
- 134. Регуляция активности CYP2E1
- 135. Транскрипционный механизм индукции liver enriched homeodomain-containing transcription factor nuclear factor 1 (Hnf1)
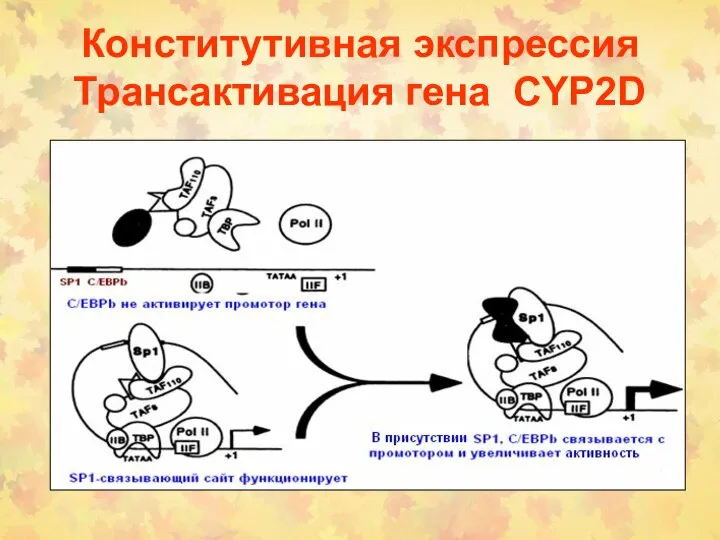
- 136. Конститутивная экспрессия Транcактивация гена CYP2D
- 137. Полиморфизм CYP2D 5-14% - кавказская раса 0-5% - африканцы 0-1% - азиаты - теряют активность CYP2D6
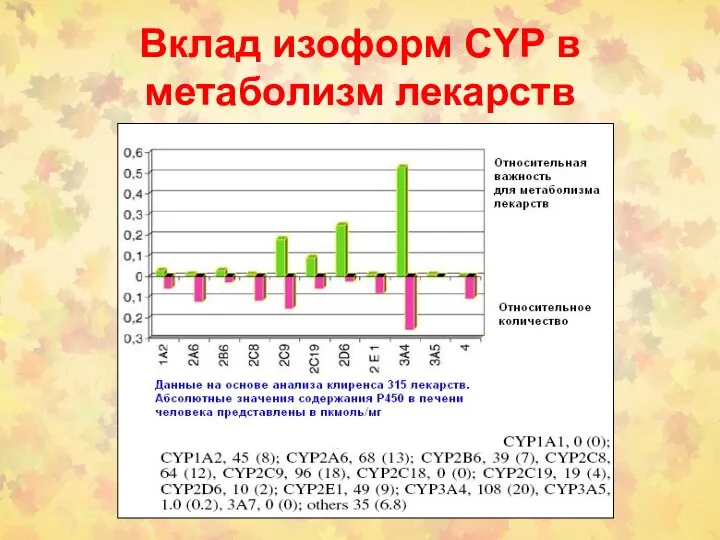
- 138. Вклад изоформ CYP в метаболизм лекарств
- 139. CYP и взаимодействие лекарство-лекарство
- 140. CYPs и рак
- 141. Р450 в метаболизме эндогенных субстратов - желчные кислоты - стероиды (синтез и распад) - жирные кислоты
- 142. Филогения микросомальных и митохондриальных СYPs Геном человека содержит 57 генов Р450, относящихся к 17 семействам. 7
- 143. Физиологические функции митохондриальных СYPs
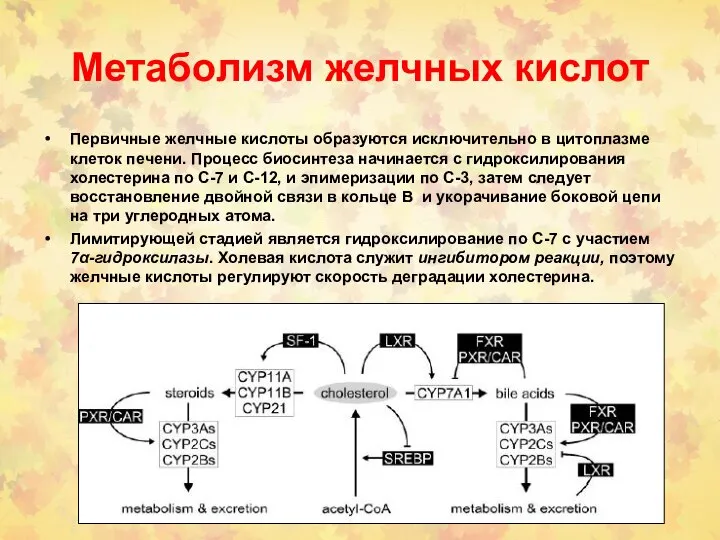
- 144. Метаболизм желчных кислот Первичные желчные кислоты образуются исключительно в цитоплазме клеток печени. Процесс биосинтеза начинается с
- 145. Метаболизм желчных кислот
- 146. Р450 в метаболизме стероидов
- 148. Основные этапы синтеза
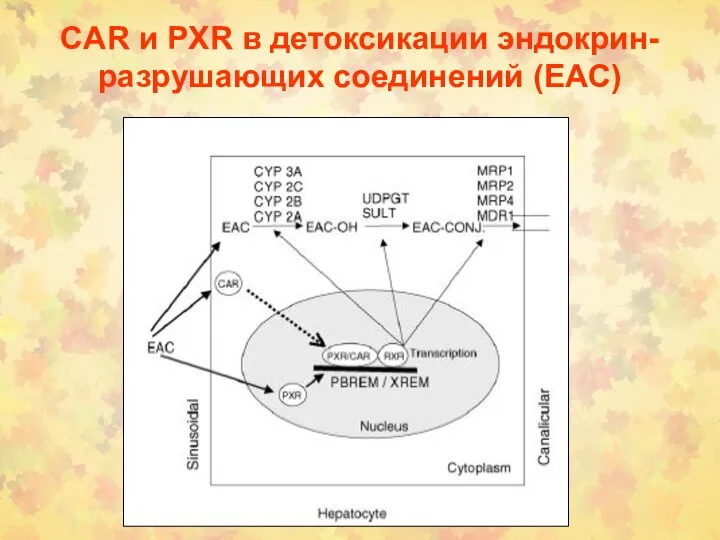
- 149. CAR и PXR в детоксикации эндокрин-разрушающих соединений (EAC)
- 150. CYP19 (Ароматаза) – ключевой фермент синтеза эстрогенов
- 151. Организация промотора ароматазы
- 152. мРНК ароматазы
- 153. Источники эстрогенов
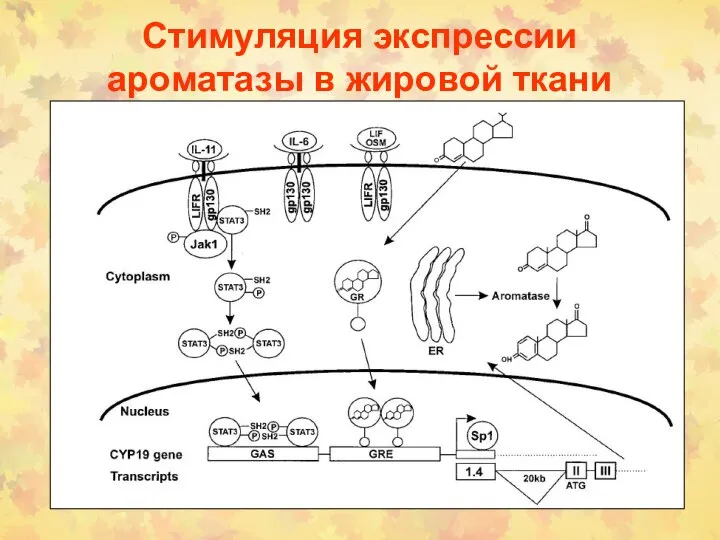
- 154. Стимуляция экспрессии ароматазы в жировой ткани
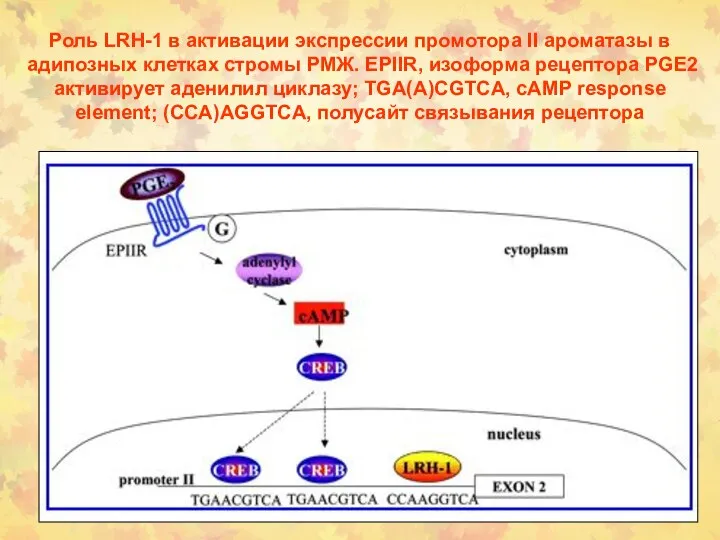
- 155. Роль LRH-1 в активации экспрессии промотора II ароматазы в адипозных клетках стромы РМЖ. EPIIR, изоформа рецептора
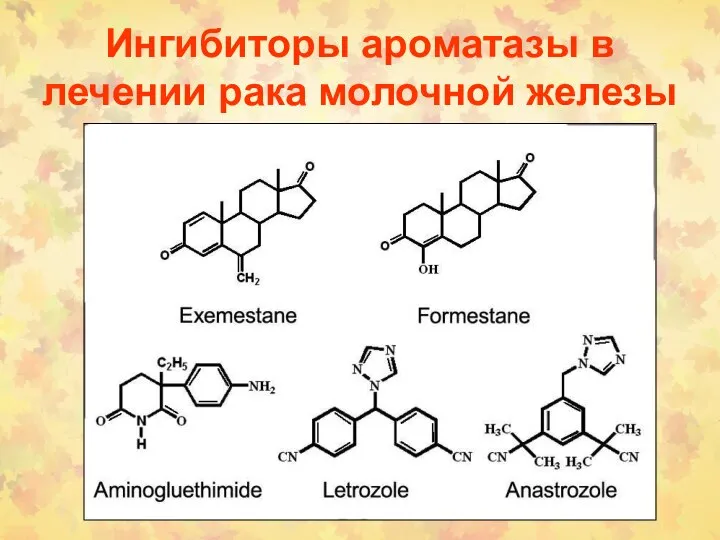
- 156. Ингибиторы ароматазы в лечении рака молочной железы
- 157. Эстрогеновые рецепторы в гормональном канцерогенезе
- 159. Взаимодействие между C18 и C19 стероидами в органах-мишенях
- 160. Эстрогены стимулируют клеточное деление
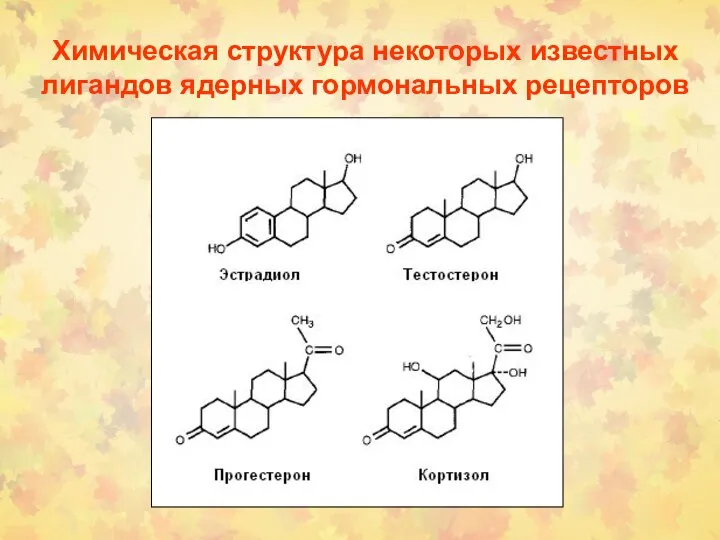
- 161. Химическая структура некоторых известных лигандов ядерных гормональных рецепторов
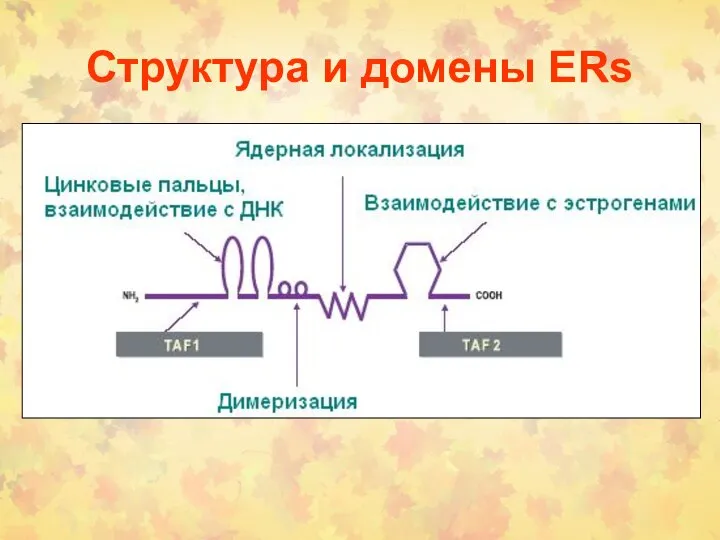
- 162. Структура и домены ERs
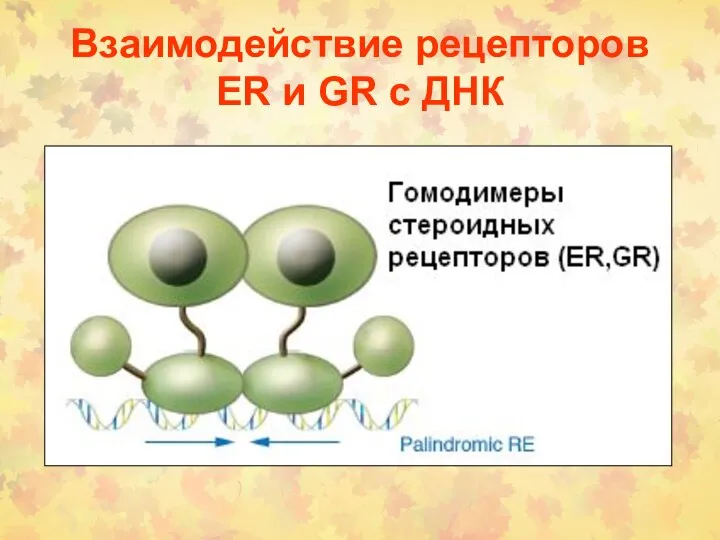
- 163. Взаимодействие рецепторов ER и GR с ДНК
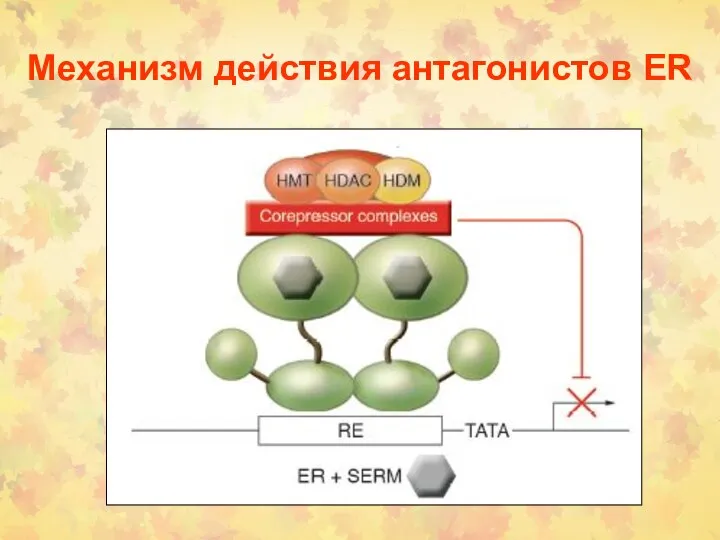
- 164. Механизм действия антагонистов ER
- 165. CYPs в метаболизме андрогенов
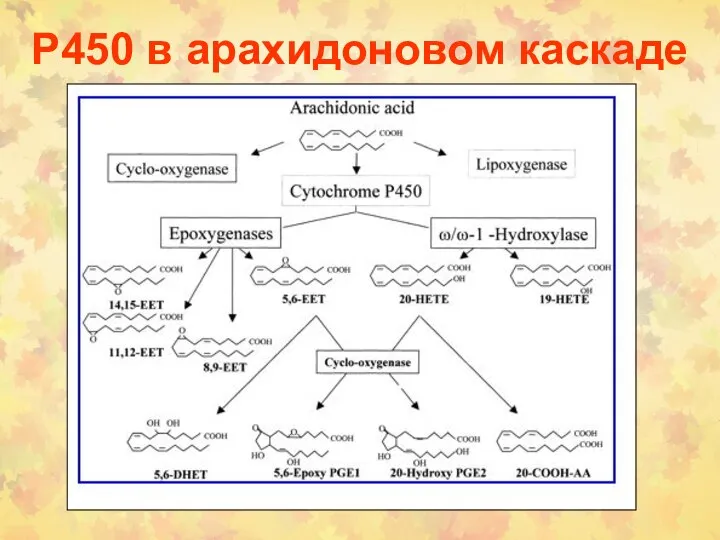
- 166. Р450 в арахидоновом каскаде
- 167. Эпоксигеназный путь СYPs
- 168. Кардиоваскулярные протективные эффекты CYP-эпокси-производных EETs
- 169. Антагонистические взаимодействия EETs и 20-НЕТЕ. Влияние на тонус сосудов
- 170. Коокисление КСБ (Х) во время конверсии АК в простагландины
- 171. Р450 и воспаление
- 172. Р450 в метаболизме жирных кислот. Роль PPAR
- 173. Метаболизм жирных кислот ω-окисление жирных кислот с последующим окислением приводит в конечном итоге к образованию дикарбоксильных
- 174. Окисление жирных кислот
- 175. Некоторые РР
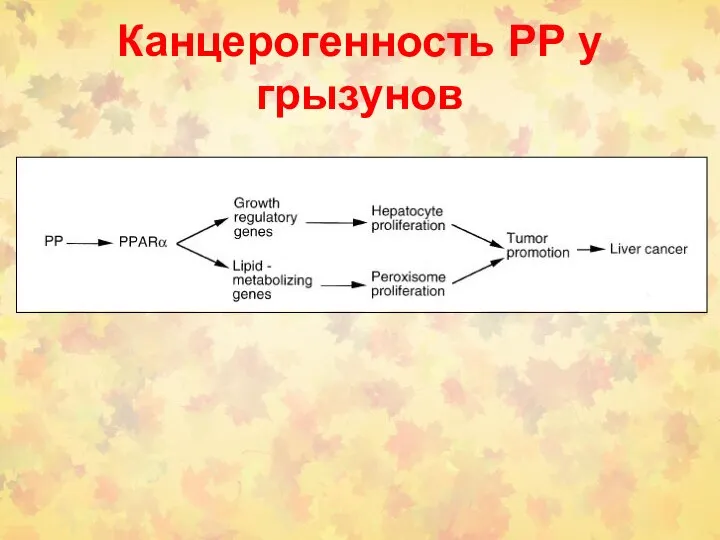
- 176. Канцерогенность РР у грызунов
- 177. Типы PPAR у грызунов
- 178. Механизм индукции CYP4A
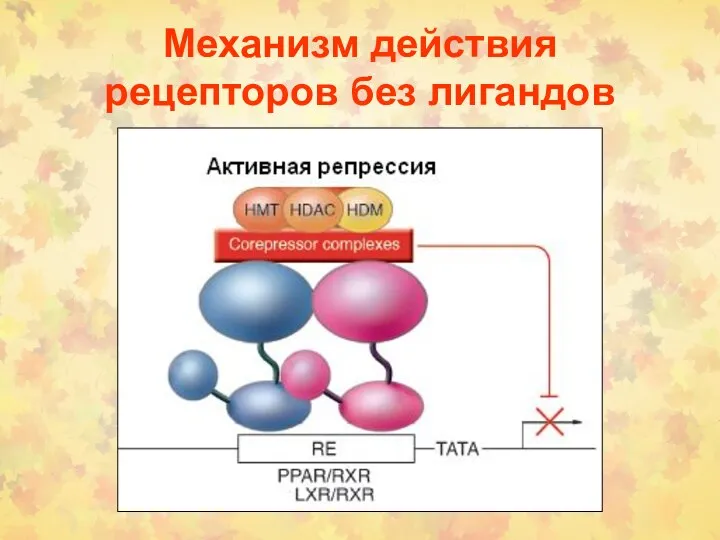
- 179. Механизм действия рецепторов без лигандов
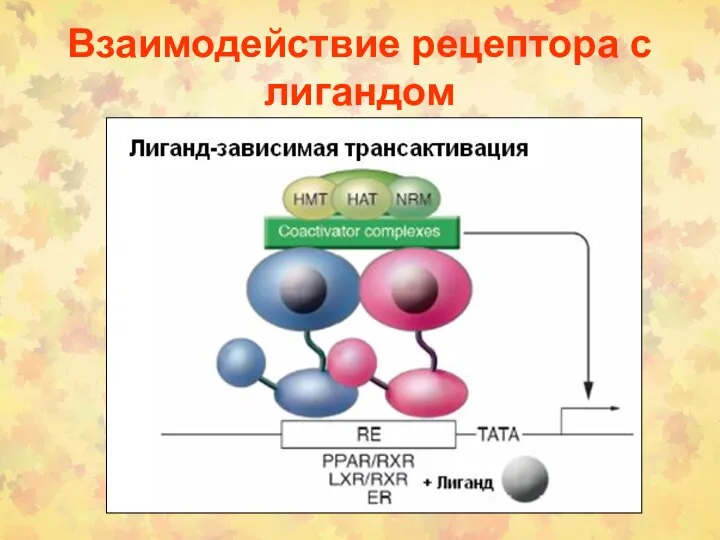
- 180. Взаимодействие рецептора с лигандом
- 181. Пути образования эндогенных лигандов PPAR
- 182. Р450 в метаболизме витамина D3
- 183. Cинтез и метаболизм витамина D
- 184. Р450 (CYP27A1, CYP2R1, CYP3A4 и CYP2J3) в метаболизме витаминов D
- 186. Скачать презентацию



























































































































 Курение табака. Можем ли мы остановить эпидемию?
Курение табака. Можем ли мы остановить эпидемию? Анемия
Анемия Мультифакториальные болезни. Лекция 6
Мультифакториальные болезни. Лекция 6 Реакция отторжения трансплантата
Реакция отторжения трансплантата Психологія, патопсихологія, психопатологія эмоційно-вольової сфери
Психологія, патопсихологія, психопатологія эмоційно-вольової сфери Лечебно-оздоровительный туризм Беларуси
Лечебно-оздоровительный туризм Беларуси Компьютерная зависимость
Компьютерная зависимость Группа когнитивно-поведенческой направленности Дневник чувств
Группа когнитивно-поведенческой направленности Дневник чувств Кәсіби бейімделу, кәсіби имидж, коммуникативті төзімділік
Кәсіби бейімделу, кәсіби имидж, коммуникативті төзімділік Дородовое наблюдение
Дородовое наблюдение СПИД – глобальная проблема
СПИД – глобальная проблема Лекция №11. Адренергические средства
Лекция №11. Адренергические средства Аборт, как социально-медицинская проблема. Классификация абортов
Аборт, как социально-медицинская проблема. Классификация абортов Заболевания придатков глаза, роговицы и склеры. Лекция №2
Заболевания придатков глаза, роговицы и склеры. Лекция №2 Охрана зрения
Охрана зрения Новый продукт компании Bepic для детей - GR8KIDS
Новый продукт компании Bepic для детей - GR8KIDS Сколиотическая болезнь клиника, диагностика, лечение
Сколиотическая болезнь клиника, диагностика, лечение Оптимизация терапии Helicobacter pylori-ассоциированной патологии верхних отделов желудочно-кишечного тракта у детей
Оптимизация терапии Helicobacter pylori-ассоциированной патологии верхних отделов желудочно-кишечного тракта у детей Психологическое здоровье. Критерии психологического здоровья. Способы укрепления.
Психологическое здоровье. Критерии психологического здоровья. Способы укрепления.  Виды хирургических инструментов. Правила их использования. Правила хирургических вмешательств
Виды хирургических инструментов. Правила их использования. Правила хирургических вмешательств Сердце. Профилактика сердечно-сосудистых заболеваний
Сердце. Профилактика сердечно-сосудистых заболеваний Қатты дәрілік түрлердің сапасын бағалау әдістері
Қатты дәрілік түрлердің сапасын бағалау әдістері Роль фельдшера в диагностике и лечении гастрита у детей
Роль фельдшера в диагностике и лечении гастрита у детей Профилактика дыхательной системы
Профилактика дыхательной системы Моделирование процесса психоречевого развития, как основа психолого-педагогического сопровождения детей раннего возраста
Моделирование процесса психоречевого развития, как основа психолого-педагогического сопровождения детей раннего возраста имобилизация и ее виды
имобилизация и ее виды Профессионально значимые качества личности специалиста
Профессионально значимые качества личности специалиста Көптік салыстыру статистикасы. Бонферрони түзетуі
Көптік салыстыру статистикасы. Бонферрони түзетуі